简介
一氧化二氮,化学分子式N₂O,俗称“笑气”,因其吸入后会使人发笑得名。有轻微的麻醉作用,最早在口腔医学领域被用作麻醉剂。短期内超量摄入可能导致人体缺氧而窒息死亡,长期吸食则可能引发高血压,晕厥甚至心脏病发作。
在汽车领域,N₂O之前一直以助燃剂的方式被大家所熟知。在赛车中,N₂O以液态形式注入,气化过程中冷却了发动机的进气,使得发动机的进气量增加,这样能够多喷油以提高发动机的功率。同时在缸内的高温高压环境下,N₂O进一步分解出N₂和O₂,其中O₂进一步增加缸内的氧含量参与燃烧,而N₂可以起到限制燃烧温度的作用,抑制爆震的发生。这种方法最早是纳粹在飞机上使用的,后来才被应用到赛车领域中的。
近期N₂O又重新进入大家的视野是因为国六排放法规新增了N₂O的限值,如图1所示。为什么要增加这种排放物呢?国六标准编制说明中给出了解释,简单的说就是因为《大气污染防治法》规定要求管控温室气体,所以应该在新标准中增加CO₂和N₂O的限值,但由于CO₂已经在油耗标准中间接控制了,所以就没有新增加CO₂的限值,而对于N₂O,在参考了美国温室气体排放标准限值和部分试验验证数据情况下,同时考虑到是第一次加这个限值并且试验验证次数有限,先定了个比较宽松的限值。从图1可以看出来,国6b中规定的N₂O限值为20mg/km[1],而国六法规的标准编制说明中给出的的部分试验数据表明,汽油车的N₂O排放只有2mg/km左右,即对汽油车来说,20mg/km限值的规定还是相对宽松的。
作为《京都议定书》规定的6种温室气体之一,N₂O在大气中的存留时间长,可达100-200年。和CO₂相比,其全球变暖潜势是CO₂的298倍。以往大气N₂O的关注重点为农田生态系统,但随着温室效应形式的越发严峻,及全球车辆保有量的巨大基数,越来越多人将目光投到汽车尾气的N₂O排放中来。

图1. 国6b排放限值
检测方法
2.1
气相色谱-电子俘获检测器联用仪法
气相色谱-电子俘获检测器联用仪法(GC-ECD)为国六法规中规定的N₂O测量方法,其中气相色谱是一种分离的方法,电子俘获检测是一种检测的方法。色谱法又叫层析法,它是一种物理分离技术。它的分离原理是使混合物中各组分在两相间进行分配,其中一相是不动的,叫做固定相,另一相则是推动混合物流过此固定相的流体,叫做流动相。当流动相中所含的混合物经过固定相时,就会与固定相发生相互作用。由于各组分在性质与结构上的不同,相互作用的大小强弱也有差异。因此在同一推动力作用下,不同组分在固定相中的滞留时间有长有短,从而按先后顺序从固定相中流出,这种借在两相分配原理而使混合物中各组分获得分离的技术,称为色谱分离技术或色谱法。当用液体作为流动相时,称为液相色谱,当用气体作为流动相时,称为气相色谱。图2为样品在色谱柱内分离的示意图。
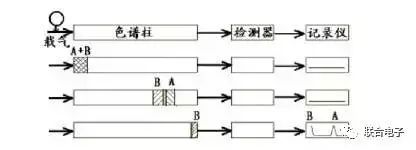
图2.样品在色谱柱内分离示意图
如图2所示,当样品进入色谱柱时,组分A、B以一条混合谱带出现,由于组分B在固定相中的溶解能力比A大,因此组分A的移动速度大于B,经过多次反复分配后,在固定相中分配系数较小的组分A首先被带出色谱柱,而在固定相中分配系数较大的组分B则更迟被带出色谱柱,于是样品中各组分达到分离的目的。设法将流出色谱柱某组分的浓度变化用电压、电流信号记录下来,便可逐一进行定性和定量分析。
组分能否分开,关键在于色谱柱,分离组分后能否鉴定出来,关键在于检测器。ECD就是一种灵敏度很高的气相色谱检测器。
ECD的原理是:由色谱柱流出的载气及吹扫气体进入ECD池,在放射源放出β-射线的轰击下被电离,产生大量电子。在电源、阴极和阳极电场作用下,该电子流向阳极,得到基流。当电负性组分从柱后进入检测器时,即俘获池内电子,使基流下降,产生一负峰。通过放大器放大,在记录器记录,即为响应信号。
2.2
量子级联激光器法(QCL)
QCL(Quantum Cascade Laser)量子级联激光器法,可用于测量汽车尾气中的极低N₂O排放(小于5ppb量级)。和常规气态污染物(HC、CO、NOX等)相比,N₂O在汽车尾气中的含量本身偏低,加之CVS系统的稀释,在气袋中的N₂O含量已经很低。加之测量本身是需要背景气体校验的,而空气中含有N₂O的浓度已经低至320ppb(十亿分之一),这就给测量带来了很大的难度。在不久的将来,DAR(Dilution air refinement)系统的采用,稀释空气还需要进一步的净化,背景气体中N₂O的含量进一步降低,这就给N₂O的检测精度提出了更高的要求。
其主要原理如图3所示,气室中含有N₂O等气态污染物,激光射入后经过多级反射后被检测器检测到,光谱中特定的波段被N₂O吸收,反映为入射光光强的减弱,通过计算可将其转化为N₂O的特征吸收光谱,再利用比尔定律可以计算出N₂O的浓度。经过实验验证该方法具有较高的线性度和可重复性[3]。
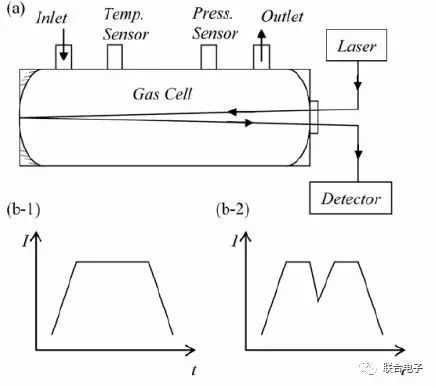
图3.QCL原理简图
生成及分解机理
3.1
缸内生成及分解机理
N₂O的缸内生成机理较为复杂,可以简化为燃烧初期、中期及末期三个阶段。
初期: HCN+O→NCO+N NCO+NO→N₂O+CO
中期: NO+H→HNO 2HCNO→N₂O+H₂O
末期: 2NO+CO→N₂O+CO₂
燃烧室内N₂O的分解主要是在燃烧中后期,此时缸内燃烧温度超过2000℃,但由于燃烧持续时间较短,此时未完全燃烧的CO、OH等还原性分子将N₂O还原成N₂。
3.2
三元催化器中的生成及分解机理
温度较高时,NO可以直接被还原为N₂,但在温度较低时,NO以及CO等分子会吸附在催化剂表面,此时NO被部分还原为N₂O,各种分子吸附在催化剂表面上的化学方程式可以表示为:
NO+NO•M→N₂O+O•M
2NO+CO•M→N₂O+CO₂+M
其中M表示为催化剂中的活性部位,NO•M表示为催化剂中吸附的NO。
当温度在400℃或者更高时,三元中的活性物质能够降低CO等还原剂的活性能,从而使N₂O被催化还原为N₂。相关化学反应式为:
N₂O+M→N₂+C•M
2O•M→O₂+2M
N₂O+O•M→N₂+CO₂
排放控制
4.1
空燃比对N₂O排放的影响
《通用小型汽油机N₂O形成机理及影响因素》中将节气门全开,采用不同的空燃比来分析对CO、N₂O、NO生成的影响[4]。其结果如图4所示。

图4.节气门全开时空燃比对CO、N₂O、NO的影响
从图4可以看出随着空燃比偏稀,N₂O的生成水平逐渐降低。原因是随着空燃比偏稀,CO及HC等还原性物质减少,使N₂O降低。空燃比偏稀,NO增大,但N₂O没有跟着增大,说明NO较难自行分解为N₂O,需要额外的催化剂作用才行。这也说明了同一工况下,混合气中还原性物质含量对N₂O的形成有较大的影响,通过调节混合气浓度,控制CO等还原性物质的含量可以控制N₂O的生成。
4.2
催化器成分及老化对N₂O排放的影响
一个比较有意思的现象就是,在采用三元催化器以前,N₂O的排放反而比较低,如表1所示,这说明N₂O在缸内生成的量其实并不高,主要还是产生于三元催化器中的催化反应。
但随着排放水平的升高,N₂O的排放因子也是逐渐降低,符合当今越来越严的减排要求。
表1. 轻型汽油车N₂O排放因子比较[2]
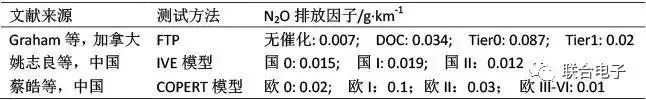
注:DOC即后处理装置为氧化催化净化器,介于国0和国I之间;Tier0为美国第0阶段,相当于国I阶段;Tier1为美国第一阶段,相当于国II、国III阶段
《Reduction of N₂O from Automobiles Equipped with Three-Way Catalyst-Analysis of N₂O Increase Due to Catalyst Deactivation》文献中分析了三元催化器的成分和老化对N₂O的形成和分解的影响[5]。图5是不同配方成分的三元催化器(新鲜和老化)在不同温度下的N₂O生成特性曲线。将配好的和汽车尾气成分大致相当的,不含N₂O的气体以固定流速通过不同配方的催化器来研究N₂O的生成特性。可以看出来,对新鲜催化器而言,高配方的催化器在相同温度区间内N₂O的生成量要远大于低配方催化器,峰值生成量相差近三倍。同时高Pd含量的催化器会让N₂O生成的温度区间范围扩大,且峰值生成点会降低为200℃。而对老化催化器而言,催化器配方的高低对N₂O生成的影响不大。对含Pd的老化催化器来说,催化器老化会使得N₂O生成的峰值温度点升高100-200℃。
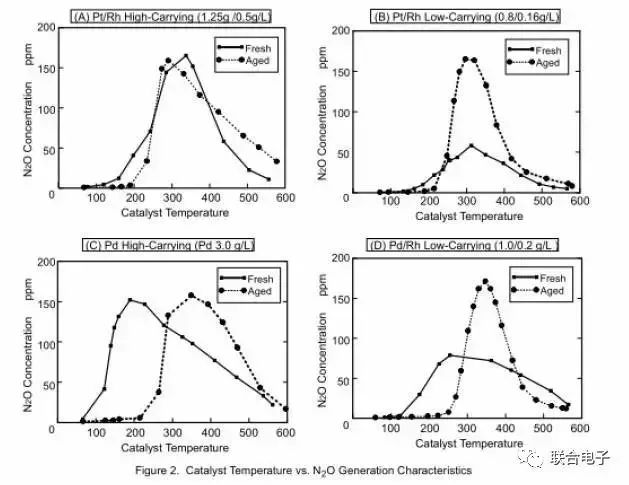
图5. 不同催化器温度下的N₂O生成特性
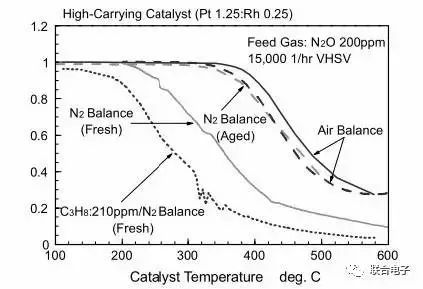
图6. 高配方三元催化器的N₂O转化特性曲线
图6是为了研究N₂O的分解,将不同成分配比的含有200ppm N₂O的混合气体通过高配方Pt/Rh催化器。图中Air Balance意味着N₂O用正常的空气来稀释,N₂ Balance即稀释气体为N₂,C3H8/N₂ Balance 即稀释气体为丙烷和N₂。可以看出来,对新鲜催化器而言,用正常空气稀释的含有200ppm N₂O的气体在大概400℃时才发生分解,到达600℃时仍然有30%的N₂O残留。但用N2稀释的混合气在200℃时N₂O就发生分解,且600℃时仅有10%的N₂O残留,而掺杂了一定量C3H8的混合气在100℃左右就开始发生分解,到达600℃时N₂O几乎没有残留。这说明O₂的减少和HC化合物的增加都对N₂O的分解更加有利。而对老化催化器而言差别不大。
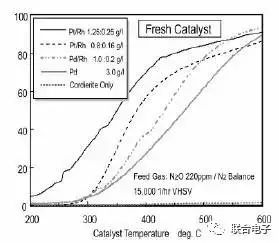
图7.不同配方新鲜催化器N₂O转化特性
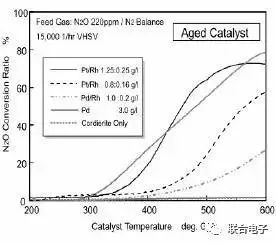
图8.不同配方老化催化器N₂O转化特性
从图7可以看出来,不同配方的新鲜催化器在200℃和600℃对N₂O的转化效率都是差不多的,但在300-400℃之间有较大的差别,而这段温度区间却也是发动机常用工况的高频温度区间。该温度区间内N₂O的转化效率和催化器配方高低并没有明显的趋势关系。
图8则反映了老化催化器的表现,随着催化器的老化,各种配方的催化器转化效率都大为降低。N₂O在较低的温度下生成,在较高的温度下被转化。老化催化器的N₂O排放高在于,在较低温度时生成量更多,而在较高温度时的转化能力下降。但总体而言,高配方催化器老化对N₂O转化效率的影响要小于低配方催化器。
Noriyuki Koike还提出了一种较为理想的低NOX排放的催化器形式:一种复合型的催化器,前级用高N₂O生成的配方,后级用高N₂O分解的配方,这样在前级通过N₂O的生成可以有效降低NO的含量,而多出来的N₂O在后级被分解掉,从而达到降低NOX的目的。这种催化器可以用于稀燃发动机。
4.3
催化器温度对N₂O排放的影响
《N₂O Emissions from Vehicles Equipped with Three-Way Catalysts in a Cold Climate》中给出了一个结论,即搭载有三元催化器的汽车的N₂O排放和催化器的催中温度显著相关[6]。图9为N₂O随催化器温度的生成及分解特性曲线。
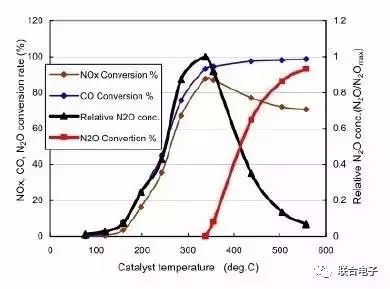
图9.N₂O随催化器温度的生成及分解特性
我们把常规气态污染物转化率达到50%的温度称之为T1, 达到90%转化率的温度称之为T2。 那么从图9中可以看到T1大概是250℃,T2大概是350℃。但是在T2温度之后N₂O才开始慢慢被转化。也就意味着在T2之前,N₂O几乎等效是一个只形成不分解的过程。图中黑线为N₂O的相对浓度,即N₂O/N₂Omax。可以看出来,N₂O基本在150℃以后才开始形成,随后随着温度急剧上升,大概在320℃左右达到顶峰。随后随着温度升高,N₂O开始分解,其相对浓度也逐渐下降。因而可以简单地认为当催化器温度位于(T2-T1)区间内时,是N₂O大量产生的时刻。停留在该温度区间内的时间越长,其N₂O的排放越高。
通过这个特性,假设试验时长为T,即之后的研究可以利用催化器在升温过程中的(T2-T1)/T 来评估不同试验过程中N₂O的排放高低。
-
发动机
+关注
关注
33文章
2473浏览量
69276 -
汽车发动机
+关注
关注
0文章
62浏览量
9569
发布评论请先 登录
相关推荐
晶圆表面污染及其检测方法
退役电动汽车锂电池正极材料的直接再生策略—去除残留污染物的关键作用
废气监测数据对接到环保局平台(HJ212传输)解决方案
高温烟气湿度仪中的测量高温烟气湿度的传感器推荐
「工业物联网」——工业烟气排放监测远程数据采集系统
排污监测物联网系统,数据共享,部门联动
PM2.5传感器监测汽车尾气颗粒物的必要性

水环境标准监测站能否准确检测微量污染物?
浅谈河南省餐饮油烟污染监测解决方案
监测海洋污染物的传感器分类与应用
SMT行业痛点不再是困扰!





 国六N₂O排放污染物
国六N₂O排放污染物












评论