(文章来源:小材科研)
自组装聚合物胶束作为多功能药物递送系统的应用已受到广泛关注,已有种类繁多的聚合物胶束给药系统进入临床实验或被FDA批准使用。然而,它们的治疗效果并没有达到预期,主要原因之一在于大多数聚合物胶束不能承受高倍稀释及与血液成分的相互作用,导致药物的提前暴释和非特异性体内分布。
物理或化学交联是改善自组装体稳定性的最直接方法,但其同时也降低了纳米系统的响应性和释放速率。聚合物胶束的物理或化学交联已成为克服组装物固有不稳定性的直接方法,然而,交联过程可能会损害纳米系统的响应性,导致有效载荷的释放效率低下因此,聚合物自组装体的稳定和响应仍是纳米载体领域存在的矛盾难题。
为了解决该问题,四川大学高分子材料学院丁明明、谭鸿和傅强教授提出一种交联诱导再组装(CIRA)策略,该策略可同时提高聚合物胶束的动力学和热力学稳定性以及还原响应性。该研究团队设计并合成可点击的多嵌段聚氨酯(MPU),其主链含有二硫键,侧链具有可点击的活性位点。进一步利用聚合物胶束界面层的点击交联化学反应驱动聚合物再组装,诱导聚氨酯的软段和硬段发生相分离,将聚合物胶束内核中的刺激敏感基团迁移到界面,形成可逆稳定的二硫交联层。
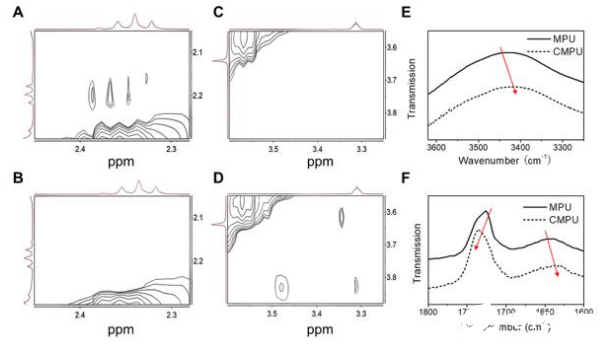
CIRA功能化能够显著提高聚合物胶束的热力学和动力学稳定性、刺激响应性,在体内外实现灵敏的药物控释开关。因此,CIRA方法能够有效增强肿瘤靶向,改善药物生物分布并获得出色的肿瘤抑制效果。该工作为高分子自组装结构调控提供新方法,并为药物传递提供了具有应用潜力的多功能纳米平台。
为了验证CIRA的基本概念,研究团队首先合成了一个可点击的多功能聚氨酯(MPU)。聚合物是由可降解聚(ε-己内酯)(PCL)、可断裂的聚乙二醇链接含有pH敏感的苯甲酸亚胺键(BPEG)、L-赖氨酸乙酯二异氰酸酯(LDI)以及L胱氨酸(Cys - PA)生成的可还原扩链剂。制备的MPU可以自组装成直径约为53nm的带负电荷的胶束。该结构为球形核-壳结构,其疏水核心由不溶性PCL软段构成,周围为可酸分离的亲水BPEG晕。硬节段主要分布在亚表面,由于邻近的疏水软节段,部分仍分布在胶束核内。在聚合物胶束形成后,界面上的炔位可以通过点击化学作用使目标配体或壳层交联。
为了实现可逆交联和点击交联,团队设计并合成了一种还原亲裂交联剂(SSAz)所得到的交联剂包含一个二硫键和两个叠氮化物位点,允许在水溶液中使用铜催化的烷基-叠氮化物环加成(CuAAC)有效地交联MPU胶束。在交联后,胶束尺寸从53nm增加到111nm,这可能是由于自组装结构的改变或重新聚合的存在。利用静态光散射(SLS)测量了胶束的质量-平均分子量。CMPU胶束的计算聚集数(Nagg)几乎是MPU胶束的两倍。这个结果暗示了可能是胶束间的交联导致了胶束的重新聚集,有而产生微观相分离。
进一步研究CIRA对于高分子纳米材料生物学性能的影响,以抗肿瘤应用为模型,发现CIRA功能化的胶束能够显著提高纳米系统的稳定性,实现灵敏的药物控释开关,从而延长药物循环时间,改善药物组织分布,在体内外实现良好的抗肿瘤效果。该工作为高分子自组装行为提供了新的理解,并为多功能纳米药物载体的设计提供新思路。
综上所述,该团队开发了一个多功能的聚氨酯模型,其主链上有二硫键,侧链上有可点击的活性位点。聚合物在水溶液中自组装成核-壳胶束,并在软段和硬段之间进行了交联诱导再组装和微相分离。由于在胶束界面上发生了简单的点击反应,CIRA推动了二硫键从内芯向胶束亚表面的迁移。因此,可以同时提高胶束的热力学稳定性和氧化还原反应性,从而增强肿瘤靶向性、特异的细胞内药物传递,并在体内外获得良好的治疗效果。该工作为大分子的自组装提供了一个新的视角,并为为多功能纳米药物载体诊疗应用提供了一个有前途的纳米平台。
(责任编辑:fqj)
-
纳米技术
+关注
关注
2文章
201浏览量
25825 -
高分子
+关注
关注
1文章
34浏览量
10989
发布评论请先 登录
相关推荐
汽车高分子材料光老化试验方法汇总

高分子半导体的特性与创新应用探索
光伏组件EVA胶膜(DSC法)交联度测试
村田贴片电容超小尺寸(1411)导电性高分子铝电解电容器

搪瓷釜脱瓷严重漏介质,用高分子复合材料轻松修补

忆阻器诱导的超混沌、多涡旋和极端多稳态小数阶HNN:镜像加密和FPGA实现
高分子基柔性电容式压力传感材料的研究进展综述
骏鼎达今日上市,专注高分子改性保护材料
高分子聚合(PPTC)设备如何提供必要的过热和过电流保护
直播预告 | 松下导电性高分子聚合物SP-Cap电容JX/KX系列

精轧机AGC油缸与牌坊配合面出现磨损?为你详细解析如何快速修复





 多嵌段高分子交联诱导胶束再组装并实现药物智能释放开关
多嵌段高分子交联诱导胶束再组装并实现药物智能释放开关












评论