目前市场上锂离子电池使用的多为石墨负极材料,从石墨的比容量和压实密度看,负极材料的能量密度很难再得到提高。与石墨负极相比,硅基负极材料的能量密度优势明显。石墨的理论比容量为372mAh/g,而硅基负极材料的理论比容量超过其10倍,高达4200mAh/g。硅碳复合材料能够大大提升单体电芯的比容量,增加电动汽车续航里程。
硅基负极材料也存在着较为明显的缺点,主要有以下两方面:其一是硅颗粒在脱嵌锂时伴随着体积膨胀和收缩而导致颗粒粉化、脱落,造成结构坍塌,最终导致电极活性物质与集流体脱离;其二是硅颗粒表面固体电解质层(SEI)的持续生长对电解液以及来自正极的锂源的不可逆消耗。由于硅基负极材料的体积效应,硅在电解液中难以形成稳定的固体电解质界面膜。伴随着电极结构的破坏,在暴露出的硅表面不断形成新的SEI膜,加剧了硅的腐蚀和容量衰减。因此,为了提高硅基负极材料的电化学性能,系统研究电解液添加剂在硅负极表面的作用机理是十分必要和迫切的。
本文针对硅基负极材料的特点,研究不同成分电解液对硅负极表面成膜的影响及其作用机理,通过不同添加剂的配合使用提升硅碳负极的电化学性能。选用膨胀相对较小的氧化亚硅(SiO)混掺石墨作为负极材料,对SiO-C/Li扣式半电池进行充放电测试、成膜机理及形貌分析、NCM/SiO-C软包电池常温循环测试。
一、实验
1.1 极片制作
正极:以镍钴锰(NCM)三元材料为正极材料,使用油系PVDF为正极粘结剂,导电剂使用Super-P, 使用吡咯烷酮(NMP)为溶剂,按照一定比例混合成正极电极浆料。
负极:以SiO混合石墨制成硅碳负极,使用水系SBR为负极粘结剂,导电剂使用Super-P,使用蒸馏水为溶剂,按照一定比例混合成负极电极浆料。
将正负极浆料分别均匀涂覆在铝箔、铜箔表面上烘干,经过碾压、裁切、烘干,制成实验所需极片。
1.2 扣式电池制作
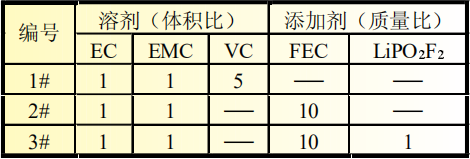
在充满氩气的手套箱中组装SiO-C/Li半电池,其中金属锂片为电池级(上海产),滴入适量电解液,加入隔膜,制成扣式电池,型号为CR2032。电解液溶剂组分为EC∶EMC=1∶1,添加剂为VC、FEC、LiPO2F2(具体配比见表1)。
表1 三种电解液成分对比
1.3 软包电池制作
以NCM极片为正极片,SiO质量分数为5%的SiO-C极片为负极片,极片经制片、卷绕、注液、预处理、铝塑膜封口等,制作出软包电池,标称容量为4Ah。
1.4 性能测试
1.4.1 扣式电池测试
SiO-C/Li半电池:极片在恒温真空干燥箱中干燥12h,于手套箱中组成正极半电池,电池型号为CR2032,在手套箱中封口取出,25℃常温下静置12h后待用。以0.05C恒流充放电进行容量标定。
1.4.2 成膜测试
SiO-C/Li扣式半电池以0.01C恒流放电, 截止电压为0.005V,静置10min。
1.4.3 循环测试
软包电池循环测试流程:1C恒流充电至4.2V,恒压充电至截止电流为0.005C,静置10min,1C恒流放电至电压降为3V,静置10min,以此做充放电循环测试。
1.5 测试设备
容量和循环性能测试采用Arbin BT2000电池测试系统。用扫描电镜对循环后硅碳负极片表面微观形貌进行观察,扫描电镜为日本电子公司JSM-6360LV型。
二、结果与讨论
2.1 添加剂对硅负极容量的影响
扣式电池采用三种电解液配方(电解液配方见表1)。测试电池电性能,不同电解液体系下扣式电池首次充放电比容量及首次库仑效率对比见表2。
表2 三种电解液样品电池充放电比容量对比
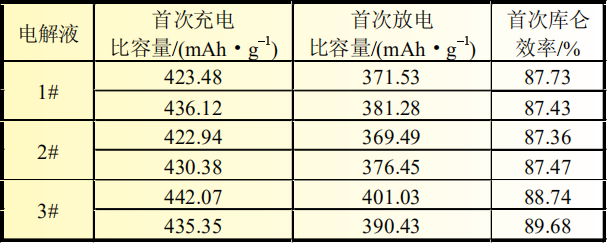
扣式半电池循环5次后,在手套箱中将其负极片取出,用流动的EMC进行冲洗,清洗后待EMC挥发完全后,将极片装入自封袋中,进行后续硅碳负极形貌扫描。从表2硅碳负极放电比容量测试结果可以看出,加入5%的SiO可以有效提高负极比容量,3#电解液体系比容量可以达到395.73mAh/g,说明3#添加剂在负极片上成膜更为完全、致密,成膜阻抗更低,有利于降低不可逆容量损失。三种电解液首次库仑效率排序如下:3#>1#>2#, 其中1#电解液和2#电解液对硅碳负极的比容量和首次库仑效率影响差别不大。
图1 不同电解液体系循环后硅碳负极表面形貌图
图1为不同电解液体系作用下硅碳负极表面形貌图,图中白色颗粒为SiO,灰色颗粒为石墨颗粒。从三张图片中均可看出,当SiO-C/Li扣式半电池循环5次后,硅碳负极片表面已经明显生成裂纹,这是由于在电化学循环过程中,锂离子的嵌入和脱出会使硅材料体积发生膨胀与收缩,产生的机械作用力会使材料结构变化,甚至坍塌。因此,随着循环的进行,硅颗粒周边易形成缝隙,从形貌上来看,即表现为极片裂缝。这些裂痕的形成将造成极片表面SEI膜破裂, 电池循环寿命下降等问题。
2.2 添加剂成膜机理分析
使用SiO-C/Li扣式半电池以0.01C缓慢放电,并对放电曲线做微分,观察电解液中添加剂在硅碳负极表面的成膜现象及作用机理,SiO-C体系0.01C放电曲线见图2,放电曲线微分图见图3。
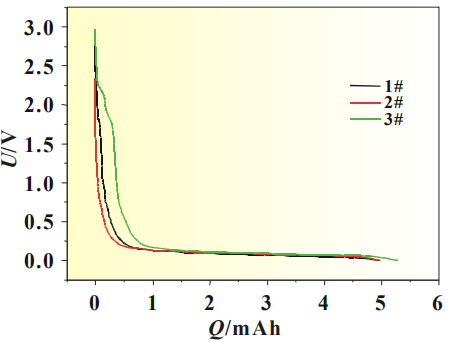
图2 硅碳负极体系扣式电池0.01C放电曲线
从图2中可以看出随着放电的进行将存在一个微小的放电平台,其中以3#曲线最为明显,开始时间较早,说明添加剂在此处有成膜反应,但1#和2#电解液无法从放电曲线上对成膜电位进行准确判断。图3为SiO-C/Li扣式电池放电曲线的dQ/dV曲线,将放电曲线微分后,可以将电极表面 的成膜反应放大,便于分析添加剂作用机理,其中图3(b)为图3(a)中Y轴小量程放大图。
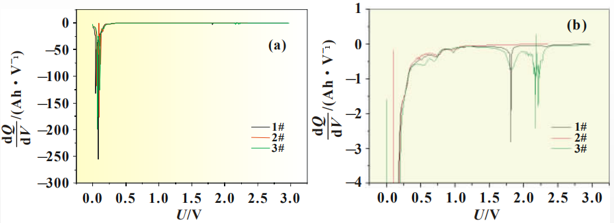
图3 硅碳负极体系放电曲线微分图
从图3(b)中可以准确判断成膜峰的位置及峰面积大小,三种添加剂成膜电位汇总为表3。结合图3(b)和表3可以看出,LiPO2F2的成膜电位为2.4V,成膜反应开始最早,同时成膜峰与其他两种电解液相比峰面积更大,主峰振幅的大小可以反映出成膜反应的强弱,说明此种添加剂组合成膜反应更完全、更致密,成膜能力更强。
表3 三种电解液成膜电位对比
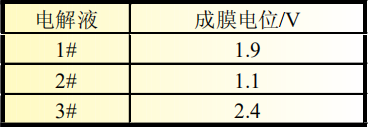
2#电解液中成膜添加剂为FEC,说明FEC的成膜电位为1.9V,在3#电解液中同样含有同比例的FEC,在微分曲线中同一位置也可以明显看到成膜峰,再次验证了FEC在此位置可发生成膜反应。而1#电解液中的添加剂VC成膜最晚,成膜电位为1.1V,在硅碳负极体系中成膜能力最弱。对比三种电解液成膜电位可以看出,LiPO2F2最易在硅碳负极表面成膜,三种添加剂成膜能力排序为LiPO2F2>FEC>VC。由于电极表面所成SEI膜的质量直接关系到电池循环寿命, 因此从图3的微分曲线所反应的成膜反应强弱可以对硅碳体系软包电池循环效果进行预测。鉴于3#电解液成膜开始电位最早,成膜峰面积最大,因此推测3#电解液中LiPO2F2+FEC的添加剂组合在硅碳负极表面进行的成膜反应最完全、成膜最致密,电极表面SEI膜包覆良好,因此循环寿命更长。循环性能推测依次为含有FEC的2#电解液,以及1#电解液。
2.3 NCM/SiO-C软包电池循环测试
NCM/SiO-C软包电池进行1C恒流充放电测试,循环测试结果见图4。从图4中可以看出,3#电解液体系循环趋势平稳,容量保持率较高,200次循环后容量保持率为90.29%,按此趋势,循环寿命可达600次(80%容量剩余)。其次为2# 电解液,50次循环后即与3#呈现出较大差异,1#电解液循环趋势下降更为明显。
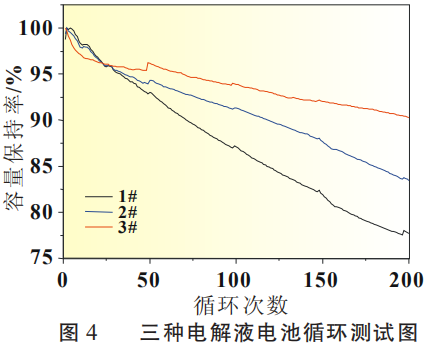
图4 三种电解液电池循环测试图
将图4所展示的循环效果与图3的电解液成膜机理分析相结合可以看出,本文从成膜反应强度预测出的循环效果与实测情况完全一致。因此,从添加剂成膜机理可对电池循环性能进行预测, 这也为电解液效果筛选提供了一种快捷有效的方法。同时,从图4可以看出,电解液添加剂对于硅碳负极体系循环寿命有着显著的影响,对于体系中成膜添加剂种类和用量的选择仍需更为深入和系统的研究。
三、结论
本文针对硅碳负极材料的特性,考察了不同电解液组分在其表面的成膜作用及机理。通过对电池容量的标定可以看出,硅的加入可以有效地提高负极比容量,含有5%SiO负极实际比容量可以达到395.73mAh/g。LiPO2F2+FEC的添加剂组合可以将电池首次库仑效率提高至89.21%,并且具有更强的成膜能力,可以显著提高硅碳负极电池的循环寿命。随着电动汽车市场的不断发展,高能量密度的材料对提高电动车的续航里程起到绝定性的作用,硅基负极材料以其明显的能量密 度优势必将成为未来动力电池发展的重要方向,存在着巨大的应用潜力。
责任编辑:xj
原文标题:电解液添加剂在硅碳负极体系中作用机理研究
文章出处:【微信公众号:锂电联盟会长】欢迎添加关注!文章转载请注明出处。
-
电解液
+关注
关注
10文章
859浏览量
23281 -
电池
+关注
关注
84文章
10756浏览量
132124 -
硅碳负极
+关注
关注
0文章
10浏览量
5692
原文标题:电解液添加剂在硅碳负极体系中作用机理研究
文章出处:【微信号:Recycle-Li-Battery,微信公众号:锂电联盟会长】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
晶硅切割液润湿剂用哪种类型?
强弱耦合型电解液调控超级电容器宽温域特性及其机制研究

水系电解液宽电压窗口设计助力超长寿命水系钠离子电池
钠电新突破:实现宽温长寿命电池的电解液革新




 不同成分电解液对硅负极表面成膜的影响及其作用机理
不同成分电解液对硅负极表面成膜的影响及其作用机理













评论