细胞核内的蛋白质在基因的调控、翻译和表达的过程中扮演着重要的角色,常与肿瘤发生、转移以及耐药性有关。但核蛋白被细胞膜和核膜的双重屏障包围,实际检测中,面临比细胞质蛋白检测更多困难。常规蛋白质免疫印迹法、酶联免疫吸附实验和免疫沉淀法均需要将细胞裂解,无法满足活细胞实时检测。而活细胞状态下检测细胞核蛋白主要方法,如分子荧光染料法和质粒表达法,需要特定筛选条件而缺乏一定的适用性,不能满足需求内源核蛋白的精准检测。
据麦姆斯咨询报道,近日,北京航空航天大学常凌乾课题组在《Biosensors and Bioelectronics》期刊上发表了题为“Companion-Probe & Race Platform for Interrogating Nuclear Protein and Migration of Living Cells”的研究论文。该工作设计了一种新型分析生物芯片平台(CPR),能在活细胞中探测核蛋白,同时实时追踪细胞的迁移;该芯片结合纳米电穿孔技术(课题组标签技术),将一种携带有识别细胞核内蛋白特异性识别肽的相伴型组合探针递送进活细胞核内,到检测到靶蛋白后产生绿色荧光。为了追踪活细胞的迁移,作者在平台上设计了多个带有标志点的放射状微通道,作为细胞的可寻址跑道。通过记录细胞在一定时间内经过的标志点的数量,可以监测细胞的迁移距离和估计迁移速度(图1)。
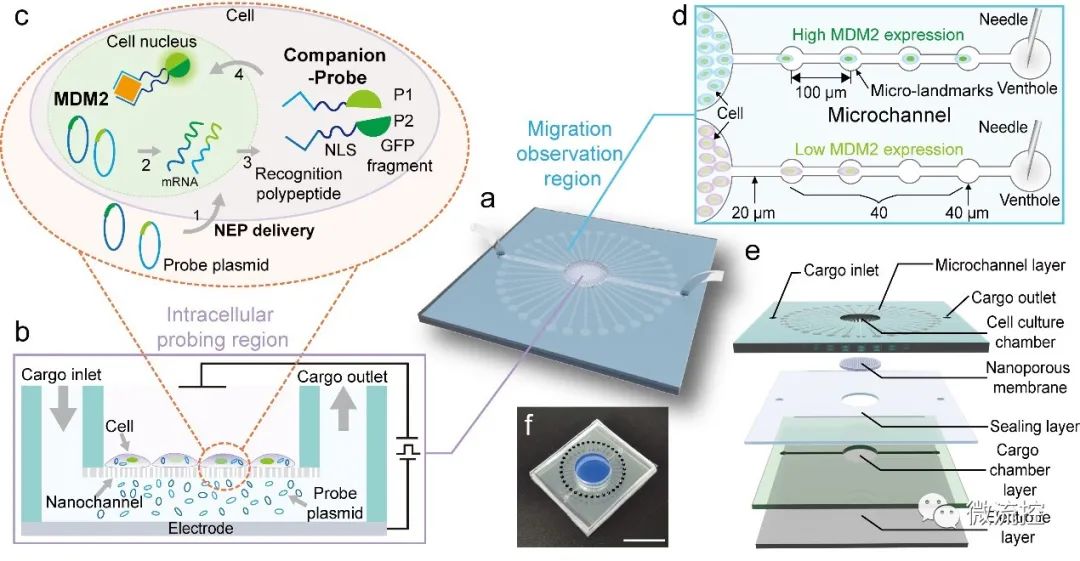
图1用于探测活细胞核内蛋白和迁移行为的CPR平台原理图
作者将40个标记点定义为四个部分,从细胞内探测区域的边缘(起点)到微通道的静脉孔,每十个标记点设为一组间隔。课题选择与细胞迁移率相关的MDM2蛋白作为检测蛋白,其表达水平与细胞迁移速度呈正相关。综合分析结果显示,45%以上的MDM2蛋白过表达的细胞迁移到20号-40号微标记,而对照组细胞只在20号微标记内迁移,表明MDM2蛋白过表达的细胞的迁移能力增强。作者根据在迁移观察区移动的时间和细胞的迁移距离估计了这些细胞的迁移速度,并验证了MDM2蛋白过表达的细胞的速度明显快于对照细胞。通过CPR平台和MATLAB软件计算的迁移速度具有可比性,证明了CPR平台在一定时期内通过简单地计算标记点来评估细胞迁移速度的可行性。根据MDM2蛋白表达和细胞迁移速度的关系分析,MDM2蛋白的表达水平与细胞迁移速度呈正相关关系(图2)。这一结果与报道的MDM2蛋白高表达促进肿瘤迁移的研究一致。
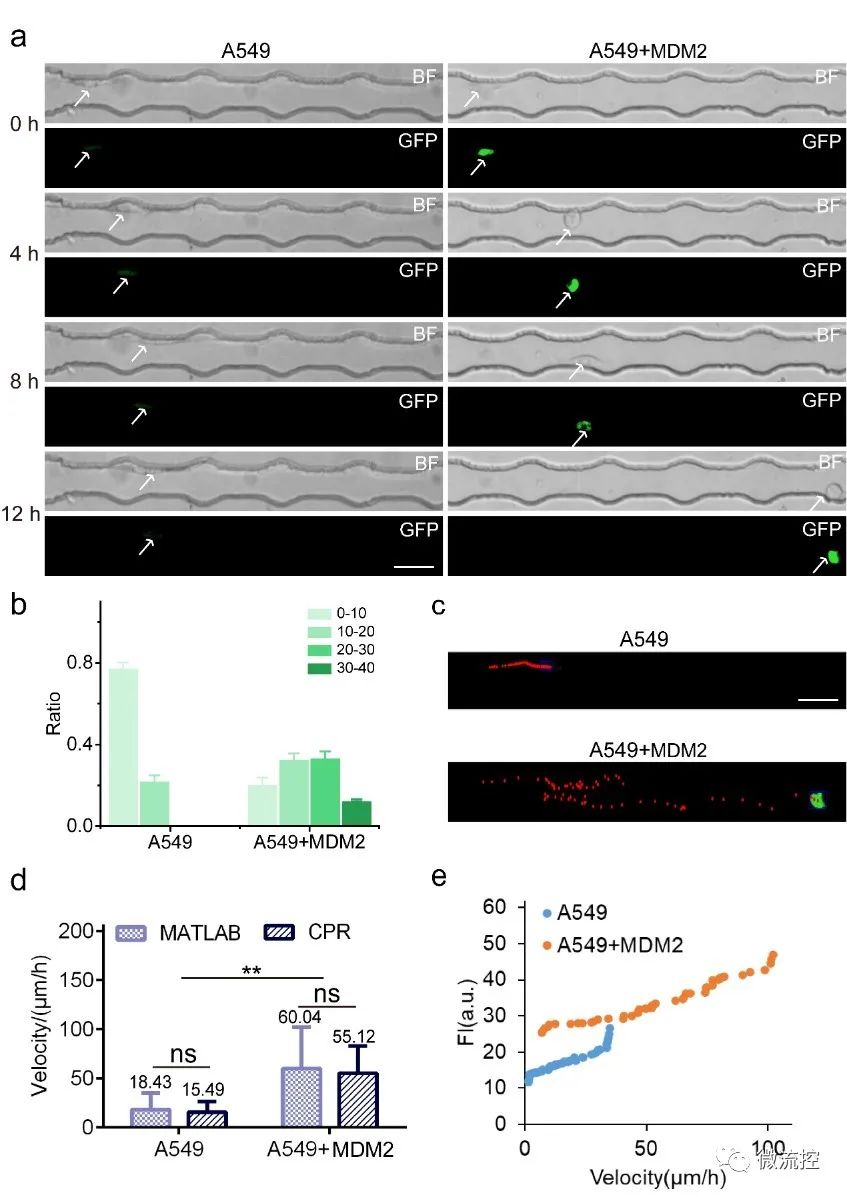
图2细胞迁移分析的CPR平台
为评估CPR平台的多功能性,作者在CPR平台上分析了六个原发性肺肿瘤细胞样本(T1-T6)和六个原发性正常肺细胞样本(N1-N6)细胞核内MDM2表达。在所有六个原发性肺肿瘤细胞的细胞核中都观察到明显的绿色荧光,表明MDM2蛋白在肿瘤细胞中的高表达。研究发现,相同时间内,原发性肺肿瘤细胞比原发性正常肺细胞迁移得更远(图3)。原代细胞的成功检测显示了CPR平台在分析不同来源的细胞样本方面的高度通用性。
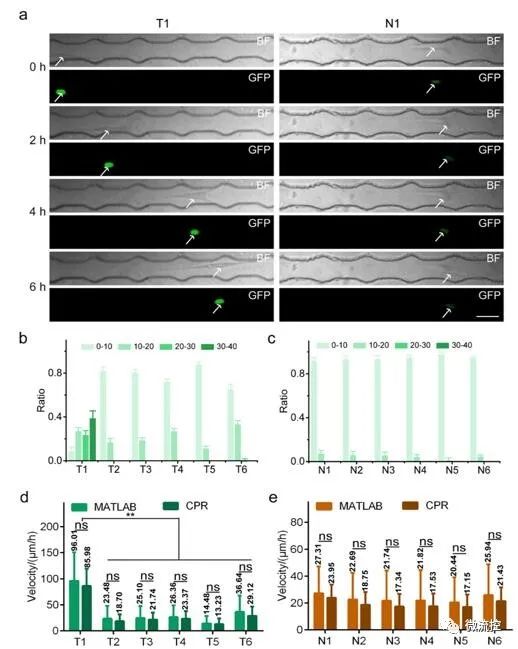
图3用于跟踪原代细胞迁移的CPR平台
该研究第一单位为北京市生物医学工程高精尖创新中心和北京航空航天大学生物与医学工程学院。常凌乾教授为主要通讯作者。第一作者为孙宏博士、董再再博士和张清洋博士。文章的其他主要共同作者包括,中国科学院大学深圳先进技术研究院任培根研究员,北京大学肿瘤医院吴楠教授。
文章链接:
https://doi.org/10.1016/j.bios.2022.114281
审核编辑 :李倩
-
纳米
+关注
关注
2文章
699浏览量
37223 -
生物芯片
+关注
关注
3文章
79浏览量
17130
原文标题:北航研发活细胞核蛋白和迁移行为综合分析生物芯片
文章出处:【微信号:MEMSensor,微信公众号:MEMS】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
一种新型多类别生物芯片DNA基因表达数据标准化方法
生物芯片概念及发展历史和前景
生物芯片分类及应用
利用发光蛋白开发出一种新型生物传感器
如何使用FPGA设计生物芯片数据采集系统的设计方法资料概述
上海生物芯片推出信号通路分析系统
生物芯片 生物芯片技术
山东农业大学研发了一种生物传感器检测TET1蛋白
多指标体外检测系统的量子点液态生物芯片应用





 一种新型分析生物芯片平台,能在活细胞中探测核蛋白
一种新型分析生物芯片平台,能在活细胞中探测核蛋白











评论