人类诱导多能干细胞(hiPSC)技术可用于疾病建模和药物开发,由hiPSC衍生的心肌细胞(hiPSC-CM)形成的心脏组织模型可用于减少和改进药物开发中动物试验的使用。但是,使用hiPSC-CM预测药物安全性和有效性,所要面临的的关键挑战,一方面在于这些细胞的不成熟,特别是hiPSC-CM表现出的自动节律性(没有电刺激的自发跳动)以及动作电位特征的不成熟。另一方面在于,物种之间的内在差异削弱了动物模型预测药物安全性和有效性的能力。
据麦姆斯咨询报道,为了克服以上问题,近日,加利福尼亚大学伯克利分校(University of California,Berkeley)的研究人员基于微流控技术构建了人类心肌细胞芯片系统——也称为微生理系统(microphysiological systems,MPS),再现了人类心肌组织微环境的三维(3D)架构,以此来探索心肌细胞的关键生理功能。研究发现,通过机械刺激和代谢信号的适当组合,可以促进hiPSC-CM成熟,相关成果发表在Nature Biomedical Engineering。
研究人员首先制作了心脏MPS,以增强多层组织自组装的一致性。简而言之,使用两步光刻法制作芯片,该芯片由以下部分组成:(1)一个细胞装载端口,通向一个带有两个大“锚定柱”和几个较小微柱的细胞培养室;(2)一个培养基装载端口,通向沿着细胞培养室周围运行的培养基通道。培养基通道和细胞培养室(高50µm)通过一系列窗孔(2µm高×2µm宽)连接,这些窗孔在特定的体积流量下提供对流的屏障,以便所有培养基中的因子通过扩散到达培养室中的细胞。其中,心脏MPS的制作利用PDMS模具复制法(使用Dow Chemical生产的Sylgard 184套件,即Sylgard基本组分与交联剂按照10:1 比例混合),并使用氧等离子体对PDMS和玻璃基底进行键合。
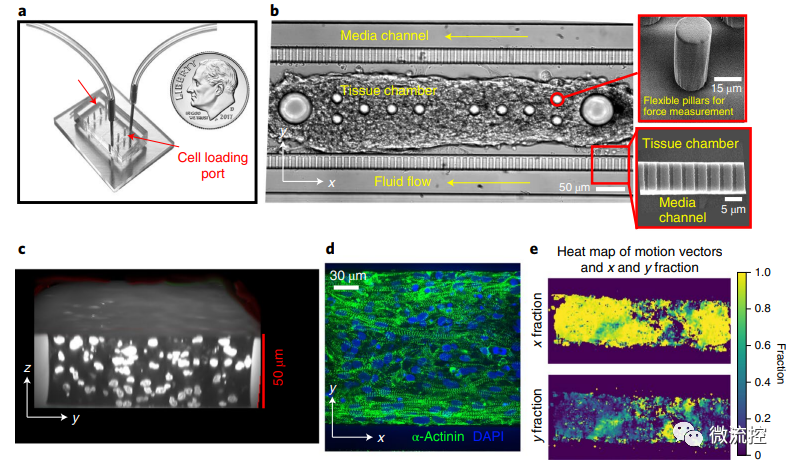
hiPSC-CM芯片的构建和表征
已有的研究表明心脏代谢相关基因表达的患者间差异很大,这些差异反映在患者来源的hiPSC-CM的转录组中。因此,研究人员在标记为野生C型(WTC)的细胞体系中测试了成熟培养基(MM)的影响。通过相关实验,研究人员确定了与标准培养基(SM)相比,基于脂肪酸的MM可导致更成熟的线粒体表型,并改善MPS中的钙处理。
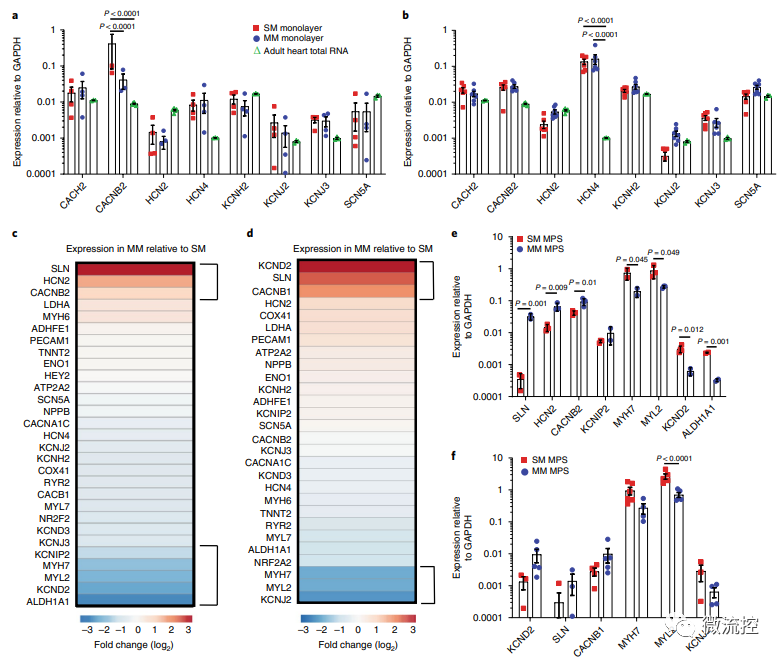
基于脂肪酸的MM处理后的单层细胞和MPS的基因表达分析
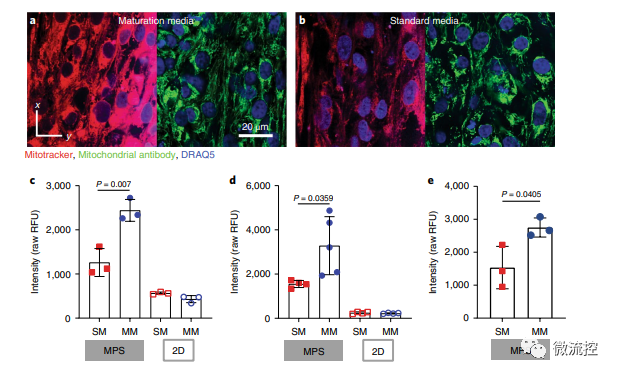
MM处理后的MPS的线粒体形态
除此之外,研究人员还观察到培养基对动作电位时程(action-potential duration,APD)不同细胞来源的依赖性影响。具体而言,在成熟培养基情况下,APD异常延长的组织,表现出较短的APD,而APD异常短的组织,表现出延长的APD。无论细胞来源如何,组织成熟都降低了自发搏动率和APD的变异性,并导致细胞表型趋同(APD在300-450ms范围内,这是人类左心室心肌细胞特征),从而可以改进致心律失常药物的药效模型。
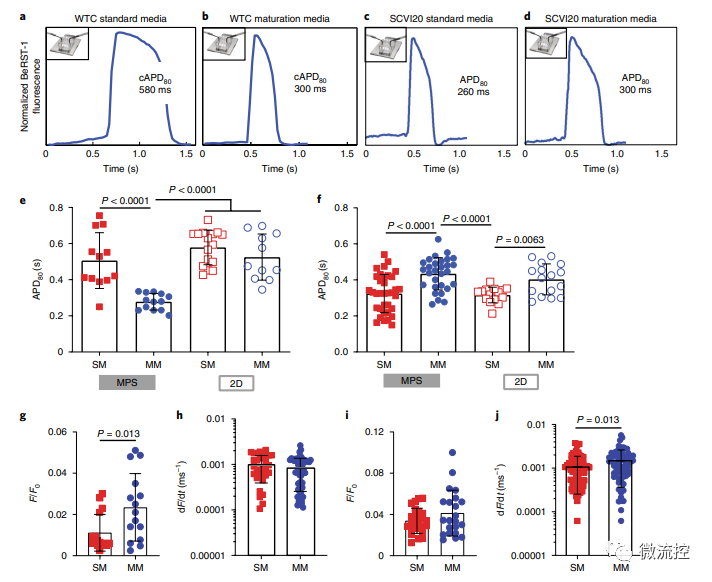
成熟心脏MPS的动作电位表征
为了了解hiPSC-CM对介质的不同反应,我们使用预测计算模型来确定特定电流、通量和钙处理机制对观察到的对动作电位和钙瞬变的变化的贡献。模型预测,不同基因型的未成熟MPS之间的个体电流不同。MM治疗导致了一组对离子电流和钙处理参数的趋同适应,并且MM引起的模拟电流变化与MM和SM对比所表现的药理学变化一致。这些结果表明,SM的糖酵解环境可能会放大来自不同品系的hiPSC-CM在动作电位和钙处理方面的差异。基于脂肪酸的MM可以减少这些差异,同时还可以减少来自同一患者细胞的样品内变异性,以便进行更具预测性的药物测试。
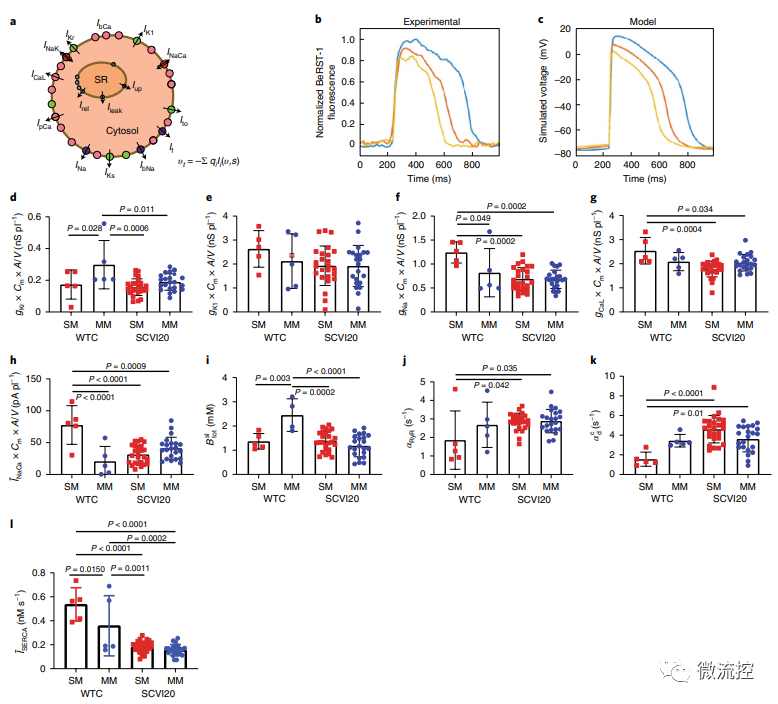
电流和钙处理机制对单层细胞和MPS动作电位贡献的数学模型
论文链接:
https://doi.org/10.1038/s41551-022-00884-4
审核编辑 :李倩
-
芯片
+关注
关注
456文章
50885浏览量
424149 -
微流控
+关注
关注
16文章
531浏览量
18903
原文标题:基于微流控的心肌细胞芯片系统,可用于疾病建模和药物开发
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
研究人员采用3D打印出一个厘米级的人体心脏泵
1毫升血可“看见”基因表达, “彩虹芯片”为心脏病治疗提供新可能
用人类细胞3D打印出了功能正常的厘米级人体心脏肌泵模型
一款模拟心脏心肌搏动和毛细血管屏障功能的心脏芯片
基于GaN光学芯片的高度集成、微型化、低成本光学显微传感系统
一种可分离的治疗性微针(MN)贴片介绍
高压功率放大器磁场促心肌组织成熟化的实现中的应用

功率放大器在磁场促心肌组织成熟化的实现中的应用

功率放大器在磁场促心肌组织成熟化的实现中的应用

心肌细胞搏动时钙离子浓度的变化与细胞收缩在时间上的先后分析
三星计划推出4亿像素传感器,报告称全球前十芯片公司今年投资下降 16%





 基于微流控技术构建了人类心肌细胞芯片系统
基于微流控技术构建了人类心肌细胞芯片系统










评论