1. CFDA2016年第173号《医疗器械生产企业质量控制与成品放行指南》中要求医疗器械行业在生产和质量管理中运用统计技术进行分析和预测。
2. FDA要求医疗器械行业抽样方案应当具有统计学依据,应当对统计推断的置信度进行分析,确保抽检的样品具有代表性。
3. 企业应当收集与产品质量控制、成品放行相关的质量控制运行数据,采用适当的统计技术,定期对相关数据进行趋势分析
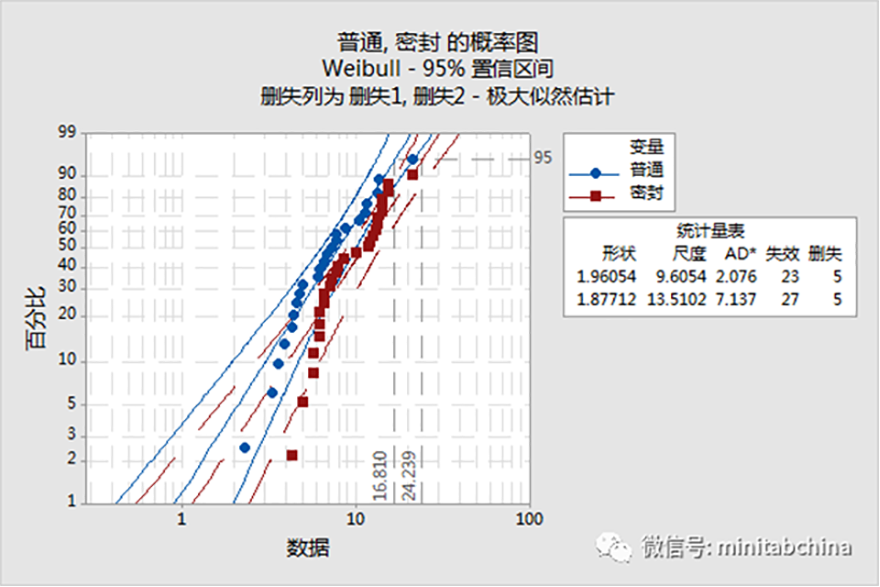
医疗器械可靠性分析
分析医疗器械在使用中受使用强度、电压、温度影响下器械的可靠性分析。
识别影响产品可靠性的失效模式。
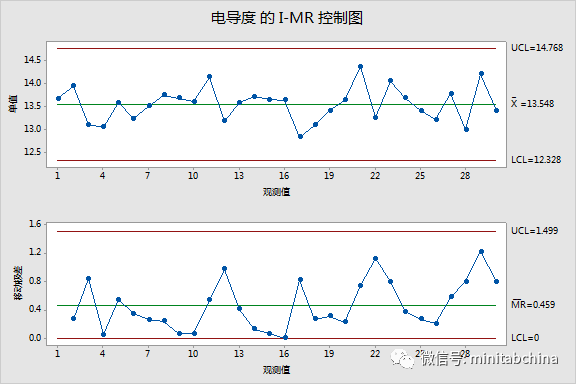
生产中过程监控
企业应当收集与产品质量控制、成品放行相关的质量控制运行数据,采用适当的统计技术,定期对相关数据进行趋势分析。
形成阶段性产品质量控制报告,警戒可能产生的偏离,按规定处置偏离或超限事件,必要时及时采取纠正预防措施。
企业应当定期对产品质量控制、成品放行控制的适宜性、充分性、有效性进行评审,并实施必要的后续措施。
通过观察和判断,适当时结合测量、试验或估量所进行的符合性评价。(GB/T 19000-2008《质量管理体系基础和术语》)
质量源于设计QbD
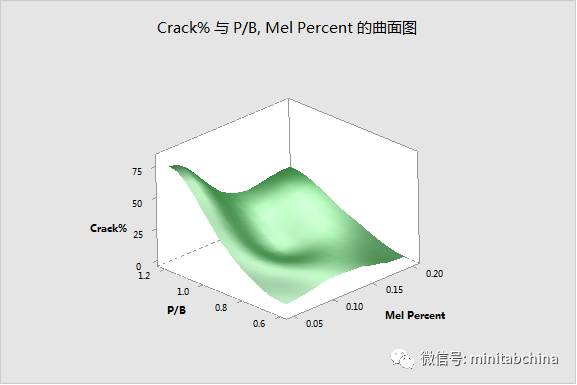
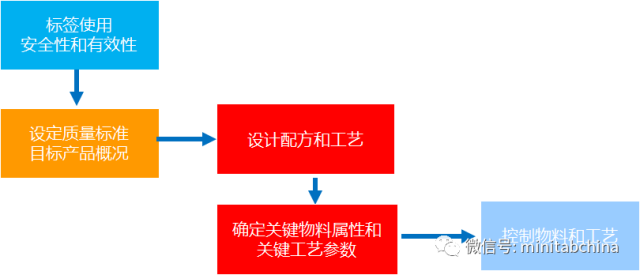
医疗器械的过程确认中,如何实现质量改进和成本节约?
各种工艺参数怎么设置才可以满足监管的需求?
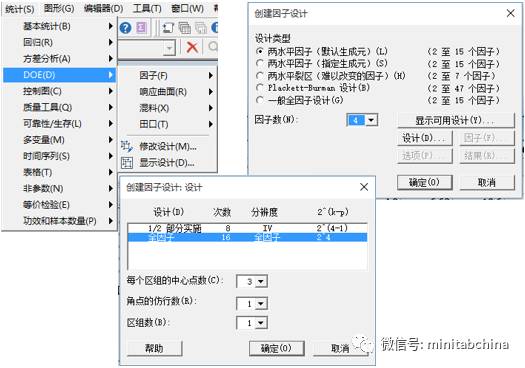
全球医疗器械协调工作组(GHTF)要求对过程进行确认,其中,操作鉴定(OQ)就要求用实验设计的方法。
审核编辑 黄昊宇
-
医疗器械
+关注
关注
19文章
823浏览量
51440 -
Minitab
+关注
关注
0文章
174浏览量
11685 -
医疗器械行业
+关注
关注
1文章
20浏览量
14831
发布评论请先 登录
相关推荐
盘谷医疗器械进销存系统各地区医疗器械协会认可
DEKRA德凯助力医疗器械高质量发展
医疗器械中电磁干扰的来源及影响

如何编制有源医疗器械设计开发流程?

选择和优化医疗器械中的电池

X1E000251005900晶振应用于医疗器械血糖仪

上海国际医疗器械展览会2025年6月25日-27日举办
纳宏光电:医疗器械滤光片领域的新突破

医疗器械密封性负压测试仪评估

选择精密医疗器械激光切割机需要考虑哪些因素





 Minitab应用于医疗器械行业
Minitab应用于医疗器械行业












评论