克服光学衍射极限,观察到亚细胞尺度的生物结构和变化过程一直是生命科学研究的目标之一,也是超分辨显微镜诞生的目的所在。随着现代显微成像技术的发展和不断突破,超分辨显微成像大家庭也一直在补充新鲜血液。不过,这些形形色色的技术各自也都存在着不足:譬如前面几期中我们提到的 PALM/ STORM/DNA-PAINT 等单分子定位技术都需要长时间的多帧采集,并需要高功率激发光。这意味着它们在很大程度上不适合对活细胞进行成像。
在超分辨显微成像专题的最后一期中,我们将为大家介绍一种完全不同的,适合活细胞的超分辨显微技术——结构光照明显微成像(Structure Illumination Microscopy, SIM)。
SIM 的原理
SIM 最早是在2005年由 Mats Gustafsson 开发并提出的,其基本原理是基于莫尔条纹(Moire pattern)——一种常用于产生光学错觉的效应。
莫尔条纹:由两个空间频率相近的周期性光栅图形叠加而形成的光学条纹。当两条线或两个物体之间以恒定的角度和频率发生干涉,而人眼无法分辨这两条线或两个物体时,只能看到干涉的花纹。
这个概念听起来有点高深,但其实莫尔条纹是一种我们在生活中随处可见的现象(图1)。大家可以翻翻看自己穿着条纹衬衫的照片,说不定就能看到莫尔条纹的身影哦。

图1 生活中的莫尔条纹
从图2我们可以更加直观地了解莫尔条纹是如何用于显示高频信息的:当两个小尺寸(高频)网格叠加覆盖在最右边的图像中时,它们之间发生干涉后就会显示一个较大尺寸(低频)的网格,这个网格会包含两个较小网格的信息。

图2 两个相互成一定角度重叠的细网格相互干涉形成的莫尔条纹。From Wikimedia commons
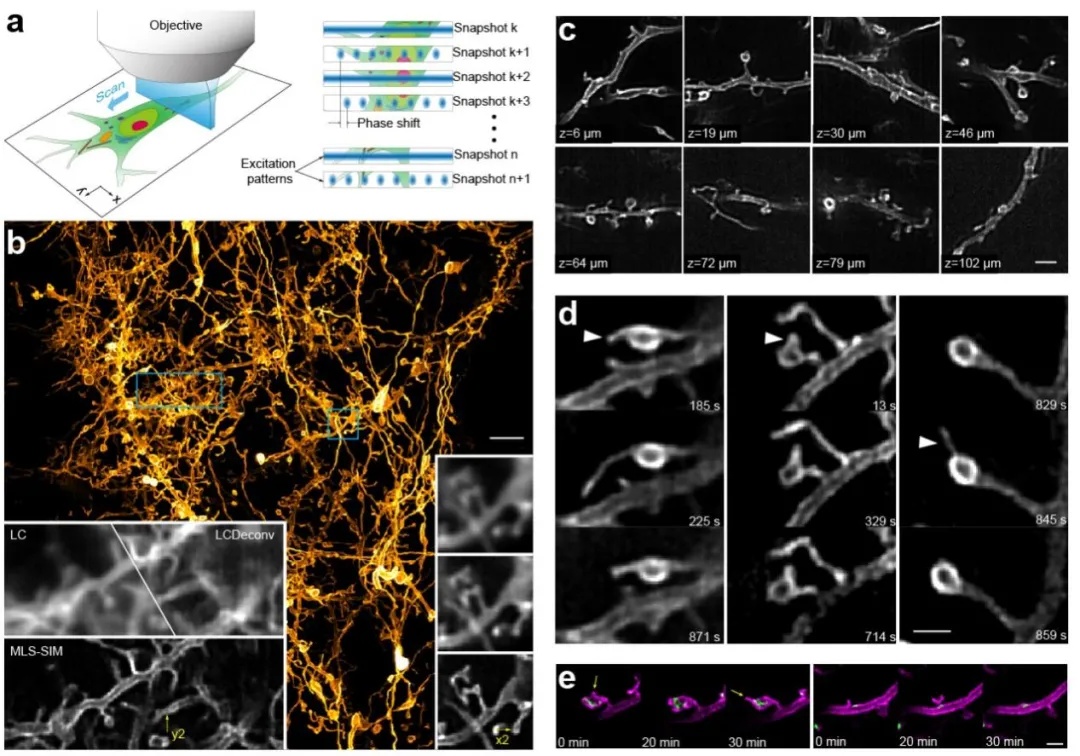
在实际使用时,通过在照明光路中插入一个结构光的发生装置(如光栅,空间光调制器,或者数字微镜阵列DMD等),照明光受到调制后,形成亮度规律性变化的图案,然后经物镜投影在样品上,调制光所产生的荧光信号再被相机接收。通过移动和旋转照明图案使其覆盖样本的各个区域,并将拍摄的多幅图像用软件进行组合和重建,就可以得到该样品的超分辨率图像了。由于需要组合多个图像,SIM 的成像过程是需要一定时间的,不过远比STORM这样的单分子定位超分辨显微技术要快许多。
还有一种速度更快的SIM技术——iSIM(Instant SIM)。它的前身是多焦点SIM(multifocal SIM,mSIM)。mSIM结合了共聚焦和结构光照明——不是用线,而是用多个稀疏的光点排列成图案进行照明(图2)。这些焦点由微透镜形成,并与发射光路径上的针孔相结合,达到光学切片的效果。微透镜阵列可以对来自每个照明焦点图像进行2倍的光学收缩,然后通过振镜将带有图案的激发光投射到整个样品上进行成像。Curd 等人在文章详细说明了构建iSIM系统的过程(Curd et al., 2015.)。
iSIM 不同于 mSIM 的地方在于,它可以通过微透镜阵列和扫描振镜直接组合多个位置的图像,不需要通过软件,从而大大提高了速度,并减少了相机噪声的影响。与PALM/STORM 等技术相比,iSIM 的速度能提高100倍。与其它结构光照明技术相比,iSIM 对样品的穿透能力要高上10倍,并且具有比转盘共聚焦更好的光学切片能力,这样一来,后期反卷积处理的效果也非常好。
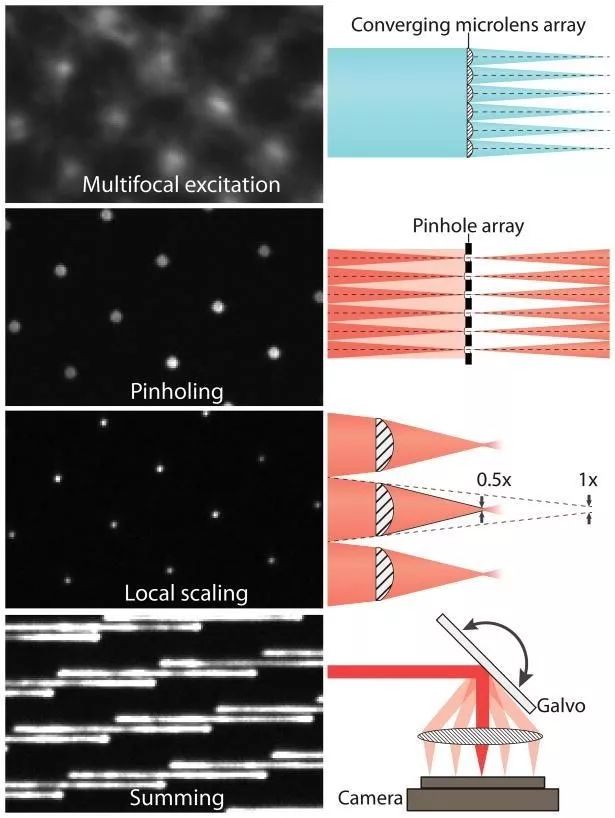
图3 产生多焦点激发的会聚微透镜阵列。激发样品后,用与微透镜阵列匹配的针孔阵列抑制非焦平面的杂散光。借助于第二个微透镜阵列,每个针孔发射的荧光可实现2倍收缩。振镜用于光栅多焦激发和和收集多焦发射光,在每次曝光期间产生超分辨率图像(为清晰起见,本图仅显示部分振镜)。(York et al., 2013)
左:原始图像。右:左图的动画示意。
SIM 的应用
SIM 和 iSIM 可以将传统光学显微镜的分辨率极限降低一半,更重要的是能够对活细胞进行超分辨成像。iSIM 能够以高达 100Hz 的频率采集图像,并且具有更好的光学切片能力。这使得 iSIM 能够在使用传统荧光染料的同时,对生物结构内部进行3维时间序列的超分辨成像。从而让研究人员可以突破光学分辨率极限,观察细胞和组织内微观结构的动态过程。
图4将 iSIM 与其他活细胞成像技术(转盘共聚焦,线扫描共聚焦)的分辨率进行了比较。这个样品的挑战是线粒体内部空隙中没有 Mcherry 表达,因此只有用 iSIM 才能实现超分辨(图c中用白色箭头所示)。
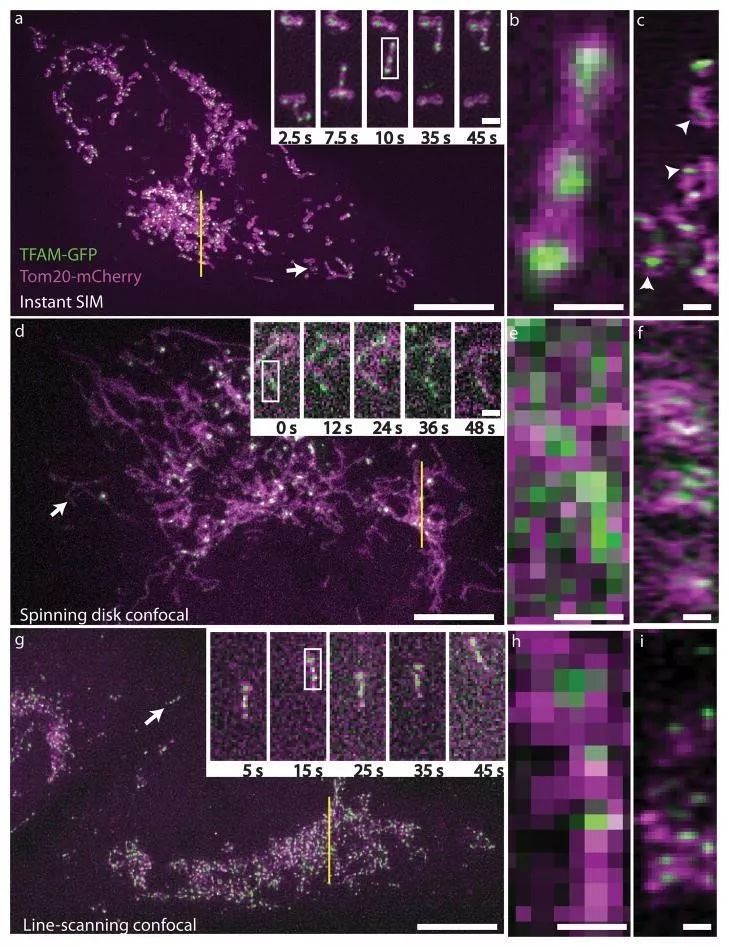
图4 表达 TFAM-GFP(绿色)和 Tom20-mCherry(紫色)的MRL-TR转化人肺成纤维活体细胞。图a-c用iSIM拍摄,d-f用转盘共聚焦拍摄,g-i用线扫描共聚焦显微镜拍摄。(York et al., 2013)
图a, d, g所示为3 μm体素的最大强度投影(XY),高倍图显示的为白色箭头指示区域在对应时间点的图像。
图b, e, h: a, d, g高倍图中白色矩形区域的高倍放大。Scalebars: 0.5μm
图c, f, i: a, d, g中黄线指示的~270 nm切片的轴向(ZY)视图。Scalebars: 1μm
内质网的运动和生长非常迅速,新的内质网小管的形成和生长发生在约100ms的时间尺度上,iSIM 能够非常清楚地捕捉到内质网的生长过程(图5)。
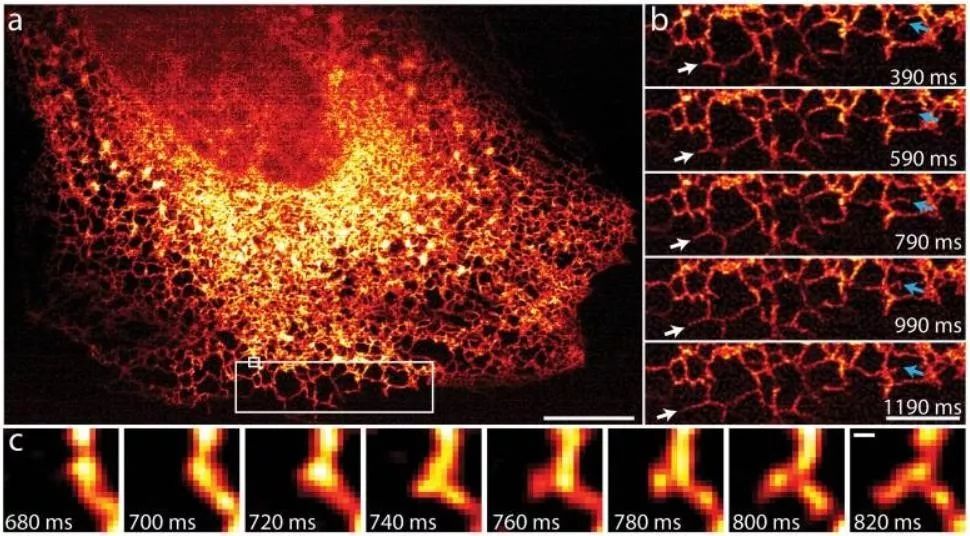
图5 iSIM拍摄的内质网动力学图像(100Hz)(Yorket al., 2013)
A:200个时间序列中的第一张图像,显示了在MRL-TR转化人肺成纤维细胞内GFP-Sec61A标记的内质网。Scalebar:10 μm
B:A中白色大矩形区域的放大图像。白色箭头指示内质网小管的生长,蓝色指示内质网小管的重塑。Scalebar:5 μm
C:A中白色小矩形的放大图像,140ms内新的内质网小管形成过程。Scalebar:200 nm
使用iSIM,York等人还成功地对3日龄斑马鱼红细胞的结构进行了活体成像(图6),避免了由于运动导致的图像模糊。展示出了对活样品生物结构进行无创成像的能力。
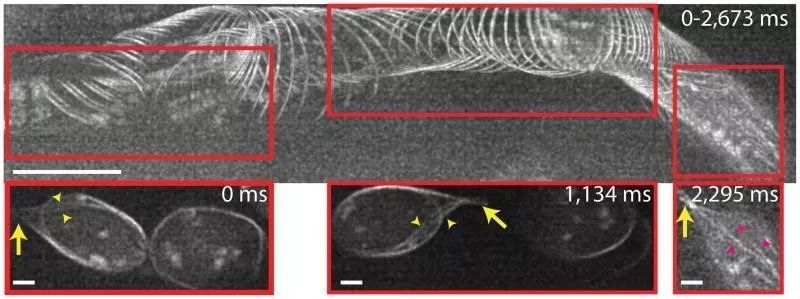
图6 上:100个2D图像(2673ms)的最大强度投影。显示3日龄斑马鱼胚胎脑部血细胞中GFP标记的微管。成像深度:20μm;运动方向:从左到右,清晰的细胞边界显示没有由于运动导致的图像模糊。Scalebar:10μm
下:上图中红色方框在特定时间的图像。黄色箭头:同一细胞末端的“尾巴”结构;黄色小箭头:尾部的微管;红色箭头:细胞内的微管。Scalebar:2μm。
适合 SIM 的科学相机
SIM 常用于进行高时间分辨率的活体超分辨成像,高速的 sCMOS相机是它们的最佳搭档。另一方面,由于曝光时间短,SIM对相机采集信号的能力要求也比较高。
因此,背照式sCMOS相机是一个不错的选择,如Prime BSI,Prime BSI express,Prime 95B等。95%量子效率带来的高灵敏度,再加上低读出噪声,可以在提高采集速度的同时保证图片信噪比。另外,均匀的背景对SIM和iSIM这种靠结构光照明来实现超分辨成像的技术来说也很重要。
审核编辑 :李倩
-
Sim
+关注
关注
2文章
246浏览量
40002 -
光学显微技术
+关注
关注
0文章
31浏览量
6122
原文标题:结构光照明显微成像(SIM)
文章出处:【微信号:vision263com,微信公众号:新机器视觉】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
新型超分辨显微成像技术:突破光学衍射极限
共聚焦激光显微镜工作原理
活细胞的“聚光灯”——前沿活细胞成像的案例分享

新品上市 | 优可测超景深数码显微镜AH-3000系列:开启智能显微系统新时代

照明显微镜激光引擎

显微测量|共聚焦显微镜大倾角超清纳米三维显微成像
详解蔡司原位液体电化学显微解决方案




 适合活细胞的超分辨显微技术——结构光照明显微成像
适合活细胞的超分辨显微技术——结构光照明显微成像














评论