【研究背景】
锂硫(Li-S)电池由于其超高的理论能量密度,是一种非常有前途的储能系统。多硫化锂(LiPSs)是工作中的锂硫电池的重要中间物。然而,LiPSs在电解质中的现有形式还没有被清楚地阐明。目前,LiPSs大多被认为是完全分离的,而多硫化物阴离子通常被认为是主要的成分。
【工作介绍】
不同于常规认识,清华大学张强教授团队最近的工作首次揭示了在锂硫电池中,多硫化锂(LiPSs)表现出强烈的结合额外的锂离子并形成阳离子簇的趋势,证实了阳离子LiPSs作为锂硫电池电解质中的主要成分存在。他们进一步证明,通过抑制阳离子LiPSs的形成可以有效地降低极化并改善电池性能。这些发现更新了人们对锂硫电池化学的基本认识,激发了人们进一步合理设计电解质和电极材料以构建高性能电池。该工作以“Cationic lithium polysulfides in lithium–sulfur batteries”为题发表在国际顶级期刊《Chem》上。
【内容解析】
一、电解液中LiPS的解离和结合行为
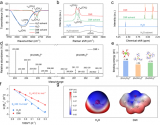
首先进行电导率分析以确定LiPSs的解离行为。由于Li2S6在各种LiPSs中硫链的长度适中,因此被选作LiPSs的模型分子。溶剂为等体积的1,3-二氧戊环(DOL)和二甲醚混合。如图1A所示,Li2S6在不同浓度区域表现出不同的解离行为。在低于10mM的低浓度区域,Li2S6的摩尔电导率随着浓度的增加而急剧下降,表现为典型的弱电解质。下面的化学方程式可以用来描述Li2S6的解离过程,具有一阶解离平衡常数。
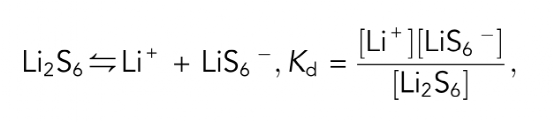
如图1B所示,1=Λm(摩尔电导率)和σ之间有良好的线性关系,表明上述方程式在低浓度区域内是有效的。Kd值被拟合为1:69×10-4,对应于Li2S6在电解质中的弱解离行为。
在20mM以上的高浓度区域,Li2S6的摩尔电导率表现出异常的增加。这种行为表明,反应的产物比反应物的分子少;因此,电离度将随着总浓度的增加而增加。这种现象被归结为三离子电离行为,即三个中性分子转化为一个阳离子和一个阴离子。对于三离子过程,假设Li2S6的反应方程与相应的三离子联合平衡常数如下。
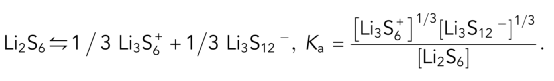
具体来说,三个中性的Li2S6分子重新结合成一个Li3S6+阳离子和一个Li3S12-阴离子。如图1C所示,在浓度超过20mM时,Λm c1/2和c之间有良好的线性关系,表明三离子联合是合理的。计算出的Ka值相对较高,为1.09,这意味着在高浓度LiPSs的实际LiPS电解质中,三离子联合行为是显著的。
图1D总结了电离反应和相应的平衡常数,显示了Li2S6的弱解离性质,同时有形成三离子的强烈趋势。为了更好地说明这一点,根据平衡常数计算了不同Li2S6浓度下不同硫成分的比例,并显示在图1E中。Li2S6具有很高的电离度,在1.0mM以下解离成LiS6-阴离子。在1.0-100 mM的宽浓度范围内,中性Li2S6分子作为主要成分,其比例高于60%。当浓度高于100 mM时,三离子相关成分Li3S6+和Li3S12-成为主要成分,而中性Li2S6分子仍然占据40%以上不可忽略的部分。因此,可以确认不同浓度的Li2S6电解液中的主要成分。
二、电解液中阳离子LiPSs的鉴定
从本质上讲,三离子结合行为是由一个Li2S6分子从另一个Li2S6分子获得Li+引起的。因此,可以推断出,如果电解质中存在一定量的自由Li+离子,Li2S6分子可以自发地与Li+结合,并以阳离子Li3S6+的形式存在。为了确定LiPS-Li+结合的情况并识别Li3S6+成分,采用了ESI-MS来分析Li2S6溶液中硫成分的组成,因为ESI-MS是一种非破坏性的工具,可以有效地获得溶解成分及其溶剂化鞘的结构信息。通过使用正负测量模式,可以根据质量/电荷比(m/z)分离和识别阳离子或阴离子状态的不同硫成分。如图2A和2B所示,Li2S6溶液表现出阴离子LiS6/S6的特征峰。(m/z = 199或192)或阳离子Li3S6+ (m/z = 303,有一个DME作为溶剂化鞘)的特征峰,分别对应于其解离和三个离子结合过程。在Li2S6溶液中加入额外的LiTFSI,Li3S6+峰的强度明显增加,而负模式的LiS6-/S6-峰几乎消失。上述结果证实了Li2S6和Li+之间的结合,形成阳离子Li3S6+。
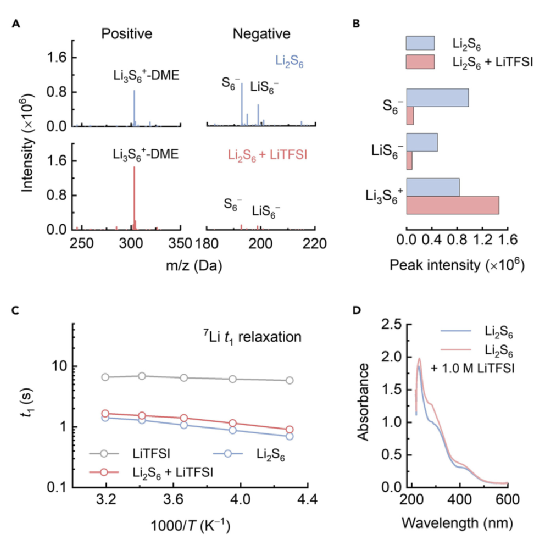
图2. 电解液中的阳离子LiPSs的鉴定。
此外,在不同的温度下进行了7Li NMR自旋晶格(t1)弛豫测量,以探测电解质中阳离子Li3S6+的存在。t1弛豫时间反映了锂原子与周围原子交换自旋能量的速度,从而提供了关于周围配位环境的信息。
如图2C所示,Li2S6溶液的t1弛豫时间显示出比空白LiTFSI溶液低得多的数值和更强的温度依赖性,表明Li2S6中Li+周围配位环境的不对称性更高。Li2S6+LiTFSI混合物的t1弛豫时间显示出与Li2S6溶液相似的数值和温度依赖性,这与LiTFSI不同,表明额外的Li+倾向于与Li2S6结合形成阳离子,表现出比DME配位的自由Li+更类似于Li2S6的不对称配位结构。采用紫外-可见光谱分析来研究硫链化学环境的变化,从而探测Li2S6和Li+之间的相互作用。如图2D所示,Li2S6的紫外可见光谱在270和420纳米处显示出典型的吸光峰,对应于硫链的n/s*激发。随着1.0M LiTFSI的加入,420纳米处的峰值强度明显加强,并呈现出蓝移,表明额外的Li+与硫链结合并降低了非结合轨道上电子的能量。
进行了电导率测量,以提供关于阳离子Li3S6+成分形成的直接和定量的证据。Li2S6和LiTFSI的混合物表现出的电导率远远高于两种成分在各自浓度下的电导率数值之和,表明,中性Li2S6分子倾向于与中性LiTFSI分子反应,形成自由离子,从而产生更多的电荷载体。反应方程可以写成如下:
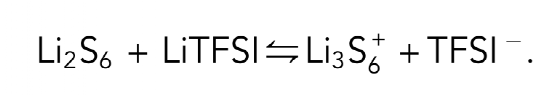
很明显,电导率测量的结果证实,Li2S6有强烈的倾向于结合额外的Li+,并在电解质中与Li盐形成相当数量的阳离子Li3S6+。
上述讨论定性地说明了Li2S6形成阳离子Li3S6+的趋势。形成Li3S6+阳离子的关联常数可以通过数据拟合进一步定量地得到。
考虑到低浓度LiTFSI的Li2S6稀溶液,以下平衡描述了离子的关联和解离行为:

鉴于每个反应的平衡常数和每个离子对相应的极限摩尔电导率,溶液的总电导率可以根据离子独立迁移定律来计算。由于图1A-1C中已经获得了Li2S6的解离平衡常数和极限摩尔电导率数据(注意K1 = 1/Kd),LiTFS的数据也可以测得,所以平衡常数K2和Li3S6+-TFSI- 离子对的极限摩尔电导率是唯一两个可以通过非线性最小平方法从实验电导率数据中拟合的未知参数。图3A展示了电导率测量和数据拟合的结果。通过数据拟合,平衡常数K2的值被确定为4.70×102,Li3S6+-TFSI离子对的极限摩尔电导率为1.44×104 mS cm-1 M-1。
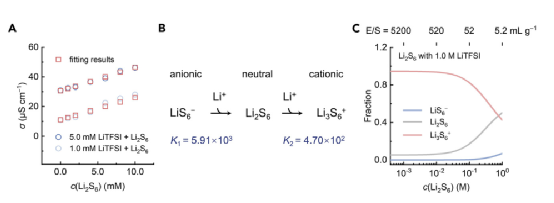
图3. LiPSs和Li+之间的解离和关联行为的定量分析。
随着锂盐的加入,图3B中定量地阐明了Li2S6和Li+之间的解离和结合反应。LiS6的一阶结合常数的值为K1 = 5.91×103,表明LiS6有与Li+结合的强烈趋势。形成Li3S6+阳离子的二阶结合常数的值是K2=4.70×102,表明中性Li2S6分子与额外的Li+结合的趋势同样强烈。根据关联常数,计算出存在1.0M LiTFSI的不同硫成分的比例,并显示在图3C。当Li2S6浓度低于100 mM时,LiTFSI提供的大量游离Li+阳离子导致电解液中阳离子Li3S6+成分的主导部分超过80%。当Li2S6浓度达到100mM时,Li2S6和TFSI阴离子之间出现了对Li+的竞争。因此,对于电解液使用过量的锂硫电池(电解液与硫的比率,E/S比率>20 mL g-1),阳离子LiPSs被认为是电解液中的主要成分。对于电解液有限的高能量密度锂硫电池(E/S比<5 mL g-1),中性LiPS分子和LiPS阳离子都是电解液中的主要成分。
三、电解液中阳离子LiPSs的理论分析
阳离子LiPSs的存在已经被实验方法所全面证实。为了获得电解质中LiPS阳离子的详细结构信息并了解其基本化学性质,进行了第一原理计算。
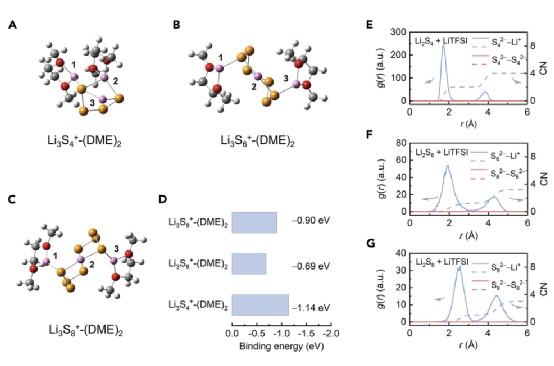
图4. 电解液中阳离子LiPSs的理论模拟。
图4A描述了Li3Sn+-(DME)2(n=4、6或8)的优化结构,图4B显示了溶解的锂离子Li+-(DME)2与中性LiPS分子结合时的相应结合能。在Li3S6+-(DME)2和Li3S8+-(DME)2复合物中,最里面的一个锂原子(编号2)被两个末端硫原子配合,而外面的两个锂原子(编号1和3)分别与一个末端硫原子和一个DME分子结合。此外,Li3S6+-(DME)2和Li3S8+-(DME)2分别表现出0.69和0.90 eV的高结合能,表明Li+(DME)2和LiPSs之间有强烈的相互作用。形成Li3S6+阳离子时,其结合能与实验结合常数相一致。相比之下,短链Li3S4+-(DME)2表现出不同的结构,其中一个锂原子与一个DME和一个末端S原子配合(编号1),另一个锂原子与一个DME和两个末端S原子配合(编号2),而另一个锂原子只与两个末端S原子配合(编号3)。这种紧凑结构的形成源于较短的硫链的较小的立体阻碍,这使得Li阳离子能够直接与电负性的端硫结合而不明显改变原来的Li2S4结构而导致更高的结合能-1.14eV。
为了进一步了解LiPS-Li+相互作用的化学性质,采用了键长分析、前沿轨道分析和自然键轨道(NBO)电荷分析来研究Li3Sn+复合物的结构和电荷转移。与中性Li2Sn分子相比,阳离子Li3Sn+-(DME)2的每个Li-S键的键长相似但略有减少。在与额外的Li+结合后,Sn2-的HOMO和LUMO能级下降,这被认为是由于Li+的吸电子能力。同时,观察到Sn2-的HOMO和LUMO之间的带隙增加,这意味着阳离子LiPSs在电化学转换中是不利的。此外,在Li3Sn+(DME)2阳离子形成后,末端的硫原子保持恒定的负电荷,即0.75e,并且从额外的Li阳离子到末端的硫原子观察到几乎可以忽略的正电荷转移(<+0.04e)。这些结果表明,LiPS阳离子中的Li-S键与初始Li2Sn分子中的离子键相似。
分子动力学MD模拟,确定阳离子LiPSs在电解质中的溶解结构。结果表明LiPS阳离子在电解质中的普遍存在。从MD轨迹中提取的不同LiPSs团簇的优化结构显示了LiPS阳离子的溶剂化结构。LiPS阳离子被DME溶解在一级溶剂化鞘中,成为一个紧凑的团块,而DOL分子和TFSI阴离子则在二级溶剂化鞘中。
总之,DFT计算和MD模拟揭示了LiPS阳离子的结合能、稳定构型和溶剂化结构,从而在理论上证实了LiPS阳离子在电解质中的存在,这与实验结果一致。
四、阳离子LiPSs的动力学评估
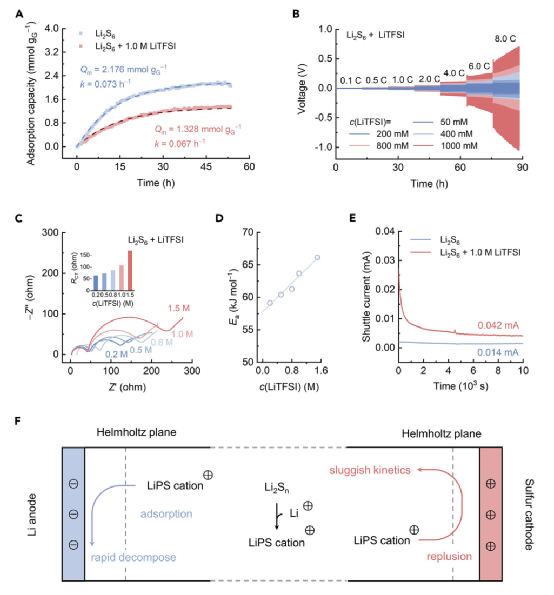
图5. 阳离子LiPSs的动力学评估。
(1)对阴极反应活性的影响
如上所述,溶解的LiPSs在Li-S电解质中以阳离子而不是中性分子或阴离子的形式存在。可以想象,这种LiPS-Li+的相互作用将影响溶解的LiPSs的电化学行为。首先,通过紫外-可见光谱法评估了Li2S6在阴极基底上的吸附行为。通过采用石墨烯(G)作为吸附剂,记录了Li2S6的吸附容量-时间曲线,并进行了拟合,以获得有关平衡吸附容量(QM)和吸附速率常数(k)的动力学参数(图5A)。在相同的Li2S6初始浓度下,与纯Li2S6相比,含有LiTFSI的Li2S6的QM明显下降,吸附速率下降,表明LiPS的吸附受到抑制。考虑到中性Li2S6和阳离子Li3S6+之间相似的结构但不同的电荷,阳离子LiPSs由于静电排斥,本质上更难被吸附在碳基质上,因此难以参与后续的电化学反应。
为了验证上述论点,使用Li2S6对称电池测量了不同电流密度下的直流(DC)极化和交变电流电化学阻抗谱(EIS),以评估LiPS电化学反应的动力学。如图5B和5C所示,Li2S6对称电池的直流极化随着LiTFSI浓度的升高而增加,每个电流密度从0.1到8.0 C。当电流密度达到8.0 C时,用50 mM LiTFSI转换Li2S6的过电位仍然很低,稳定在80 mV。相比之下,1,000 mM LiTFSI组表现出超过440 mV的大过电位。随着LiTFSI浓度的增加,对称电池的循环伏安曲线显示出延迟的电流反应和最大电流的减少。因此,LiPS-Li+的相互作用明显阻碍了Li2S6的氧化还原动力学,上述结论也体现在EIS的结果中。随着LiTFSI浓度的增加,电荷转移电阻(RCT)增加,对应于氧化还原动力学的增加难度。此外,在不同的温度下,测量的RCT拟合到Arrhenius方程中,得到Li2S6转化的活化能。如图5D所示,观察到活化能(Ea)与LiTFSI浓度之间的正相关关系,表明动力学的下降来自于电化学反应中阳离子LiPSs的内在迟滞性。
(2)对阳极金属锂副反应的影响
考虑到LiPSs和Li金属阳极之间的反应会显著影响Li-S电池的循环寿命,对阳离子LiPSs与Li金属阳极的反应性进行了评估。如图5E所示,加入1.0M LiTFSI后,Li2S6的穿梭电流达到0.042 mA,比空白Li2S6溶液的0.014 mA高出2倍。穿梭电流的增加表明,阳离子LiPSs对金属锂阳极的反应更加激烈,会消耗金属锂。
阳离子LiPSs在阴极表现出迟缓的氧化还原动力学,而在阳极则表现出高活性。上述现象可以用带正电的阳离子LiPSs和电极的电双层之间的相互作用来解释。一般来说,阳离子过度地吸附在亥姆霍兹平面上,Li阳极带负电。相反,由于LiPSs的电化学平衡,硫阴极是净正电,阴离子过度地被吸附。因此,与中性LiPS分子相比,阳离子LiPSs更容易被阴极排斥,更难进入亥姆霍兹平面参与电化学反应(图5F)。然而,由于静电吸引,阳离子LiPSs更容易被吸附在金属Li阳极表面,与金属Li阳极发生副反应,加剧了穿梭效应。简而言之,阴极和阳极的电双层结构不同,导致阳离子LiPSs的动力学顺序相反。
五、应用
动力学测量结果表明,阳离子LiPSs在阴极是迟缓的,但在阳极是活跃的,这表明对锂硫电池的性能有整体的有害影响。因此,提出了一个降低锂盐浓度以减少阳离子LiPS比例的策略,以改善电池性能。为了证明所提出的策略,测量了含有不同浓度LiTFSI的锂硫硬币电池的速率性能(图6A)。在0.1、0.5、1.0和2.0C时,LiTFSI浓度为50至500mM的锂硫扣式电池表现出类似的比容量。然而,当速率达到4.0C时,含有50 mM LiTFSI的锂硫钮扣电池仍然提供432 mAh g-1的比容量,而含有100或500 mM LiTFSI的锂硫钮扣电池则表现出明显的比容量下降,分别为150.2或31.7 mAh g-1。在4.0C时相应的电压-容量曲线进一步阐明了速率性能的差异(图6B)。在高浓度的LiTFSI(100或500mM)下,在第二个平台之前过早终止放电被观察到,表明源于缓慢反应动力学的大过电位。相反,将LiTFSI浓度降低到50 mM,减少了电解液中阳离子LiPSs的比例,从而改善阴极的氧化还原动力学。因此,极化现象得到缓解,实现了活性物质的高利用率。
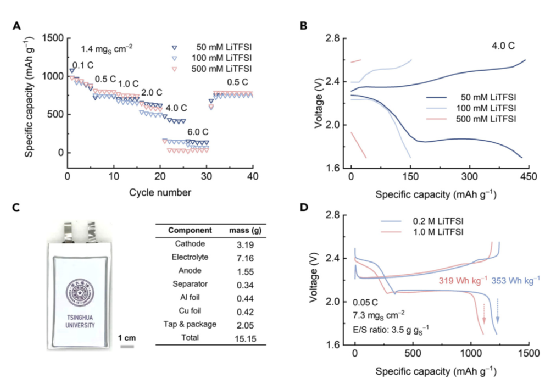
图6. 锂硫电池的电化学性能(A和B)(A)不同LiTFSI浓度的锂硫纽扣电池的速率性能和(B)相应的电压-容量曲线在4.0 C。(C)2 Ah级锂硫软包电池的光学图像和参数。(D) 不同 LiTFSI 浓度的锂硫 软包电池的电压-容量曲线。
软包电池验证:组装了LiTFSI浓度为0.20M和传统的1.0M LiTFSI电解质的软包电池。如图6D,使用0.2 M LiTFSI的锂硫软包电池在0.05 C的循环速率下,提供了1,244 mAh g-1的卓越放电容量和353 Wh kg-1的高初始能量密度。相比之下,含有1.0 M LiTFSI的锂硫电池显示出更高的极化,而放电容量却低得多,仅为1,106 mAh g-1。因此,含有1.0 M LiTFSI的锂硫电池只显示出319 Wh kg-1的初始能量密度。
上述软包电池级别的评估清楚地表明了阳离子LiPSs对电池性能的负面影响,以及减少阳离子LiPSs的比例以实现高能量密度锂硫电池的有效性。
【要点总结】
一、首次证实了锂硫电池中存在阳离子LiPSs。
二、LiPSs是弱解离的,但与额外的Li+结合形成LiPS阳离子,阳离子LiPSs被确定为电解质中的主要物种。理论模拟证明了阳离子LiPSs的构型和溶剂化结构,并表明LiPS-Li+的相互作用具有离子键的性质。
三、阳离子LiPSs在阴极氧化还原动力学方面比较迟钝,而在金属锂阳极上则具有更强的化学活性。因此,降低锂盐浓度以减少LiPS阳离子的比例,可以有效提高电池在容量、极化和速率反应方面的性能。更重要的是,按照该策略,锂硫软包电池在低锂盐浓度下实现了353Wh/kg的高实际能量密度。
四、本工作关于锂盐的现有形式和行为的研究结果为锂硫化学提供了新的见解,并为合理设计电解质和电极材料以构建高性能锂硫电池提供了重要指导。
Cationic lithium polysulfides in lithium–sulfur batteries
Chem(IF25.832)Pub Date:2022-08-11, DOI:10.1016/j.chempr.2022.07.004
Yun-Wei Song, Liang Shen, Nan Yao, Xi-Yao Li, Chen-Xi Bi, Zheng Li, Ming-Yue Zhou, Xue-Qiang Zhang, Xiang Chen, Bo-Quan Li, Jia-Qi Huang, Qiang Zhang
审核编辑 :李倩
-
电解液
+关注
关注
10文章
848浏览量
23101 -
锂硫电池
+关注
关注
7文章
97浏览量
13636 -
能量密度
+关注
关注
6文章
287浏览量
16475
原文标题:清华大学张强Chem突破性进展:打破常规认识,首次证实锂硫电池中存在多硫化物阳离子
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
水系电解液宽电压窗口设计助力超长寿命水系钠离子电池
安泰功率放大器在电解液体浸润性测试中的应用
钠电新突破:实现宽温长寿命电池的电解液革新
镍氢电池的电解液是什么
ATA-3080C功率放大器在电解液体浸润性测试中的应用
高压电解电容虚标原因,高压电解电容虚标怎么判断
新宙邦拟在美国投建10万吨/年电解液项目
新宙邦美国路易斯安那州碳酸酯溶剂和锂离子电池电解液项目启动
LG、三星、索尼与A123圆柱电池设计及性能比拼
锂离子电池生产过程中湿度控制的重要性





 电解液中LiPS的解离和结合行为
电解液中LiPS的解离和结合行为











评论