肿瘤干细胞(CSCs)是癌症复发、恶化和无效治疗的主要原因之一。免疫检查点疗法是目前肿瘤治疗中潜力较大的一种治疗策略,如抗程序性死亡-1抗体(aPD-1)的免疫治疗已经在多种肿瘤治疗中发挥抑瘤的作用。但是,整体的治疗效果往往受到CSCs免疫逃避的限制。抗CSCs的治疗将有助于提升癌症的整体治疗效果,改善目前临床中免疫检查点疗法的局限。
基于此,广州医科大学谢茂彬教授团队研制了一种集协同免疫和氢治疗于一体的可穿戴丝质微针装置(SMND),由双层MN贴片(DLMNP)组成,以载aPD-1的丝素蛋白(SF)为内基质,以载氨硼烷的介孔二氧化硅纳米颗粒(AB-MSN)包覆聚己内酯为外热响应涂层进行H₂释放。结果显示该协同治疗策略可实现令人满意的抗肿瘤和抗CSCs疗效,同时全身毒性最小。相关工作以“A Smart Silk-Based Microneedle for Cancer Stem Cell Synergistic Immunity/Hydrogen Therapy”为题于2022年7月18日发表在Advanced Functional Materials期刊。
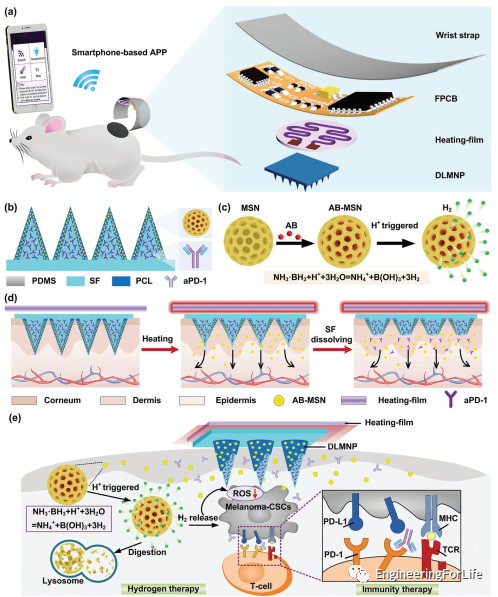
图1 SMND制备与智能给药原理图。a)无线连接SMND经皮给药小鼠黑色素瘤模型示意图。b)负载双药的DLMNP的结构。c)AB-MSN的制备方法示意图及酸触发分解和H₂释放机理。d)智能手机控制SMND的智能热响应药物释放示意图。e)SMND抗CSCs协同免疫/氢治疗机制示意图。
研究人员开发的SMND体积小巧、重量轻,由于其可弯曲性和手腕带的灵活性,可以包裹在患者的手腕上。加热膜与FPCB电连接,粘在DLMNP背面。FPCB尺寸为50mm × 25mm,重量较轻,只有24g。此外,SMND的加热膜是微型的,直径为10mm,厚度为0.5mm。采用微成型技术在PDMS母模上制备了该贴片的DLMNP。光学显微镜表征了DLMNP的结构和形态。每个金字塔MN都整齐地排列成15 × 15方阵,中心距离为1500μm。每个MN的平均高度为600μm,顶端直径为20μm,底部直径为200μm。罗丹明6G作为模型药物,包裹在DLMNP中。结果表明,罗丹明6G可以在MN中均匀荷载。使用定制开发的智能手机APP进行SMND在实际应用场景下的调试。首先点击APP图标进入APP界面。整个界面分为搜索蓝牙按钮、加热按钮、停止加热按钮三个功能按钮,以及蓝牙信息显示窗口和实时温度显示窗口两个显示窗口。然后,点击SEARCH面板,找到目标蓝牙BT16。最后,在蓝牙信息显示窗口点击BT16,即可成功连接智能手机与FPCB的蓝牙连接。同时,FPCB中的红灯会亮起来,表示连接成功。然后点击HEAT面板,触发加热膜的加热功能。同时,可以实时显示温度,并伴有灯图标的颜色变化。一旦温度达到50摄氏度,它就会保持这个温度。点击STOP按钮后,温度会逐渐下降。因此,可以通过APP指令HEAT/STOP启动热膜热驱动和热控制。

图2 SMND的电子和物理结构。a)腕带下SMND与FPCB组装的光学图像。b)FPCB上详细块电路的光学图像。c)与FPCB电连接的柔性加热膜的光学图像。d)DLMNP的数码照片。e)罗丹明6G染色DLMNP及其平台的数字显微镜图像(f)和侧视图(g)。h)定制智能手机APP加热控制和数据显示的实时操作:(步骤1)点击桌面图标进入APP;(步骤2)点击SEARCH面板查找目标蓝牙名称;(步骤3)选择目标蓝牙BT16进行连接;(步骤4)点击所述HEAT面板,对所述柔性电路进行加热控制;(步骤5)点击停止面板,停止加热。
DLMNP由SF基内层MN和PCL基外层组成。DLMNP的表面是白色的,而不是像内部SF MN那样透明的。在喷涂前后,除表面外观外,DLMNP的形状和结构没有变化。在DLMNP表面观察到多孔和颗粒形态,同时内SF MN表面相对光滑。此外,还引入了FITC标记的PCL,并将Rhodamine 6G标记的SF引入DLMNP制造过程,通过这两种染料之间的发射波长差异来帮助区分这两种成分。显然,在DLMNP的每一根针中都可以观察到红色和绿色的荧光,证明了整个DLMNP中两种化合物的均匀整合。共聚焦激光扫描显微镜(CLSM)图像显示了DLMNP的双层结构。采用乙醇蒸气后处理来调节SF的二级结构,以控制其溶出速率。通过FTIR和X射线衍射(XRD)揭示不同时间(0、2、4、6和8h)乙醇蒸汽处理SF MN内部的构象和二级结构变化。未经乙醇蒸汽处理的原始SF MN在1656/cm(酰胺I)、1537/cm(酰胺II)、1250/cm(酰胺III)处的红外吸收峰相对较弱,在12.1处有一个典型的丝I晶体峰,具有典型的无规则线圈构像和主要的非晶结构特征,[26a,29]对应着快速溶解的特征。然而,经过乙醇蒸汽后处理的SF MN在1627/cm(酰胺I)、1525/cm(酰胺II)、1526/cm(酰胺II)和1230/cm(酰胺III)处出现了尖锐的吸收峰,以及显著的典型丝状II晶体峰,在XRD中为20.2°、28.0°和30.9°,这是β-薄片构像的代表。未处理的SF MN比后处理的SF MN在开始时的药物释放率明显更高。在28h内,原始SF MN的累积药物释放量达94.1% ± 4.2%,而8h乙醇蒸汽后处理SF MN的累积释药量仅为55.2% ± 3.3%。不同的乙醇蒸汽处理时间对SF MN后处理的释放速率有影响。随着乙醇蒸汽处理时间的增加,SF MN后处理药物释放速率减慢。力学试验中DLMNP的穿透力如图所示,由于猪皮的固有阻力特性,力随着载荷位移的增加而逐渐增大。随着插入的进行,可以清楚地观察到P点插入力的一个小的突然下降。这表明DLMNP压缩超过了皮肤破裂极限,导致皮肤穿透。因此,DLMNP的穿透力为0.58N,远小于破坏力1.78N。此外,对处理过的猪皮进行了观察,发现具有类似大小的DLMNP的阵列排列的红色斑点,表明DLMNP确实在皮肤上产生了微孔。DLMNP拥有aPD-1加载的内矩阵和AB-MSN封装的PCL涂层。制备了热响应的PCL涂层,用于控制H₂的释放。PCL的热相变特性赋予了DLMNP的热反应性能,可以通过探索封装aPD-1的释放来反映。DLMNP加热15min(50℃),未涂覆MN组在228h内累积释放aPD-1为49.0% ± 2.4%,略高于未加热的DLMNP组(33.19% ± 1.2%)。相反,加热组的aPD-1释放量在初始15min内急剧增加,表明PCL在加热到阈温度后发生了由固态到液态的相变。考虑到MN加热导致aPD-1失活的风险,研究人员测试了aPD-1从DLMNP中释放后的生物活性。据估计,释放的aPD-1在4℃下储存16天后,90%以上的aPD-1仍然具有与PD-1抗原结合的生物活性。同样,PCL在DLMNP中的热相变特性可以通过H₂的释放反映。只有当温度达到50℃(PCL的相变温度)时才能生成H₂,这进一步说明了DLMNP的热响应能力。
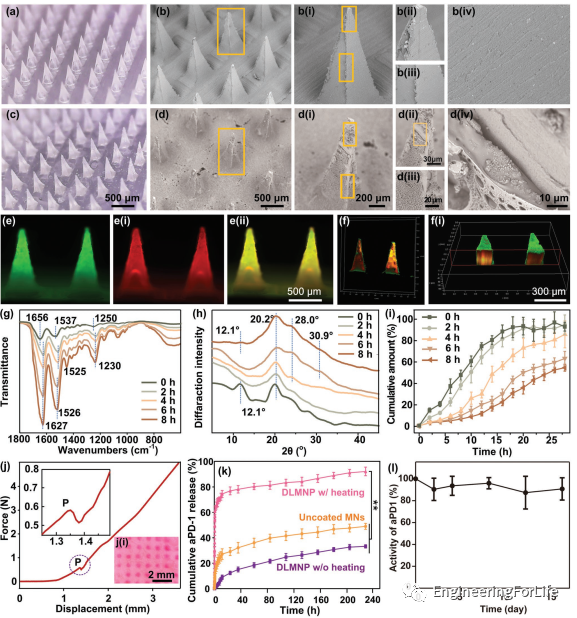
图3 DLMNP的理化特性。a)未涂PCL的DLMNP的数字显微镜图像。b)未涂PCL的DLMNP的SEM图像:b(i)单个MN;b(ii)MN的上尖端;b(iii)MN的主体;b(iv)MN的表面。c)PCL涂层DLMNP的数字显微镜图像。d)DLMNP的SEM图像:d(i)单个MN;d(ii)MN上尖;d(iii)MN体;d(iv)MN表面。e)DLMNP的荧光图像:外层包埋FITC(绿色),内部MN包埋罗丹明6G(红色);e(ii)它们的重叠部分(黄色)。f和f(i)不同视图下DLMNP的三维共焦重建图像。g-i)不同时间(0、2、4、6、8h)乙醇蒸气处理DLMNP内SF MN的理化特征:(g)SF MN的FTIR;(h)SF MN的XRD;(i)SF MN的溶解谱。j)DLMNP的机械穿透曲线和j(i)经DLMNP处理的皮肤样本图片。k)随着时间的推移,在37℃ PBS(pH=7.4)中培养的DLMNP体外积累aPD-1释放。l)aPD-1从DLMNP释放后的生物活性。
为了评价SMND的体内抗癌和抗CSCs效率,研究人员采用B16F10-CSCs荷瘤小鼠模型模拟临床转移性黑色素瘤。注射aPD-1的小鼠在最初的8天内肿瘤生长延迟,而随后肿瘤明显复发,在AB-MSN组也发现了类似的趋势。DLMNP联合AB-MSN组和DLMNP联合aPD-1组肿瘤消退作用有限,肿瘤复发是由于CSCs的异质性导致的免疫耐受所致。相反,经aPD-1 + AB-MSN治疗的DLMNP小鼠表现出持续的肿瘤抑制作用,一些肿瘤在治疗后甚至消失。14天后,经aPD-1 + AB-MSN治疗的DLMNP小鼠的肿瘤重量(39.8 ± 21.5mg)远小于经AB-MSN治疗的DLMNP(671.6 ± 24.7mg)和经aPD-1治疗的DLMNP(601.4 ± 31.7mg)。血红素和伊红(H&E)染色图像显示,在aPD-1 + AB-MSN的DLMNP治疗的动物模型的大部分肿瘤区域出现广泛的组织病理学和坏死。结果表明,免疫治疗和氢治疗的协同抗肿瘤作用比单一治疗更有效。不同处理后未观察到明显的体重、减轻或其他临床毒性迹象,这表明DLMNP联合aPD-1 + AB-MSN治疗可能是一种安全的治疗策略,具有很大的临床潜力。为了进一步证实DLMNP在肿瘤部位的持续释放aPD-1,研究人员在不同时间点收集治疗过的肿瘤进行免疫染色。aPD-1组在给药日(第0天)肿瘤部位出现较强的抗体信号。DLMNP传递的aPD-1在3天内产生连续信号,具有持续免疫治疗的潜力,并极大地避免了重复穿刺以保持足够的药物浓度。
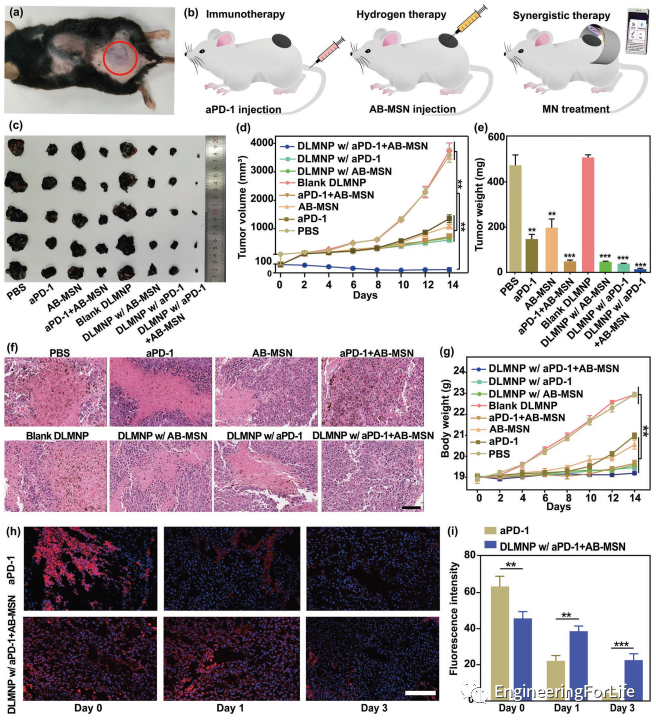
图4 SMND的体内协同抗癌效率。a)小鼠背侧及相关皮肤(红圈内区域)经皮注射SMND的DLMNP。b)对B16F10-CSCs小鼠模型进行不同处理的示意图。c)小鼠治疗后肿瘤的代表性照片。d)肿瘤生长曲线和e)B16-CSCs荷瘤小鼠在治疗14天后的肿瘤重量。f)治疗14d后切除肿瘤代表性H&E染色图像。g)B16 CSCs荷瘤小鼠治疗14天内体重。h)不同时间点aPD-1处理肿瘤和aPD-1 + AB-MSN处理DLMNP的免疫荧光染色(绿色:aPD-1;蓝色:细胞核)。i)荧光图像分析的平均荧光强度。
综上所述,研究人员开发了一种可穿戴的蚕丝基微针装置(SMND),用于智能给药,并评估了其协同免疫和氢治疗黑色素瘤CSCs的效果。SMND的双层MN贴片(DLMNP)不仅可以实现热响应H₂释放,还可以实现aPD-1的持续传递,用于免疫治疗。这种协同CSCs治疗策略是双重保险。首先,H₂的热响应释放阻止了肿瘤细胞的增殖和迁移。此外,其较强的穿透能力可以消除肿瘤内部的CSCs,抑制CSCs的进一步分化。其次,aPD-1的持续释放阻断肿瘤免疫逃逸。氢处理后存活的肿瘤细胞进一步被T细胞捕获,从而有效避免肿瘤转移和复发。最后,患者可以在家通过智能手机通过SMND的智能电子元件管理给药过程,避免了医护人员的护理需求。在B16F10-CSCs小鼠黑色素瘤模型中,协同治疗实现了令人满意的抗CSCs效果,同时全身毒性和副作用最小。
论文链接:
https://doi.org/10.1002/adfm.202206406
审核编辑 :李倩
-
贴片
+关注
关注
10文章
873浏览量
36924 -
微针技术
+关注
关注
2文章
74浏览量
8698 -
可穿戴
+关注
关注
4文章
760浏览量
85422
原文标题:用于癌症干细胞协同免疫/氢治疗的智能蚕丝微针
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐

半侵入式"可穿戴诊所"——微针技术的创新应用
柔软可拉伸的新型3D打印材料可改善可穿戴传感应用
研究人员提出一种电磁微镜驱动系统
研究人员制造可将短波红外光的频率“上转换”到可见光频率范围装置
一种可实现稳定压力传感的新型可拉伸电子皮肤
一种用于化学和生物材料识别的便携式拉曼光谱解决方案
一种基于单像素光电探测器的高光谱视频成像系统设计

自发电设备:可穿戴设备的能量收集技术取得重大进展





 研究人员开发了一种可穿戴的蚕丝基微针装置
研究人员开发了一种可穿戴的蚕丝基微针装置











评论