01
研究背景
将生物质分子(一种可用且丰富的可再生有机碳源)转化为有价值的有机化学品是减少化学工业碳排放的有效方法。在各种生物质分子中,由C6 糖水解产生的5-羟甲基糠醛 (HMF) 可以被催化还原制备2,5-二羟甲基呋喃 (DHMF),它是生产聚醚、聚氨酯和聚酰胺的重要前驱体。目前,它是由HMF在高压和高温下加氢制备的。因此,需要开发在温和条件下不使用H2将HMF氢化为DHMF的可持续方法。最近的进展表明,电化学驱动是替代加氢过程的一种可持续方式。对于HMF加氢生成DHMF,它可以通过直接电还原途径进行,其中羰基参与电极处的电子转移,或者通过表面吸附 H(表示为 H*)进行电催化加氢 (ECH)。然而,HMF加氢活性通常比析氢反应 (HER) 低,导致DHMF的法拉第效率 (FE) 降低。为了克服这个问题,HMF氢化最好在具有高HER过电位的电极上进行,例如Cu和Ag。之前的大多数报告都是基于对低浓度HMF(通常为 20 mM)的研究。高浓度的HMF(》100 mM)通常会导致FE和DHMF的选择性降低,这是由于严重的HMF二聚化。近年来,由位于主体金属基体中的外来金属的孤立原子组成的单原子合金(SAA)催化剂引起了较大的关注。除了最大限度地利用单原子的特点外,SAA还表现出独特的双金属协同效应。
02
成果简介
清华大学段昊泓教授制备的Ru1Cu单原子合金在用于HMF电化学还原中表现出比铜合金更出色的性能,在-0.3 V(vs. RHE)下DHMF的产率为0.47 mmol cm-2h-1,FE为85.6 %。Ru1Cu单原子合金也可以在高浓度下发生HMF二聚反应,DHMF的FE在高浓度(100 mM)时基本保持不变。该工作“Electrocatalytic Hydrogenation of 5-Hydroxymethylfurfural Promoted by a Ru1Cu Single-Atom Alloy Catalyst“为题发表在《Angewandte Chemie International Edition》上。
03
研究亮点
1. 单原子Ru在促进水解离中起着关键作用,增加了H*的表面覆盖率,减少了HMF的羰基覆盖率;
2. 通过电催化加氢(ECH) 机制获得了DHMF。
04
图文导读
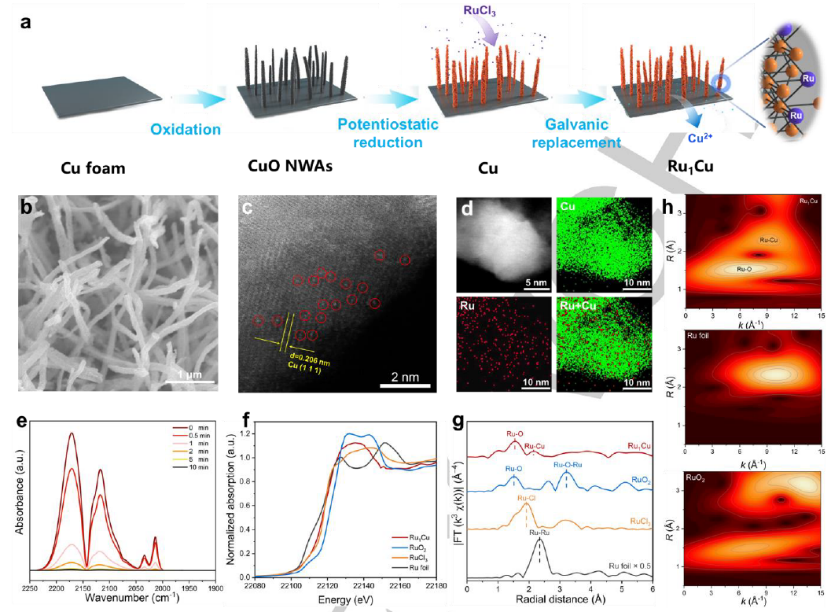
图 1. (a) Ru1Cu SAA合成示意图。Ru1Cu SAA的 (b) SEM。(c) RHAADF-STEM,其中红色圆圈显示单分散的Ru原子。(d) STEM-EDS映射。(e) 在室温下用He吹扫的Ru1Cu SAA的CO-DRIFTS光谱。(f) Ru K-edge的XANES 光谱。(g) Ru K-edge的傅里叶变换EXAFS光谱和 (h) Ru箔、RuO2和Ru1Cu SAA的小波变换EXAFS光谱。
合成过程如图1a 所示。通过在碱性条件下用 (NH4)2S2O8对Cu泡沫进行简单的化学氧化,然后在空气中煅烧来制造CuO纳米线阵列 (NWA)。通过在电化学系统中在阴极电位下还原母体CuO纳米结构,获得了Cu NWA。然后,通过电流置换法将单原子Ru引入Cu NWAs中,获得Ru1Cu SAA。SEM(图 1b)显示了Ru1Cu的纳米线阵列形态,这表明原始的Cu结构被保留。如图1c所示,HAADF-STEM与EDS相结合显示了Ru原子在 Cu NWA 中的孤立分散,没有观察到Ru簇或纳米颗粒。EDS-mapping(图 1d)证实了 Ru 物种在整个Cu NWA中的存在和均匀分布。通过CO-DRIFTS证实了Ru 在Ru1Cu SAA中的分离(图 1e)。图 1f 显示了Ru1Cu的Ru K边的X射线吸收近边光谱 (XANES)。Ru1Cu的吸附边缘位于Ru箔和RuO2之间,靠近RuCl3,在扩展的 X 射线吸收精细结构光谱(EXAFS,图 1g)中,1.50 Å 处的Ru1Cu的第一层归因于Ru-O,2.17 Å归因于Ru-Cu。图 1h 中的小波变换 (WT) 进一步证实了 Ru-Cu 散射的存在。Ru-Cu键(2.17 Å,9.1 Å-1)存在于Ru1Cu中,明显不同于Ru箔和RuO2,表明形成了分散在铜纳米线上的原子级钌原子。
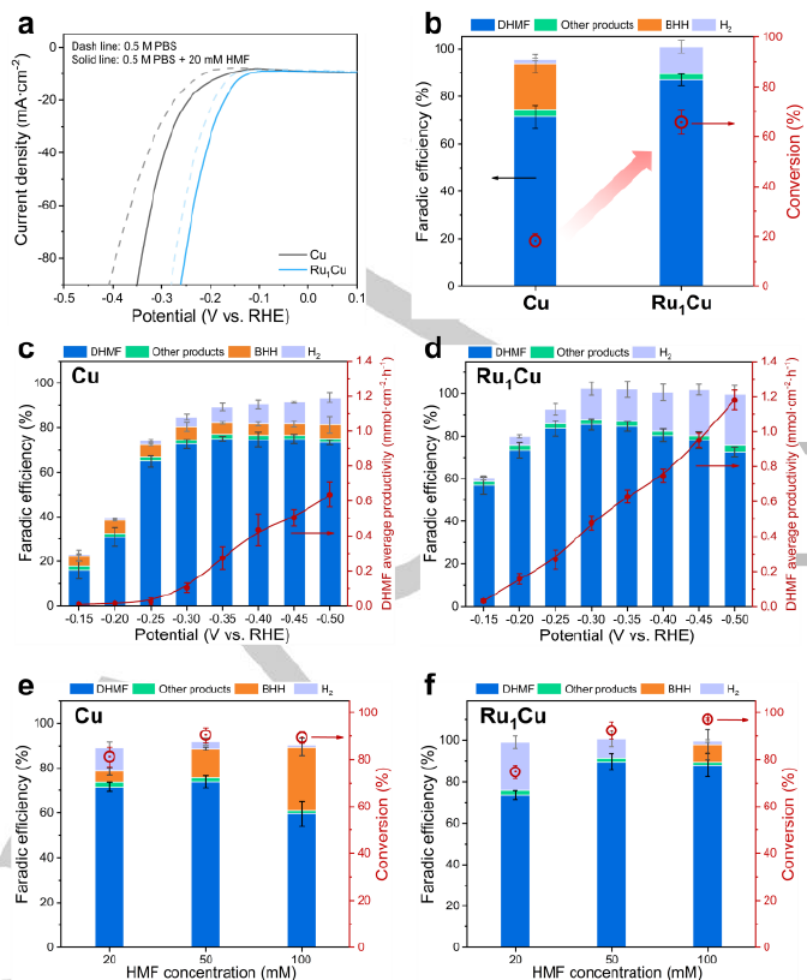
图 2.Ru1Cu SAA 和Cu的电化学性能。(a) 含和不含20 mM HMF的0.5 M PBS中Cu和Ru1Cu的LSV曲线。(b) Cu和Ru1Cu的产物分布及相应转化率。DHMF 在 (c) Cu 和 (d) Ru1Cu上的产物分布和生产率。不同浓度的HMF 下,HMF在 (e) Cu 和 (f) Ru1Cu上的产物分布和相应转化率。
图2a显示,添加20 mM HMF后,Ru1Cu SAA和Cu均表现出增强的电流密度,表明HMF的电化学还原比HER更有利。图2b显示,Ru1Cu SAA 比Cu表现出更高的转化率和DHMF的更高FE。如图 2c-d所示,在不同的电位下,与Cu相比,Ru1Cu SAA显示出更高的DHMF生产率和FE。Cu在HMF 浓度增加时显示DHMF的FE降低(图 2e),这主要是由于BHH的形成。相比之下,Ru1C在高HMF浓度下显示抑制HMF二聚化(图2f),导致DHMF 的FE更高。
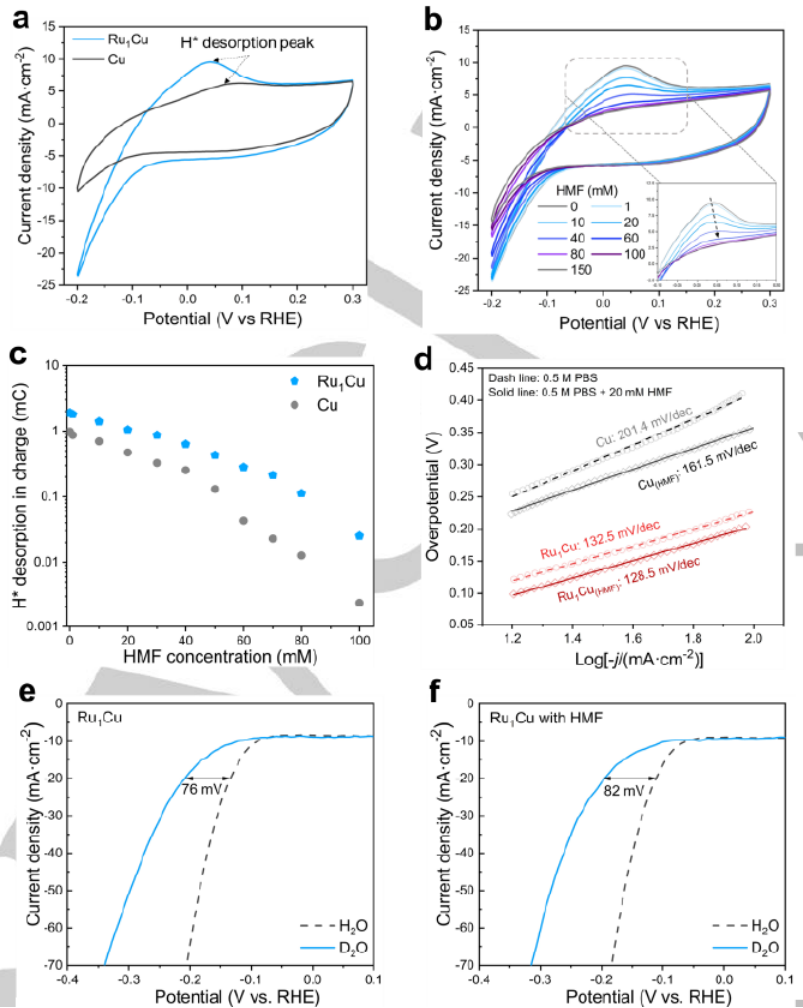
图 3. (a) Cu和Ru1Cu在 0.5 M PBS中的CV曲线,扫描速率为 100 mV·s-1。(b) 添加不同浓度HMF的Ru1Cu的CV曲线,插图显示放大的H*解吸峰。(c) 不同HMF浓度下 Cu和Ru1Cu上的H*解吸电荷。(d) 在HMF存在和不存在的情况下,HER在Cu和 Ru1Cu上的Tafel图。(e-f) 在不添加和添加20 mM HMF的情况下,在pH 7.0或pD 7.0电解液中Ru1Cu的LSV曲线。
纯电解液中的循环伏安图(CV)在Cu和Ru1Cu的阳极扫描中显示 0.09 V 和 0.03 V的峰值,分别归因于 H* 解吸(图 3a)。H*解吸峰明显大于Ru1Cu,表明电极上存在更多的H*。之后,随着 HMF 的加入,两个样品的 H* 解吸峰变得更小并被完全抑制(图 3b)。通过对H*解吸峰的面积进行积分,然后计算不同HMF浓度下的相应电荷(图 3c),Ru1Cu显示出更高的H*解吸电荷量,从而反映了更高的H*覆盖范围。通过Tafel图评估HER和电化学还原的动力学(图 3d)。Cu和Ru1Cu的HER的 Tafel 斜率分别为 201.4 和 132.5 mV dec-1,这表明Volmer步是两种样品的速率决定步。随着 HMF 的加入,这两个样品的 Tafel斜率表现不同。与 HER (201.4 mV dec-1) 相比,在 HMF存在下,Cu的Tafel斜率降低,这意味着HMF的电化学还原在动力学上比HER优于Cu,并且 RDS也相应变化。与HER(132.5 mV dec-1)相比,Ru1Cu在HMF存在下表现出相似的Tafel斜率,这表明在Ru1Cu上电化学过程的 RDS 受引入HMF的影响较小,即 RDS可能仍然是HMF电化学还原中的Volmer步骤。在LSV中,HER 和电化学还原反应都揭示了动力学同位素效应 (KIE)(图 3e)。对于 HER,在 Cu上观察到明显的阴极位移,表明氘释放 (DER) 的动力学比HER更缓慢。然而,与Ru1Cu相比,阴极位移不太显着(图 3e),这意味着单原子Ru在促进水分解中起着至关重要的作用,可能是通过促进产生H*的 Volmer 步骤。对于 HMF的电化学还原,在Ru1Cu上观察到类似的KIE阴极位移程度(图 3e,f),表明电化学还原的 RDS 保持为 Volmer 步骤,这与HER的几乎相同的 Tafel 斜率值和HMF的电化学还原一致(图 3d)。因此,推断HMF在Ru1Cu上的电化学还原可能遵循ECH机制,其中H*通过Volmer步骤产生,用于随后的HMF加氢。对于通过ECH过程进行HMF还原,即H*生成后HMF加氢,它将遵循 Langmuir-Hinshelwood (L-H) 机制,表明HMF和H2O之间存在竞争吸附。因此,可以预期在更高的 HMF 浓度下会出现负反应顺序。相比之下,对于HMF的电还原,它将遵循 Eley-Rideal (E-R) 机制,这表明HMF和H2O之间存在非竞争性吸附,这在较高的HMF 浓度下由零反应级揭示。相比之下,Cu 显示0.2级,接近零级。
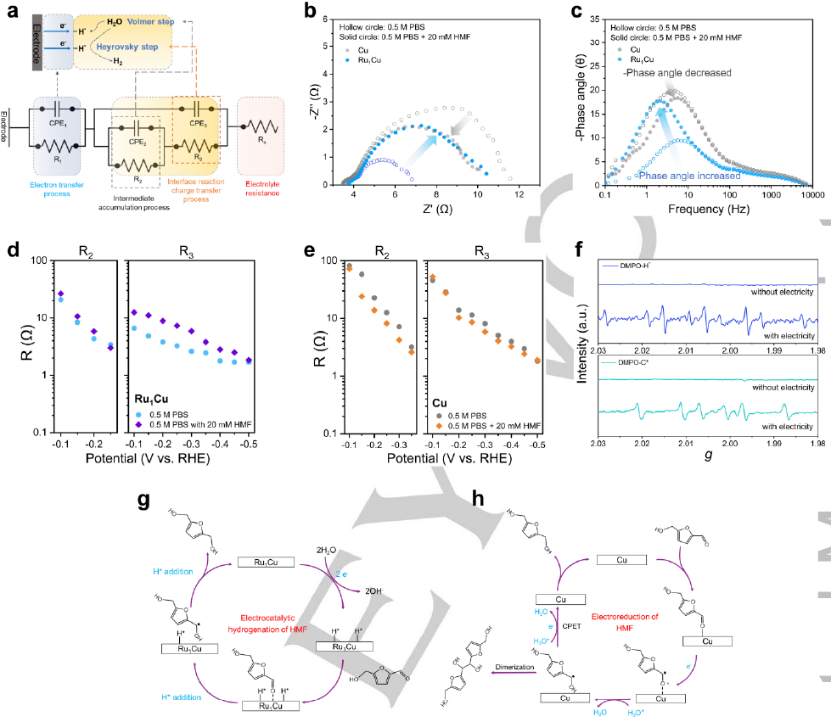
图4. (a) 电化学阻抗谱拟合中使用的等效电路模型和所提出的Cu和Ru1Cu的HER机理示意图。在-0.3V(vs. RHE)下Cu和Ru1Cu上(b) 奈奎斯特图和 (c) HER 波特图。在存在和不存在HMF的情况下,在从-0.1 V到-0.5 V的电位窗口下 (d) Ru1Cu 和 (e) Cu中间积累的等效电阻 (R2) 和界面反应电荷转移过程电阻 (R3) 的相关性。(f)Ru1Cu上碳和氢自由基的准原位EPR谱图。HMF在 (g) Ru1Cu和 (h) Cu上的电化学还原机理。
引入HMF来评估电化学还原行为。在相同的施加电位下,随着 HMF 的加入,Cu 上中低频的半圆(图 4a,b)和相位度(图 4c)下降,但在Ru1Cu上观察到相反的趋势,表明随着 HMF 的加入,Ru1Cu和Cu上的电荷转移过程以不同的方式发生了变化。比较了不同电位下有或没有HMF的中间积累过程 (R2) 和界面反应电荷转移过程 (R3) 的等效电阻(图 4d-e)。对于Ru1Cu,R2(图 4d,左)没有明显变化,因为Volmer步骤是HER和ECH在Ru1Cu上的常见步骤。而 R3(图 4d,右)在从-0.1 V到-0.45 V的电位窗口下随着HMF的添加而增加,这意味着在HMF存在下,Heyrovsky步骤在动力学上是不利的。至于Cu,R2(图4e,左)随着HMF的添加而降低,这表明HMF的电还原更倾向于通过CPET工艺而不是Volmer步骤进行。R3(图4e,右)仅略微降低,这可以通过CPET在HMF的电化学还原和HER中的Heyrovsky步骤显示出比较电阻的相似动力学来初步解释。图4f显示在纯电解质中观察到H自由基超过Ru1Cu,这意味着水可以被还原为H自由基。当随后引入HMF时,碳自由基被检测为六重体。基于上述组合电化学技术,提出在Cu中制备单原子Ru改变了HMF的电化学还原机制。在Ru1Cu 上,水在单原子Ru上被活化,伴随着电子转移和解离成H*物种,然后是两个H* 物种通过ECH机制与HMF的羰基反应生成DHMF(图 4g)。而 Cu 通过电还原机制进行,其中HMF的羰基接受来自电极的电子并通过CPET工艺与邻近的质子相结合。生成的自由基中间体通过另一个CPET过程进一步转化为DHMF,或者可能通过与另一个自由基的C-C偶联发生二聚化(图 4h)。
05
总结与展望
作者合成了一种Ru1Cu单原子合金,它对HMF的电化学还原比Cu表现出更好的性能,实现了更高的DHMF生产率(0.47 mmol·cm-2·h-1)和 FE(85.6%)。在高HMF浓度(100 mM)下DHMF的FE为87.5%。通过使用各种电化学技术表征的动力学结果表明,Ru1Cu和Cu对应物的电化学还原机制不同。单原子Ru促进水的离解产生H*物质,这些物质通过ECH机制与HMF有效反应生成DHMF,而Cu遵循CPET工艺。这项工作为实现生物质升级的高效电催化加氢提供了一种新的策略。
06
文献链接
Electrocatalytic Hydrogenation of 5-Hydroxymethylfurfural Promoted by a Ru1Cu Single-Atom Alloy Catalyst (Angew. Chem. Int. Ed.2022, DOI: 10.1002/anie.202209849)
文献链接:
https://doi.org/10.1002/anie.202209849
审核编辑 :李倩
-
电化学
+关注
关注
1文章
323浏览量
20611 -
光谱
+关注
关注
4文章
824浏览量
35195
原文标题:段昊泓Angew:Ru1Cu单原子合金促进HMF电催化加氢
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
Cu-Cu Hybrid Bonding技术在先进3D集成中的应用

实时原位监测光电催化过程中反应物浓度与热效应的微光纤传感器技术
中国科大在纳米级空间分辨红外成像及催化研究中取得新进展


EthernetiP转modbusTCP网关在加氢催化中的应用

EthernetiP转modbusTCP网关在加氢催化中的应用

上海交大JACS:单原子催化,非晶态载体更具优势!




 Ru1Cu单原子合金促进HMF电催化加氢
Ru1Cu单原子合金促进HMF电催化加氢











评论