在肌肉组织中,当线粒体DNA异质性超过一定水平或者线粒体功能失调时,会产生较少的三磷酸腺苷(ATP)和过多的活性氧(ROS) ,这会引发肌肉的萎缩、无力和耐力丧失。因此,研究如何恢复或改善线粒体功能以促进肌肉再生是一个有吸引力的课题。
线粒体转移是在各种病理条件下恢复受损细胞的自发过程。在给药之前将线粒体转移到细胞治疗产品中可以提高治疗效果。然而,先前报道的线粒体转移方法效率低,限制了它们的临床应用。
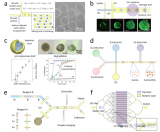
为了克服这些挑战,香港城市大学孙东教授团队提出了一种基于液滴微流控的线粒体转移技术,可以实现高效、高通量的线粒体定量转移至单细胞。该技术结合了共培养和液滴微流控的优点,对肌肉再生有较好的治疗作用。相关工作以“High-efficiency quantitative control of mitochondrial transfer based on droplet microfluidics and its application on muscle regeneration”为题,于近期发表在Science Advances上。
基于液滴微流控的线粒体转移系统
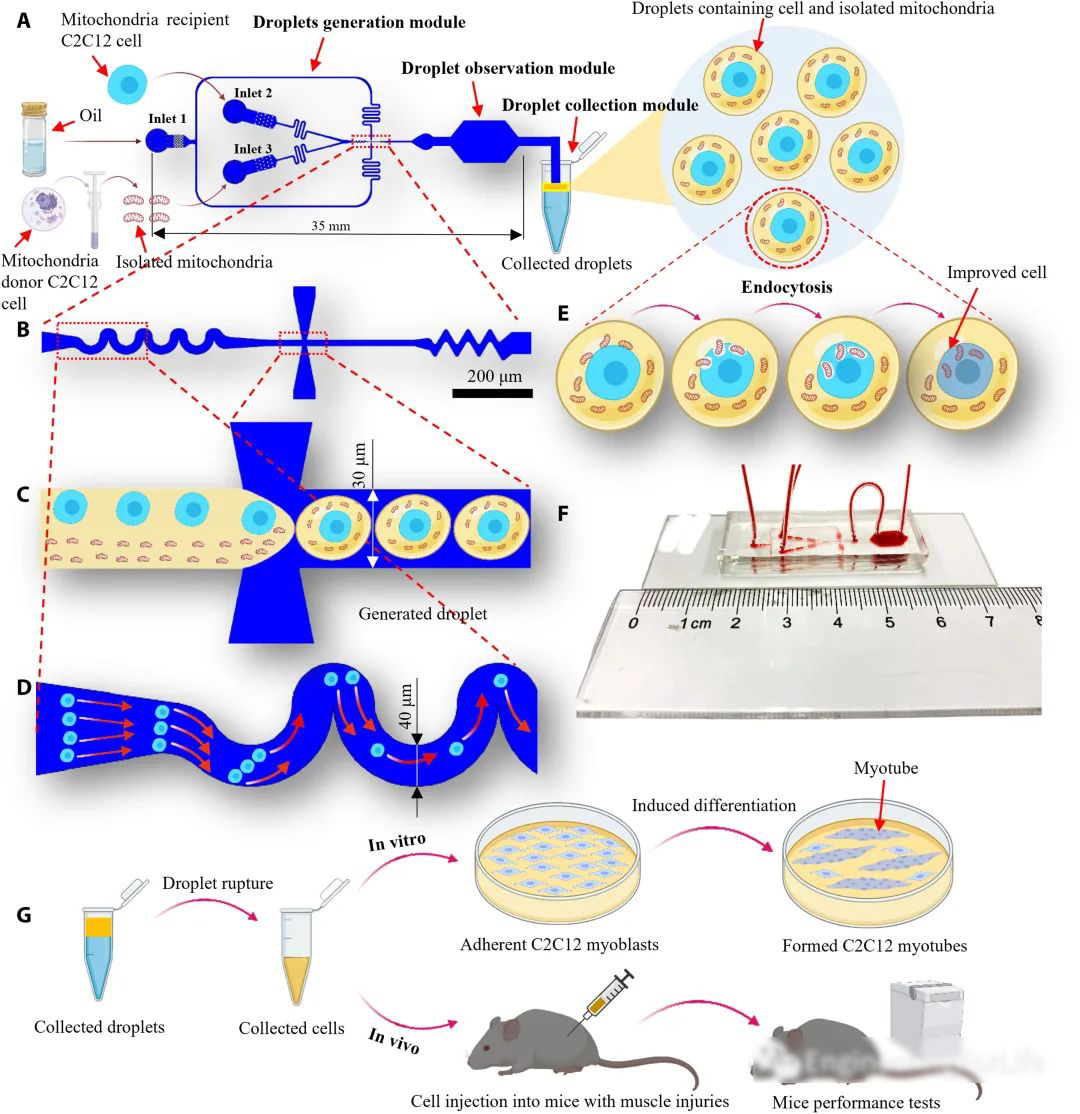
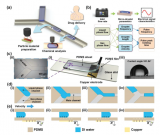
研究人员开发的基于液滴微流控的线粒体转移系统由三个模块组成:液滴生成模块、液滴观察模块和液滴收集模块。
该系统采用流动聚焦结构将线粒体受体C2C12细胞悬液和分离的线粒体悬液这两种悬浮液分离成液滴,波浪状结构用于增加单细胞封装率,同时降低多细胞封装率,提高封装效率(图1)。
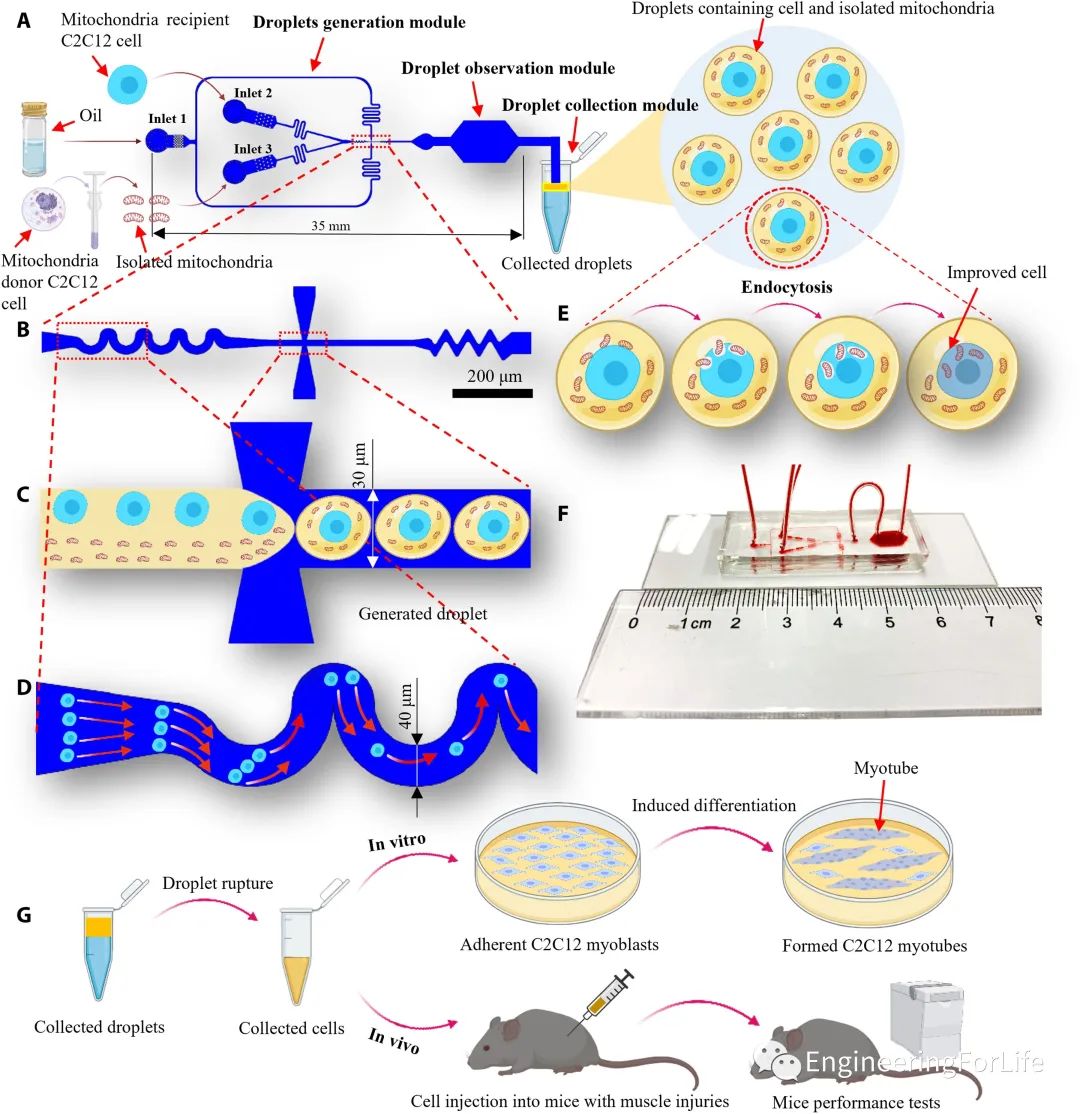
图1系统安装示意图、基于液滴微流控的线粒体转移技术的工作流程和实验评估
从图2可以观察到线粒体受体细胞C2C12和新鲜分离的线粒体加载到微流控芯片中进行封装和线粒体转移的过程。在产生的液滴***培养2小时后,分离的线粒体通过内吞作用被受体细胞吸收。
通过波浪状结构,封装效率提高到超过泊松分布,单细胞封装效率可达到约47.8%,而多细胞封装率被抑制至约5.9%。线粒体转移效率,随着液滴直径的增加而略微下降,但均在70%以上。使用本线粒体转移系统进行处理后,受体细胞的存活率仍然可以保持相对较高。
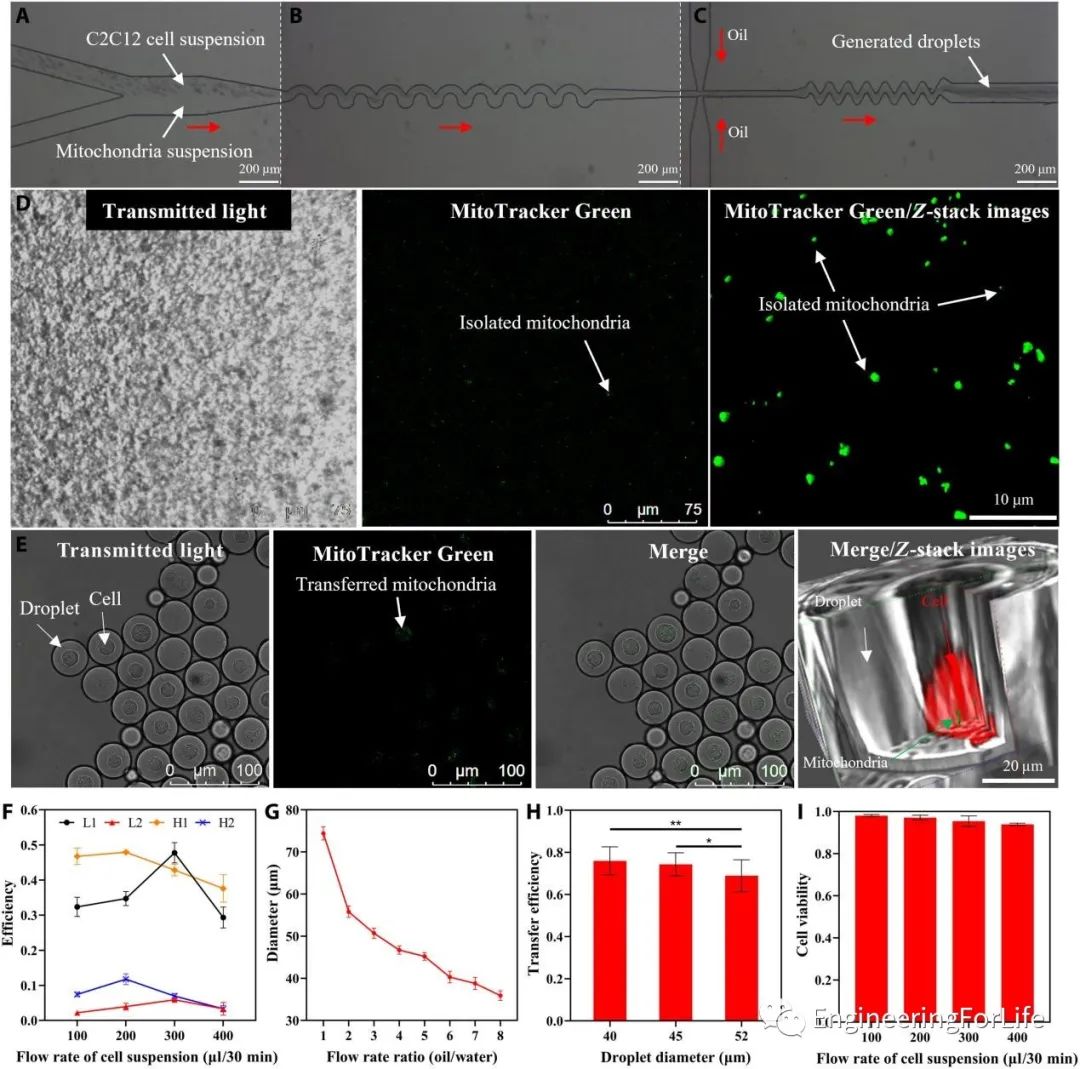
图2基于液滴微流控的线粒体转移系统展示
高效定量线粒体转移
液滴的封闭微环境限制了分离的线粒体的移动距离,增加了分离的线粒体接触细胞的概率。而转移到液滴细胞中的线粒体数量可以通过调整线粒体悬浮液的浓度来控制,从而可以对转移到受体细胞中的线粒体进行定量控制。
在该研究中,研究人员使用了三种不同浓度的分离线粒体悬浮液来验证所提出系统的转移效率。随着浓度的增加,线粒体转移效率略微上升。通过共聚焦显微镜进行观察和3D重建(图3)。
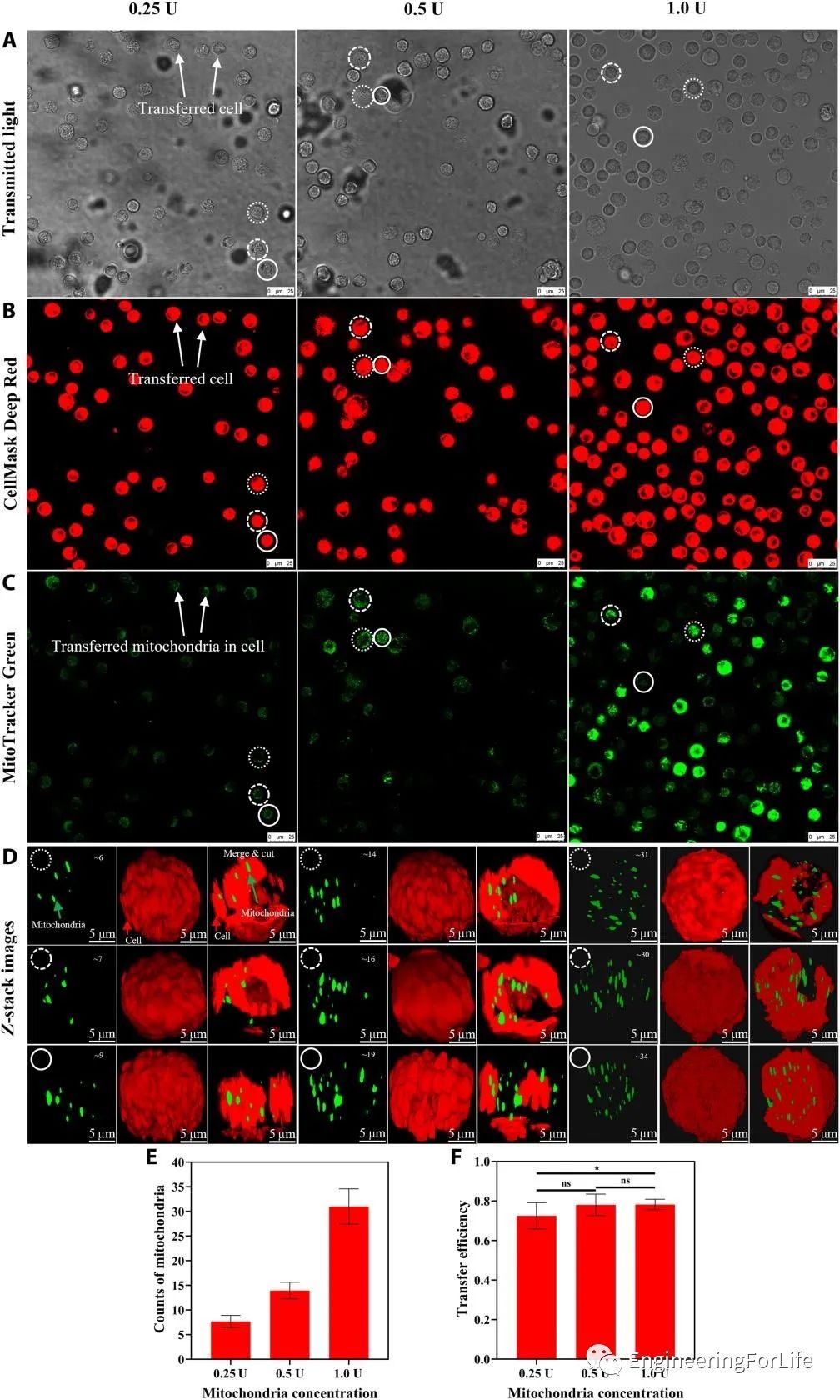
图3采用所提出的基于液滴的方法对线粒体转移进行定量控制
线粒体转移促进C2C12细胞增殖和成肌分化的体外研究
研究人员通过肌生成测定,来测试C2C12成肌细胞在使用该技术进行线粒体转移后的分化能力。结果表明,高线粒体转移组ATP水平和mtDNA含量显著增加(图4)。
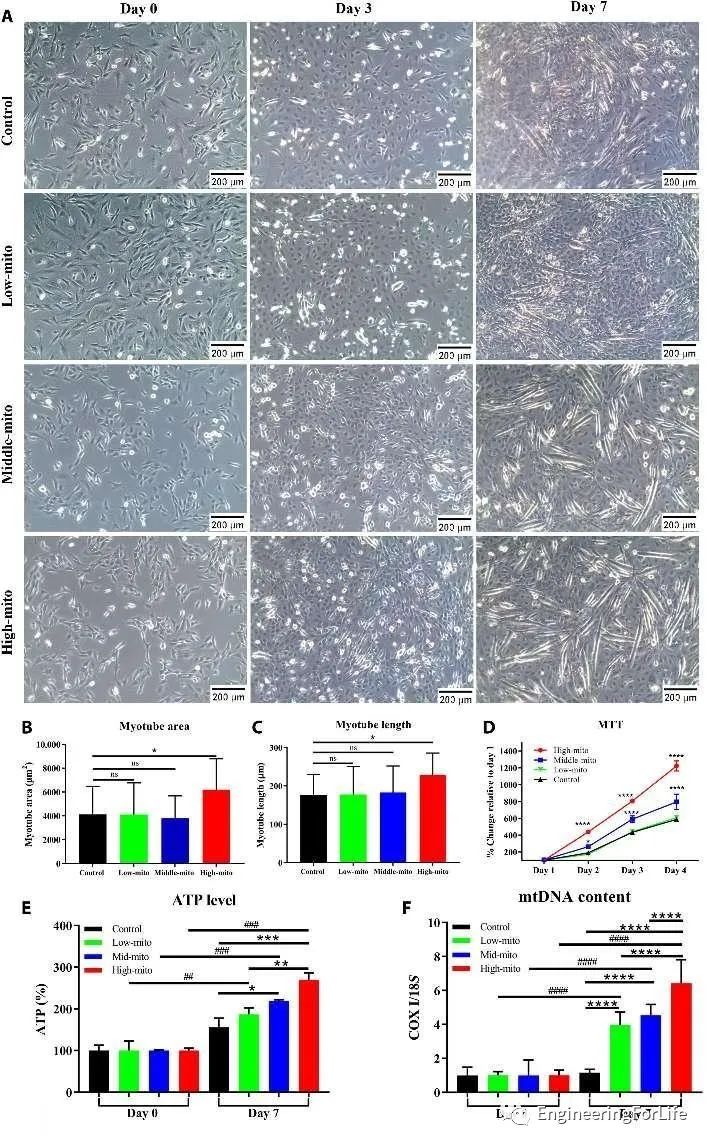
图4线粒体转移对C2C12成肌细胞成肌分化作用的体外研究
通过qPCR分析肌肉再生相关基因的表达水平。除磷酸甘油酸激酶1(Pgk1)外,其他标志物均以浓度依赖性方式在线粒体转移时显示出表达上调。特别的是,转移的线粒体过少或过多都不能促进Pgk1的表达,这一现象进一步表明了定量控制线粒体转移在精准医学中的重要性(图5)。
上述体外实验结果表明,高线粒体转移细胞(31个/每细胞)可以明显增强成肌分化和ATP的产生能力。基于此,研究人员在动物实验中使用高线粒体转移细胞来研究细胞疗法治疗的功能结果和剂量效应。
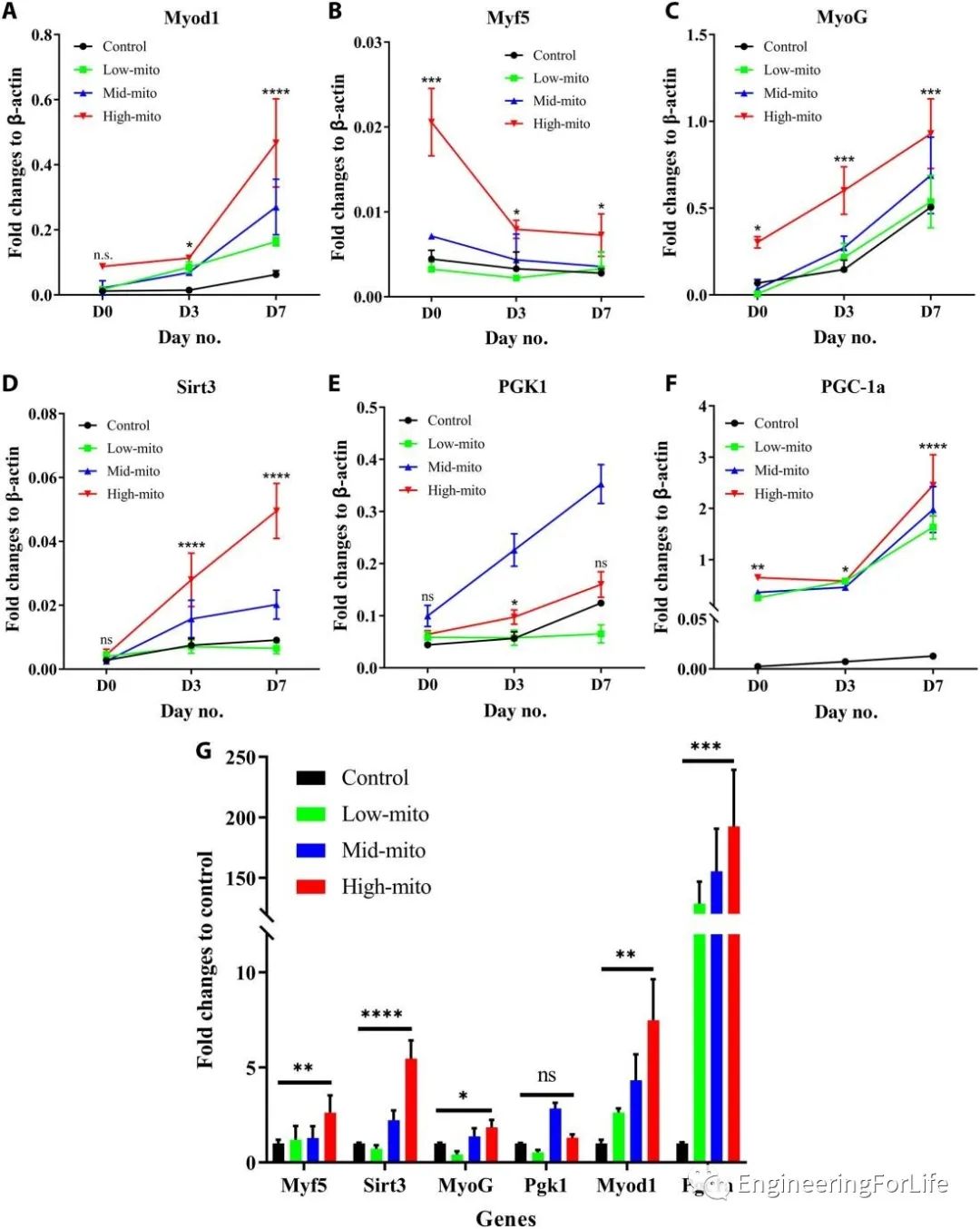
图5线粒体转移后C2C12细胞在成肌分化过程中的肌源性因子和线粒体相关基因的表达情况
肌内注射线粒体转移的C2C12以改善肌肉愈合质量和功能
研究人员通过小鼠肌肉损伤模型,来评估该技术的肌肉再生效果。没有线粒体转移的成肌细胞移植不足以促进受伤肌肉的愈合过程,注射高剂量细胞后可能产生免疫反应,而注射低剂量线粒体转移的C2C12细胞(LH组)获得该研究中最令人满意的愈合结果(图6)。
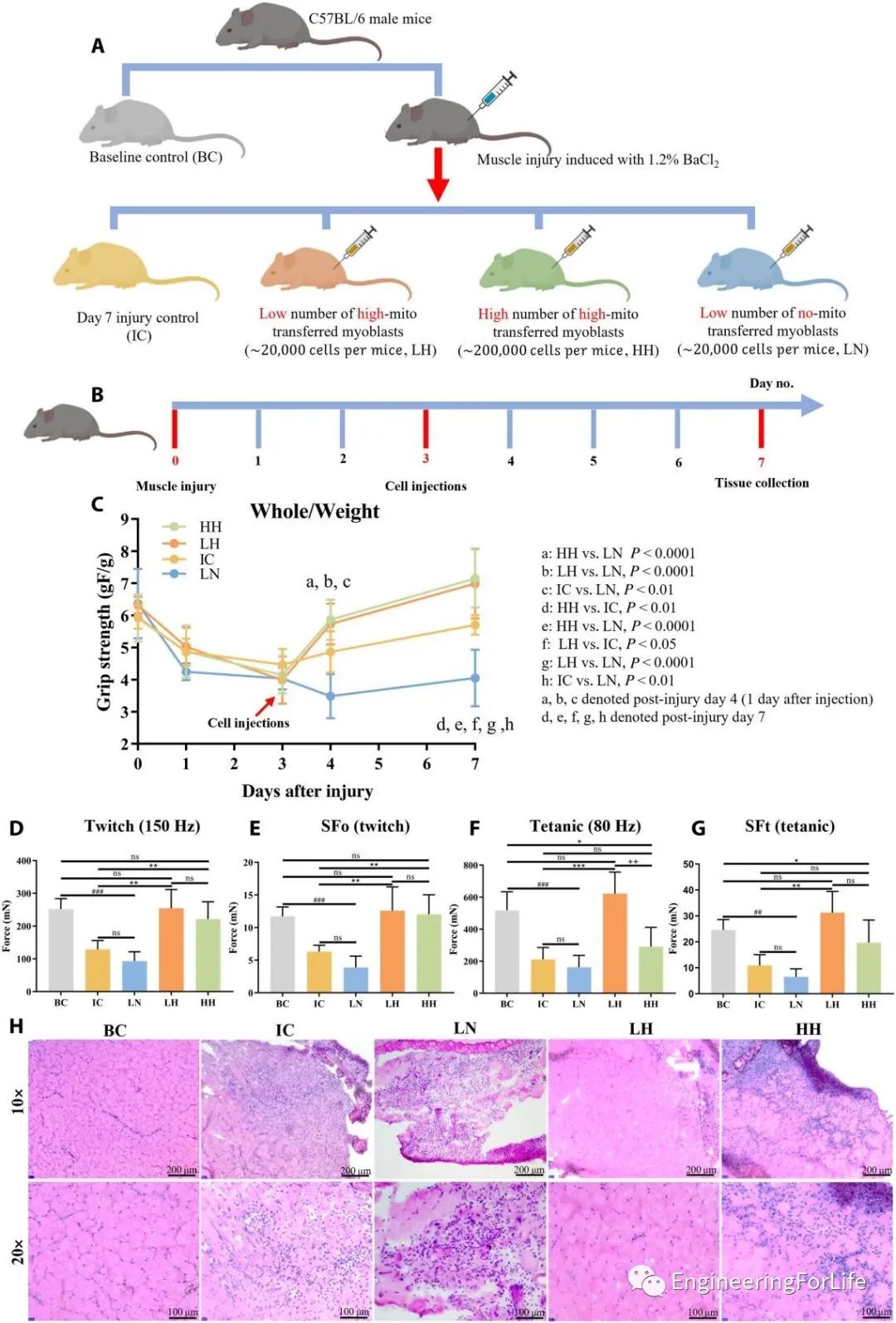
图6体内研究线粒体转移的C2C12注射对肌肉再生的影响
基因分析结果同样证明,LH的表达上调最高,这与功能评估中的最佳愈合结果一致(图7)。
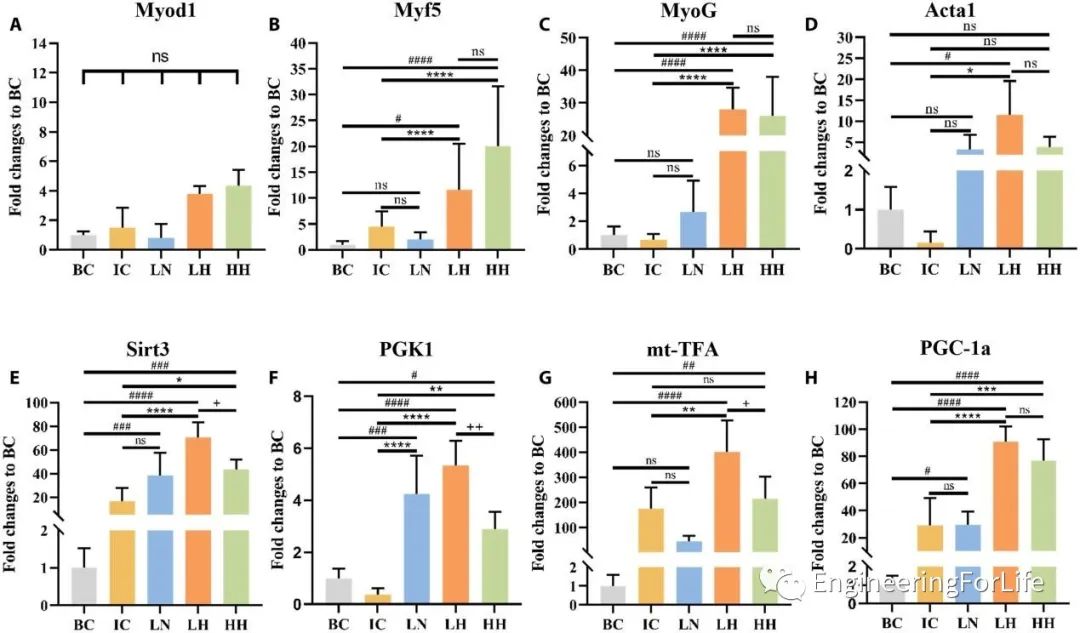
图7 C2C12细胞注射后肌肉损伤小鼠的肌源性因子和线粒体代谢基因表达水平
综上所述,研究人员开发了一种新的基于液滴微流控的线粒体转移方法,以克服定量高通量转移的局限性。该研究开辟了一条在给药前使用高效和高通量线粒体转移技术来***细胞治疗产品的新途径。所提出的技术可以显著促进线粒体转移的临床应用,优化细胞功能改善,用于线粒体相关疾病的细胞治疗。
审核编辑:刘清
-
ATP
+关注
关注
0文章
20浏览量
14731 -
QPCR
+关注
关注
0文章
6浏览量
6439 -
ROS
+关注
关注
1文章
276浏览量
16963
原文标题:基于液滴微流控的线粒体转移技术,实现线粒体高效、高通量转移
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
微流控芯片的层流与液滴的关系与作用
基于轨道电润湿的液滴操控技术,有望用于新一代数字微流控平台

微流控柱阵列装置中微小液滴的形成原理介绍





 介绍一种基于液滴微流控的线粒体转移技术
介绍一种基于液滴微流控的线粒体转移技术











评论