01
研究背景
近年来,具有高能量密度和长循环稳定性的锂电池极大地推动了可移动电子设备和电动汽车的发展。为了最大限度提高电池比能量,需要使用具有低电位、高比容量的负极,例如石墨、硅和锂。然而,这些负极和电解质之间会发生不可逆反应,严重影响电池寿命。除了在热力学上负极的高反应性外,负极表面结构对反应过程也会产生影响。因此,从微观层面了解电解质在负极表面的反应过程迫在眉睫。
02
成果简介
近日,清华大学张强教授和北京理工大学张学强教授在Science Advances上发表了题为“Inhibiting intercrystalline reactions of anode with electrolytes for long-cycling lithium batteries”的论文。该论文研究了锂金属负极晶界对负极和电解质之间反应的影响。结果表明,反应优先发生在晶界,导致晶间反应。因此,本工作设计了一种铝(Al)基杂原子偏析晶界(Al-HCGB),其中Al原子偏析在晶界处,能够抑制晶间反应。另外,该研究还展示了一种可扩展的Al-HCGB制备方法,显著提高了软包电池(355 Wh kg−1)的循环性能。
03
研究亮点
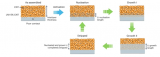
(1)本文探究了负极晶界对负极和电解质之间反应过程的影响。结果表明,反应倾向于优先发生在晶界处,因为晶界处的Li比晶面处的Li具有更高的能量(图1A)。
(2)为了抑制晶间反应,构建了铝(Al)基杂原子偏析晶界(Al-HCGB;图1B)来修饰锂金属负极。在Al-HCGB中,电子从锂转移到铝原子,阻碍了锂金属和电解质之间的晶间反应,减轻了活性锂和电解质的损失。
(3)与常规锂负极相比,Al-HCGB修饰的锂负极电池寿命是常规锂负极的两倍,组装的355 Wh kg-1软包电池循环113次后能够保持86%的初始容量。
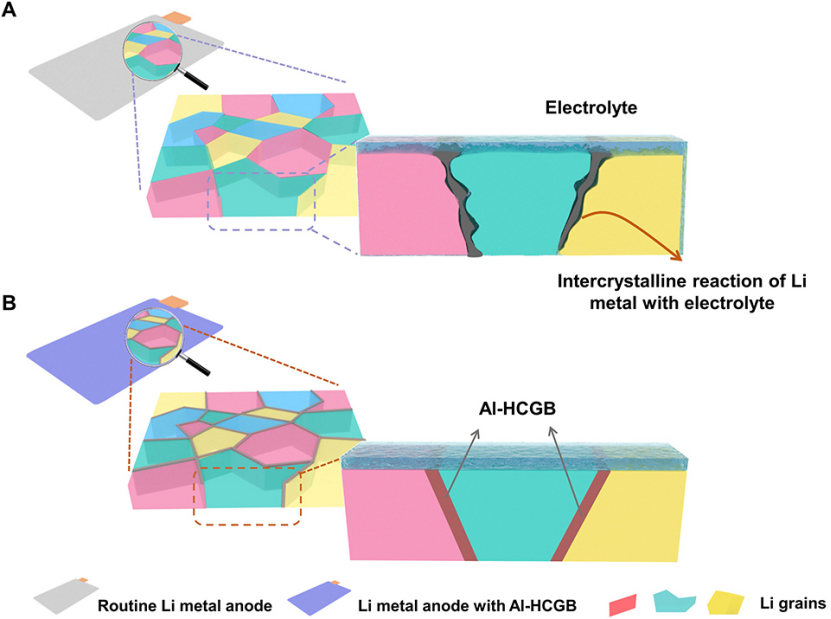
图 1、(A)常规锂金属和(B)Al-HCGB锂金属晶间反应过程示意图。
04
图文导读
为了定量描述Li原子在晶面和晶界上的反应活性,采用基于密度泛函理论(DFT)的第一性原理计算确定了位能(Esite)。Esite定义为Esite=Etotal-Evacancy,其中Etotal和Evacancy分别是原始无缺陷模型和包含Li空位的模型的总能量。因此,具有高Esite的Li原子表现出高反应性。Li(100)和Li(110)平面之间的平均Esite接近,表明Li在两个晶面上的反应性相似(图2,A和B)。
然而,在Li(100)和Li(110)平面之间的晶界处,Li原子的平均Esite显著高于晶面,表明晶界处的Li具有更高的反应性。因此,Li与电解质之间的反应倾向于从晶界开始,然后沿着晶界扩散,即晶间反应。
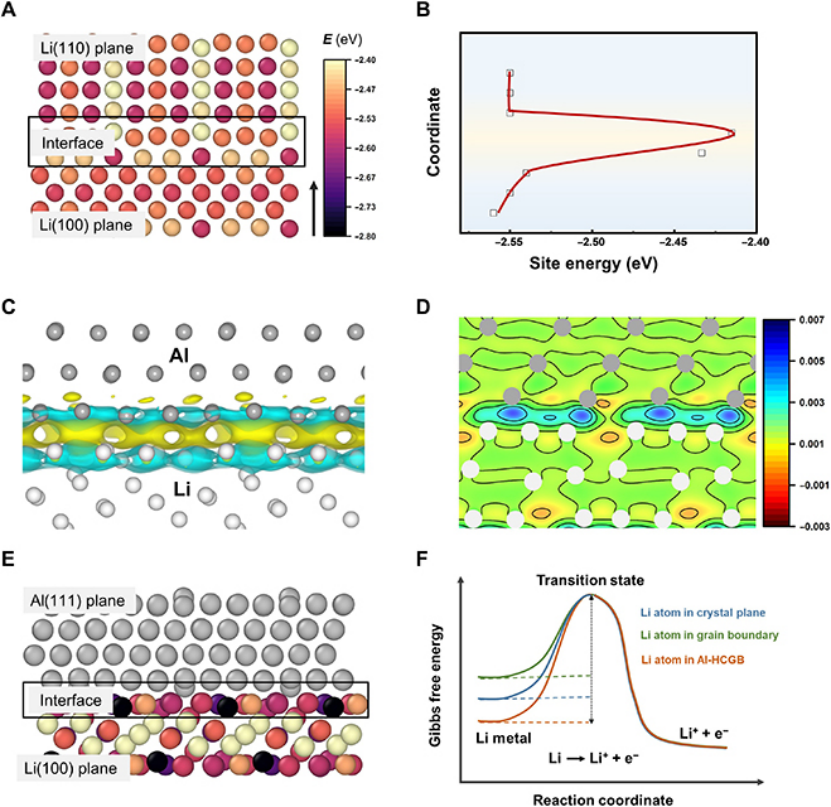
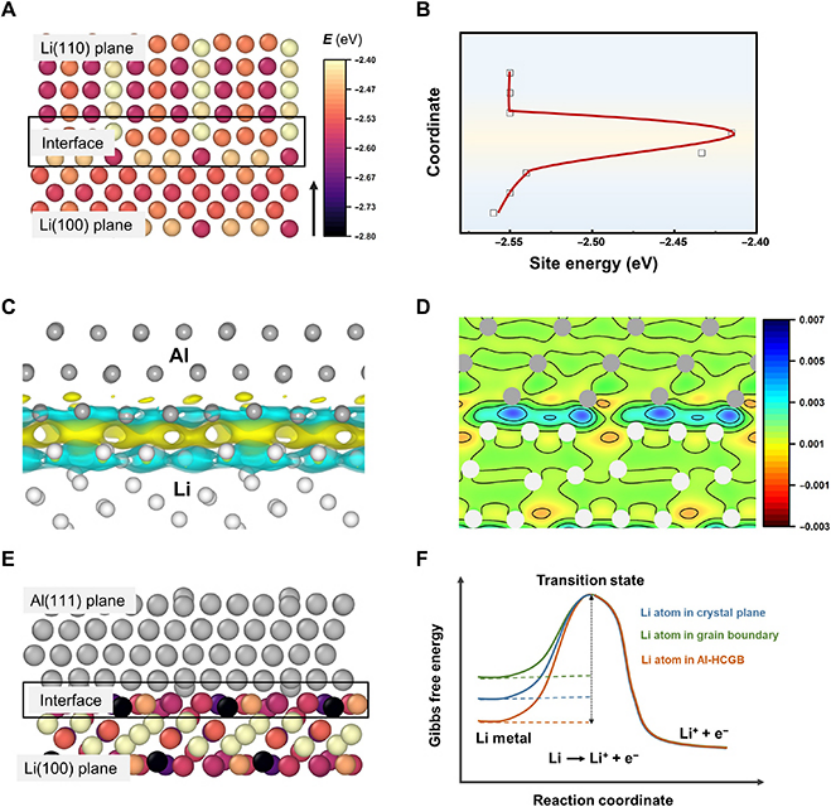
图2、(A)Li(110)、Li(100)及其界面中锂原子的位能(Esite)。(B)Esite沿(A)中箭头方向的演变。(C)Li和Al界面处的变形电荷密度分布。(D)(C)的相应二维(2D)截面。(E)Li(100)平面以及Li和Al金属之间的界面中,Li原子的位能。(F)反应Li-e-=Li+在晶面、晶界和Al-HCGB的吉布斯自由能变化示意图。
本工作提出采用杂原子偏析晶界(HCGB)来抑制锂箔和电解质的晶间反应。变形电荷密度分析证实(图2C和D),当Al原子等杂原子与Li原子接触时,由于Al原子的电负性强于Li原子,电子从Li转移到Al原子。电荷转移降低了锂原子周围的电子密度,进一步降低了锂的反应性。当将Al原子引入晶界时,晶界处Li原子的平均Esite从-2.41下降到-2.60 eV(图2E)。
因此,通过在晶界处引入杂原子能够降低锂原子在晶界处的反应性。随着Esite的减少,Li-e-=Li+反应的能垒增加(图2F)。因此,与常规晶界相比,Al-HCGB可以抑制金属锂与电解质的晶间反应,从而显著降低活性锂和电解质的消耗速率。
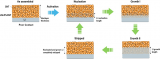
为了制备Al-HCGB修饰的锂金属负极(Al-HCGB-Li),首先将锂金属熔化,然后加入少量的铝金属(图3A)。Li和Al金属的质量比为95:5。
在晶粒中引入杂原子后,杂原子在退火过程中倾向于分布在畸变能降低的位置。因此,Al原子自发集中在晶界处,使整个系统的畸变能降到最低,称为晶界偏析(图3B)。在晶界处的Al原子浓度(C)与边界(Eboundary)与内部(Einterior)之间畸变能差的关系满足阿伦尼乌斯方程:
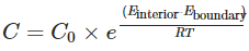
其中C0为晶粒内Al原子浓度,R为气体常数,T为温度。
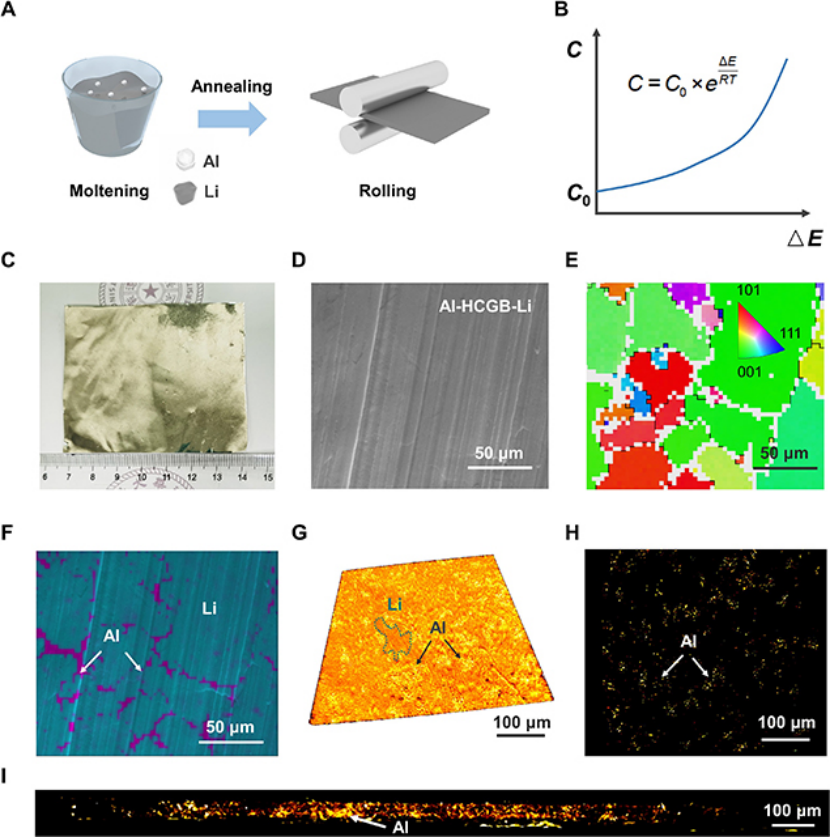
图 3、(A)Al-HCGB-Li制备过程。(B)晶界处Al原子浓度与畸变能的关系。(C)Al-HCGB-Li箔的光学图像。(D)Al-HCGB-Li的SEM图像。(E)Al-HCGB-Li的EBSD映射和反极图颜色分布。(F)Al-HCGB-Li中Al元素的EDS映射。(G)XRM显示在Al-HCGB-Li内的Al分布。(H)(G)的横向和(I)纵向剖视图。
将退火的Al-HCGB-Li擀成厚度为50 μm的Li箔用于表征和电池组装(图3C)。扫描电子显微镜-电子背散射衍射-能量色散光谱(SEM-EBSD-EDS)用于研究Al-HCGB-Li箔的形态和Al-HCGB-Li中Al原子的分布。Al-HCGB-Li箔的表面平整光滑(图3D)。图3E显示,Al-HCGB-Li由多个方向不同的晶粒组成,这些晶粒用不同的颜色表示。
同一区域Al元素的EDS映射表明,大多数Al原子集中在晶界(图3F)。此外,使用三维X射线显微镜(3D XRM)来探测Al-HCGB-Li内部的Al分布(图3G)。Li的颜色比Al深,因为Al具有更大的原子质量。Al的分布表明,其在Al-HCGB-Li内部呈偏析状态而不是均匀分布,表明Al原子在表面和内部都集中在晶界(图3H和I)。
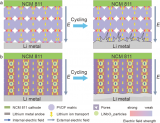
将Al-HCGB-Li和常规Li箔浸泡在腐蚀性电解质(1.0 M LiPF6inDMC)中,以评估Al-HCGB抑制锂与电解质晶间反应的效果。EBSD映射用于定量监测常规Li箔和Al-HCGB-Li的反应过程(图4A)。具有一定取向的部分(带有颜色的部分)为活性Li,而黑色部分代表不可识别的相,可以视为反应产物,如Li2O和Li2CO3。
常规Li箔和Al-HCGB-Li的晶界在原始状态下十分清晰。随后,晶间反应在晶界处发生,并沿着晶界扩展。24小时后,与Al-HCGB-Li相比,常规Li箔出现了更多不可识别的相。对于常规Li箔,可识别相的比例在反应24小时后从88%下降到50%(图4B)。然而,Al-HCGB-Li的可识别相仅从84%减少到69%。
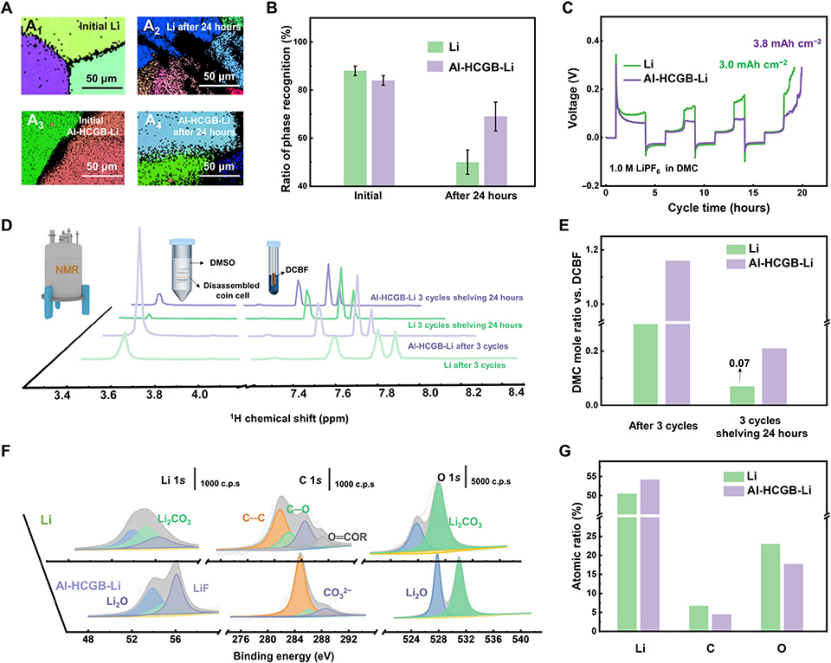
图4、(A)(A1和A2)常规Li和(A3和A4)Al-HCGB-Li箔在(A1和A3)初始状态和(A2和A4)浸泡电解液24小时后的EBSD图。(B)图(A)中可识别相的比例。(C)常规Li箔和Al-HCGB-Li循环3次后的Li剥离容量。(D)常规Li箔和Al-HCGB-Li金属电池循环3次,并放置24小时后,电解液的1H-NMR谱。(E)根据图(D)计算的DMC摩尔比。(F)常规Li箔和Al-HCGB-Li负极上SEI的XPS光谱。(G)常规Li箔和Al-HCGB-Li表面Li、C、O原子比。
采用常规Li箔(负极)|常规Li箔(正极)或常规Li箔(负极)|Al-HCGB-Li(正极)电池,探究了Al-HCGB-Li缓解晶间反应的效果,电极厚度为50 μm。首先从正极上剥离3.0 mAh cm−2的锂,然后在正极上镀2.0 mAh cm−2的锂,使更多的活性锂暴露在正极上,加快了活性锂的消耗速率。在连续不对称循环3圈后,3.8 mAh cm−2的活性Li保留在Al-HCGB-Li中,而常规Li箔箔只有3.0 mAh cm−2,表明Al-HCGB-Li中活性Li的消耗含量显著降低了11%(图4C)。
循环后,将上述电池拆开提取电解质,并使用1H液体核磁共振(1H-NMR)来确定溶剂的消耗量。1H-NMR中3.6 ppm的峰归属于DMC中的H,7.0 ppm之后的峰属于内标物质2,4-二氯三氟化苯(DCBF;图4D)。DCBF的含量是固定的,作为基准。图4E显示,使用Al-HCGB-Li负极的电池在3次循环后DMC和DCBF的摩尔比为1.16,高于使用常规Li箔负极的电池(0.34),表明Al-HCGB-Li中DMC溶剂的消耗量为常规Li箔中的三分之一。
通过X射线光电子能谱(XPS)进一步研究了常规Li箔和Al-HCGB-Li上的SEI成分(图4F和G)。常规Li箔和Al-HCGB-Li上的SEI具有相似的组分,例如LiF和Li2O。然而,常规Li箔上的SEI具有比Al-HCGB-Li更高的C和O原子比,表明Al-HCGB-Li上的溶剂分解在循环过程中得到了缓解,即DMC的消耗量减少。
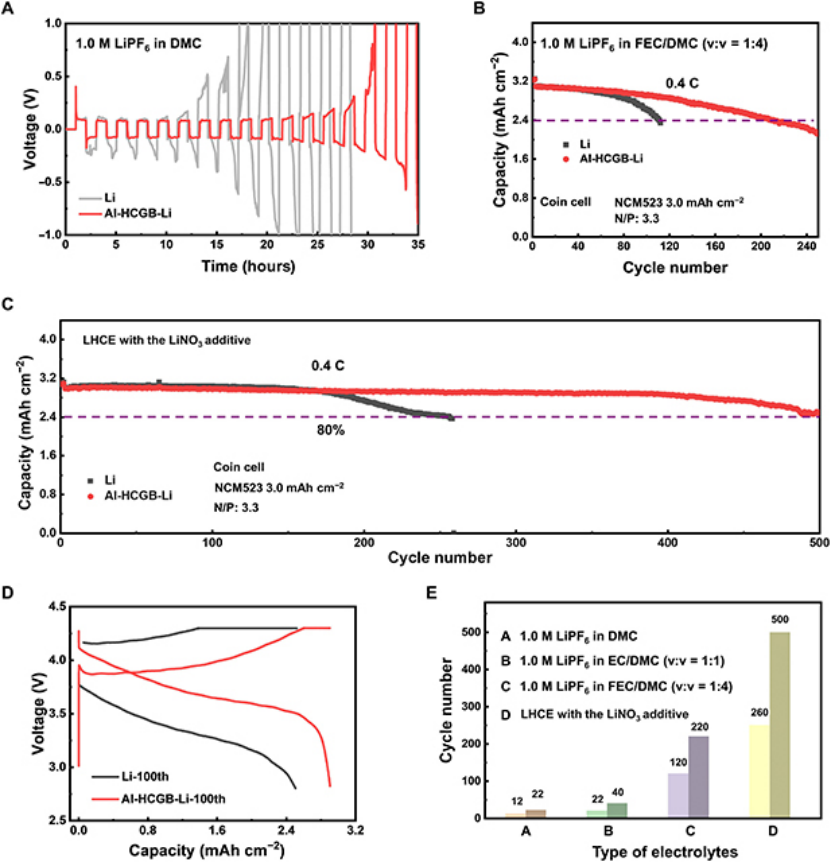
图5、(A)在1mA cm-2@1mAh cm-2下,常规Li和Al-HCGB-Li对称电池的循环性能。Li|NCM523电池在(B)1.0 M LiPF6in FEC/DMC和(C)添加了LiNO3的LHCEs中,0.4C下的循环性能。(D)含FEC电解质的扣式电池在第100个循环时的充放电曲线。(E)不同电解质体系扣式电池循环性能。
采用对称锂电池研究了Al-HCGB-Li和常规Li箔的稳定性。DMC对Li金属不稳定,因此选用DMC制备反应活性高的电解质(1.0 M LiPF6in DMC)。图5A显示,含有常规Li箔的电池在15 h内电压极化逐渐增加到500 mV,而含有Al-HCGB-Li的电池在25 h后电压极化保持在200 mV。另外,还在实际条件下用高载量LiNi0.5Co0.2Mn0.3O2(NCM523, 3.0 mAh cm-2)正极和Al-HCGB-Li或常规Li箔组装成了全电池,N/P比为3.3。图5B显示,在1.0 M LiPF6inFEC/DMC电解液中,采用Al-HCGB-Li的电池可循环220次,与常规Li(120次循环)相比,其寿命要长得多。
此外,在添加了LiNO3的局域高浓电解质(LHCE)中,Al-HCGB-Li|NCM523电池在0.4 C下能够循环500次,容量保持率为80%,几乎是常规Li箔(260次循环)的两倍(图5C)。含FEC电解质的Al-HCGB-Li电池循环100次后,中值电压为3.59 V,大于常规Li箔电池的3.28 V(图5D)。图5E总结了在不同电解质体系中Al-HCGB-Li的稳定性,结果表明,在各种电解质中Al-HCGB-Li的晶间反应均受到显著抑制。
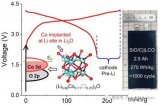
为了进一步证明Al-HCGB-Li的循环稳定性,组装了软包全电池,NCM523正极载量高达4.0 mAh cm−2、电解质含量为2.3 g Ah−1,N/P比为2.5,选择1.0 M LiPF6in FEC/DMC作为电解质。软包电池在第一次循环时的放电容量为3.84 Ah,能量密度高达355 Wh kg-1(图6A)。在113次循环后,它可以保持86%的初始容量(图6B)。
处于剥离状态的常规Li箔在100次循环后被大量死锂覆盖,部分粉碎的死锂从铜集流体上脱落(图6C)。相比之下,Al-HCGB-Li的形貌相对平坦且致密,从Al-HCGB-Li表面可以观察到活性Li,表明Al-HCGB-Li仍然可以参与后续循环。同时,由于死锂的积累减少,中值电压从第3圈到第100圈仅变化30 mV(图6D)。
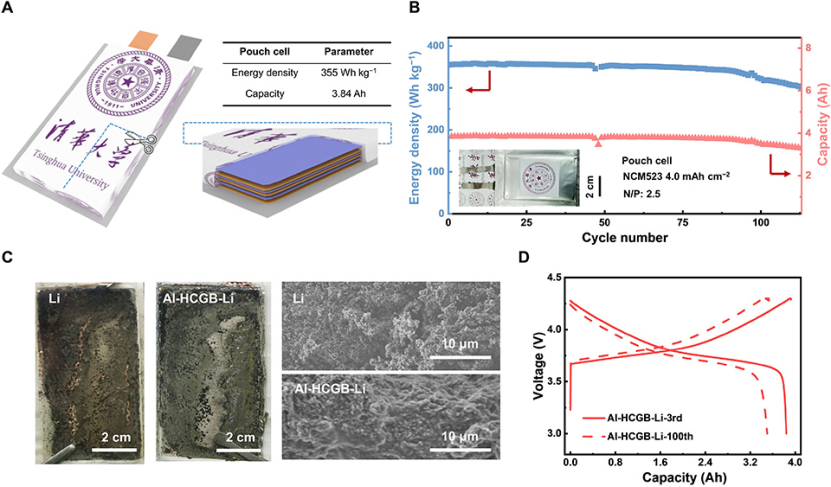
图 6、(A)355 Wh kg-1软包电池示意图。(B)具有Al-HCGB-Li的3.84-Ah软包电池循环性能。(C)100次循环后,软包电池中常规Li和Al-HCGB-Li在剥离状态下的照片和SEM图像。(D)具有Al-HCGB-Li负极的软包电池在第3次和第100次循环时的充放电曲线。
05
总结与展望
本工作揭示了锂金属负极晶界对电解质和锂金属之间反应的影响。从微观角度看,反应优先发生在晶界,即晶间反应。因此,本工作使用Al-HCGB来抑制晶间反应,其中Al集中在锂金属表面的晶界处。电子从Li转移到Al-HCGB中的Al原子,增加了晶界反应的能垒。因此,由于减轻了晶间反应,电解质和锂金属的消耗速率显著降低。与常规Li相比,具有Al-HCGB-Li的锂金属电池寿命是常规Li的两倍。355 Wh kg-1的软包电池循环113圈后,其容量下降到初始容量的86%。这项工作揭示了表面微观结构对负极/电解质界面反应的影响,并提出了一种有效策略来抑制晶间反应。
审核编辑:刘清
-
锂电池
+关注
关注
259文章
7988浏览量
169058 -
电解质
+关注
关注
6文章
802浏览量
19992 -
EDS
+关注
关注
0文章
93浏览量
11507 -
软包电池
+关注
关注
1文章
175浏览量
7945
原文标题:清华张强Science子刊:杂原子偏析晶界抑制锂负极晶间反应
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
电解电容正负极判断 电解电容的作用是什么
电解电容怎么区分正负极的呢
无极电容器有电解质吗,无极电容器电解质怎么测
电解电容的正负极怎么区分
不同类型的电池的电解质都是什么?
固态电池竞争趋向白热化 半固态电池量产先行





 锂金属负极晶界对负极和电解质之间反应的影响
锂金属负极晶界对负极和电解质之间反应的影响












评论