石墨烯量子点(GQDs)由于其独特的物理结构,使其在抗菌领域得到广泛的关注。以石墨粉为原料,采用震荡冲击法制备GQDs,探究在808nm激光的照射下,GQDs对大肠杆菌的抑制效果。结果表明:1.0mg·mL-1的GQDs在光照20min的情况下,可将大肠杆菌完全杀灭,而将光照时间提高至25min时,0.6mg·mL-1的GQDs即可将大肠杆菌完全杀灭。若提高GQDs质量浓度或光照时间,GQDs可短时、高效地杀灭抑菌。GQDs在抑菌过程中,不仅能产生活性氧,其自身结构也能对大肠杆菌的细胞膜造成破坏,在抗菌方面具有广阔的发展前景。
自然界中的有害微生物严重威胁人类的生命健康。细菌对人类的危害促使着我们在现有抗菌剂的基础上开发出新兴的、复合型的高效抗菌剂势在必行。而自从石墨烯的抗菌作用被报道以来,石墨烯类材料因其特殊的物理化学结构而得到了广大学者的关注。石墨烯量子点作为石墨烯的衍生物,具有比石墨烯更大的比表面积,而这种优异的结构特性对细菌有较好的吸附作用,有利于对细菌的捕获,从而抑制细菌的生长,GQDs与微生物独特的作用方式使其在抗菌方面的应用具有广阔的发展前景。
石墨烯的抗菌能力不仅与表面基团以及掺杂质存在着直接联系,还对尺寸具有一定的依赖性,不同的方法制备出的不同尺寸的GQDs的吸收峰、荧光颜色等都不同,其抗菌能力也存在着明显差异。
传统的石墨烯量子点的制备过程复杂,难以量产,且只有在紫外光下对光有明显的吸收,而在可见光下几乎无响应。本文采用简单高效且创新方法———震荡冲击法来制备石墨烯量子点,并对其光学特性、光热效应、光动力效应及抑菌性能进行研究,从而进一步推进GQDs在杀菌领域的研究。
实验材料与方法
1、实验材料
大肠杆菌购自上海保藏生物技术中心;
无水乙醇、无菌生理盐水、盐酸、氢氧化钠、PBS、2.5%戊二醛等试剂购自沃瑞达斯有限公司。
2、GQDs的合成
采用震荡冲击法制备石墨烯量子点:将石墨粉和惰性气体通过加料管进入第一震荡冲击机腔体内,经过腔体和冲击介子的高效运动,得到石墨烯量子点半成品;后将半成品和惰性气体经加料管加入第二震荡冲击机腔体内继续震荡冲击,可获得合格的球形纳米石墨烯量子点。
3、激光诱导GQDs的光热转换
称量一定量的GQDs粉末于蒸馏水中超声,制成质量浓度为0.6mg·mL-1的水溶液,取200μL置于透明的玻璃管中,密封管口,以低功率密度(2 W·cm-2)的808nm的红外激光束垂直照射玻璃管中的样品,实时监测并记录样品的温度,以相同体积的蒸馏水作为对照组,每组实验重复3次。
4、菌液和培养基的制备
取1.00g胰蛋白胨,0.50g氯化钠和酵母提取物,溶于100.0mL去离子水中,121℃灭菌30 min,冷却至室温,得到琼脂液体培养基。而琼脂固体培养基需在上述配方中加入3.00g琼脂,高压灭菌后倒入已灭菌的培养皿内,待琼脂凝固,于4℃下保存备用。取少许大肠杆菌菌液于35 mL的琼脂液体培养基中,在37℃,220 r·min-1的摇床上培养过夜后,取10 mL菌液离心,将菌液的吸光度A调整至0.5,即可得到菌体浓度CE为5×108 cfu·mL-1的大肠杆菌菌液。
5、大肠杆菌生长曲线的绘制
于6个新灭菌的培养瓶内,各加入60mL的琼脂液体培养基、紫外照射20,min处理后的200μL
大肠杆菌溶液和GQDs,调整GQDs浓度,于37℃,220r·min-1震荡培养。每隔1h记录溶液600 nm下的吸光度A600,直至菌液的吸收值不再明显增长为止,每组实验重复3次。
6、GQDs的抑菌性能研究
取0.2mL的大肠杆菌溶液于6个2mL的玻璃管中,加入GQDs,调整其浓度。用近红外激光在管壁正上方5 cm处照射20min,未加入GQDs的菌液作为实验对照。再取0.2mL的大肠杆菌溶液于6个2mL玻璃管中,加入GQDs,调整其质量浓度0.6mg·mL-1,用近红外激光在管壁正上方5cm处照射一定时间后,将菌液稀释104倍,取100μL滴在琼脂固体培养基上,用涂布器将菌液均匀地涂布在平板上,于37℃恒温培养箱中培养24 h后计数,大
肠杆菌的存活率按以下公式计算:
Rs=nexp ncon×100%
式中:Rs为细菌存活率,%;nexp为实验组菌落个数;ncon为对照组菌落个数。
每组数据重复3次后取其平均值,计算误差。
实验结果与讨论
1、GQDs的材料表征
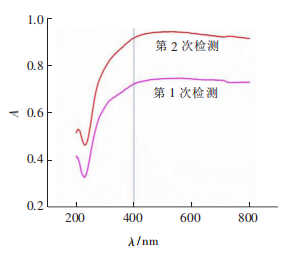
对石墨烯量子点材料进行了表征。图为石墨烯量子点的紫外-可见光光谱表征图,可知,在200~230nm的紫外光阶段,吸光度有略微的下降,而后在230~400nm之间呈上升趋势,至400 nm后几乎保持不变。可见此石墨烯量子点不仅在紫外阶段对光有明显的吸收,在可见光阶段也表现出良好的光学吸收特性。
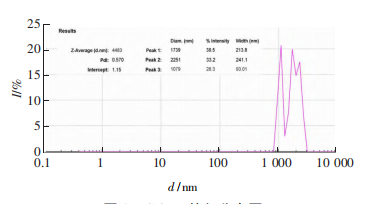
由GQDs的粒径分布图可知,此GQDs平均粒径为4483nm,但粒径分布稍有不均。
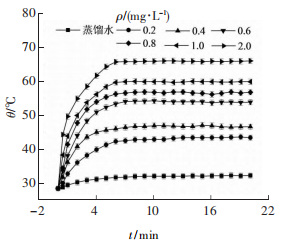
2、GQDs的光热升温曲线
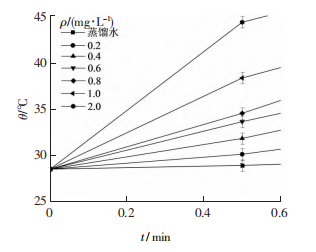
在低功率密度(2 W·cm-2)的808 nm的激光照射下,GQDs水溶液可以产生大量的热。从图中可以看出,GQDs水溶液在光照20min后,其温度随着GQDs质量浓度的增大而增大,当GQDs的质量浓度从0.2mg·mL-1升高至2.0mg·mL-1时,GQDs水溶液在激光照射30s时,温度从28.5℃升高至30.1,31.8,33.6,34.5,38.3,44.3℃,随着激光照射时间的增加,温度逐渐升高,在照射6 min后,温度基本达到最大值,溶液温度升高了约15~37.7℃。GQDs的质量浓度从0提高至1.0mg·mL-1,温度升高了(23.2±0.5)℃,而从1.0mg·mL-1提高至2.0mg·mL-1时,温度仅提升了(6.1±0.5)℃,而对照组蒸馏水在激光照射20min后,温度仅上升到32.2℃,升温幅度仅为3.7℃左右。实验结果表明,GQDs具有较好的光热转换能力,且热效应会随着浓度的增大而进一步增强,但增长趋势变缓。
3、GQDs对大肠杆菌生长的影响
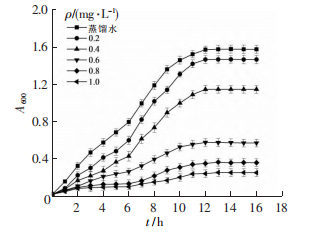
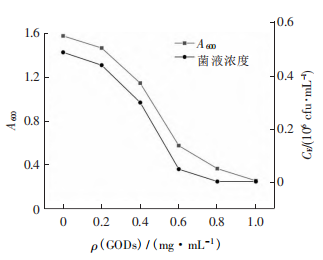
细菌培养液在600nm处的光密度(A600)反映了培养液中细菌浓度的高低。本实验将一定量的GQDs和大肠杆菌菌液在激光照射后加入琼脂液体培养基中,每隔1h,测量菌液在600nm处的吸光度A600,绘制出不同GQDs质量浓度下大肠杆菌的生长曲线。
如下图所示,菌液的初始吸光度相同,随着培养时间的增加,大肠杆菌在培养基中不断地生长、繁殖,溶液的吸光度不断增大。当GQDs的质量浓度为0.2mg·mL-1时,大肠杆菌的生长曲线略低于对照组,即GQDs对大肠杆菌的抑制效果很不理想,但随着GQDs质量浓度的增加,溶液的吸光度减小,抑菌效果逐渐增强。由图可知,当GQDs的质量浓度达到1.0mg·mL-1时,大肠杆菌的生长曲线几乎与横轴平行,说明溶液中菌液含量极低,大肠杆菌的生长几乎被完全抑制。实验结果表明,GQDs能够抑制大肠杆菌的生长,且抑制作用随着GQDs质量浓度的增大而逐渐增强,当GQDs的质量浓度为1.0mg·mL-1时,大肠杆菌的生长几乎被完全抑制。
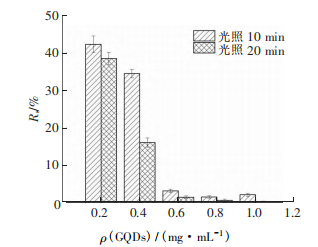
4、GQDs对大肠杆菌的抑制作用
将大肠杆菌菌液稀释104倍,涂布于琼脂固体培养基上,在最适宜的条件下培养24h,计数平板内的菌落并计算大肠杆菌的存活率。由图可知,在低功率密度(2W·cm-2)808nm的激光照射下,大肠杆菌的存活率Rs随着GQDs质量浓度ρ(GODs)的增加而逐渐降低。当GQDs的质量浓度为0.6mg·mL-1时,大肠杆菌的存活率就低于10%,说明此质量浓度下的GQDs对大肠杆菌的抑制作用较为明显,绝大多数的大肠杆菌已经死亡。但1.0mg·mL-1的GQDs在激光照射10 min的情况下,仍有极少数的大肠杆菌存活,而照射时间增加至20min,大肠杆菌的生存率达到0。另外,GQDs在光照20min时大肠杆菌的存活率均低于照射10min时的大肠杆菌的存活率。上述实验结果表明,激光照射时间也是影响GQDs抑菌作用的重要因素之一。
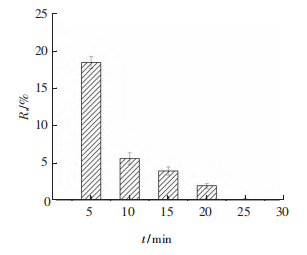
下图是GQDs质量浓度为0.6mg·mL-1时,不同激光照射时间对抑菌作用的影响。由图可知,激光照射5min后,大肠杆菌的存活率只有18.36%,随着光照时间的增加,大肠杆菌存活率逐渐降低,光照时间达到10min时,大肠杆菌的存活率低于10%,而在照射25min后,大肠杆菌被完全杀灭。由上述实验可知,光照时间和GQDs质量浓度对大肠杆菌的抑制作用均有重要影响。如果提高GQDs质量浓度,杀灭细菌的时间将会进一步缩短,由此可见,在激光照射下,GQDs可以短时、高效地杀灭细菌。
5、GQDs抑菌机制分析
(1)光热效应和光动力效应
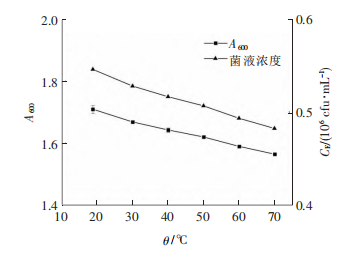
GQDs能将吸收的光能转换成热能,为验证GQDs光热效应对抑菌作用的影响,将大肠杆菌在不同的温度下单独作用20min,于37℃下恒温培养16h后,测量大肠杆菌在600nm的吸光度,如图所示,吸光度的数值随着温度的升高而降低,当温度从室温升高至70℃时,吸光度从1.709降低至1.564,即大肠杆菌菌液浓度CE从0.546×106cfu·mL-1降低至0.482×106cfu·mL-1,由此可说明,大肠杆菌活性在此温度范围内受光热效应的影响。但仅在光热效应的作用下,大肠杆菌的浓度降低较小,难以达到安全杀菌的目的。但GQDs在激光的照射下,光热效应总伴随光动力效应同时产生,由上图可知,GQDs在光热效应和光动力效应的共同作用下可以达到安全杀菌的效果。
而在有光激发的情况下,碳点中的光能引发电荷转移,在光动力效应下会产生活性氧物种,从而对细菌结构造成破坏或导致细菌死亡。下图为GQDs对大肠杆菌活性的影响,可知,大肠杆菌菌液浓度随着GQDs质量浓度的增大而减小,当GQDs质量浓度达到0.8mg·mL-1,大肠杆菌菌液浓度为0。由此可说明,GQDs在光动力效应下可以杀灭细菌。
为了验证GQDs抑菌过程中的氧化还原机制,采用活性氧荧光标记物二氯荧光黄二乙酸酯(DCFH-DA)对实验中产生的自由基和活性氧进行标记。无荧光的DCFH遇到细胞内产生的活性氧如·OH时,将被氧化成DCF而发出绿色的荧光。
由图可知,经过GQDs处理过的菌液发出了绿色的荧光,而没有经过GQDs处理过的菌液表现出来的荧光较为微弱。实验结果表明,GQDs在抑菌过程中产生了ROS,可与细菌胞内物质,如脂质、蛋白质、核酸等产生氧化作用,破坏细菌的细胞结构,最终导致细菌的死亡。也进一步说明了ROS在GQDs的抑菌作用中扮演着十分重要的角色。

综上所述,GQDs对大肠杆菌的抑菌作用是由光热效应和光动力效应共同作用的。
(2)GQDs对大肠杆菌细胞膜的作用
为研究GQDs自身结构对大肠杆菌的破坏作用,对石墨烯量子点进行扫描电镜分析,如图所示,石墨烯量子点边缘锋利,细菌细胞与石墨烯类材料接触后,细菌细胞被纳米片层包裹,其锋利的外表对大肠杆菌的外表造成破坏而发生不可逆的损伤。

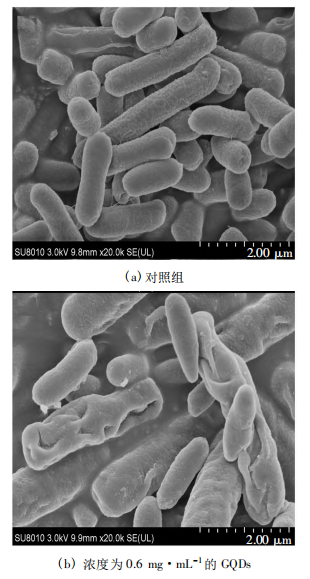
为研究GQDs对大肠杆菌细胞膜的破坏作用,将其与0.6mg·mL-1的GQDs共同培养12h后,经过固定脱水等处理后用扫描式电子显微镜观察大肠杆菌形貌,通过对照组和实验组的大肠杆菌形貌上变化,分析GQDs与大肠杆菌的相互作用过程,探究GQDs对大肠杆菌的抑菌机制,结果如图所示。
由图(a)可知,正常情况下,大肠杆菌呈现出规则的短棒状结构、表面光滑,且细胞膜结构完整。相比之下,大肠杆菌与GQDs接触后,如图(b)所示,大肠杆菌则出现变形、凹陷、细胞膜破裂等情况,表面也变得粗糙。而这些形态的变化是由于大肠杆菌与GQDs的接触过程中,GQDs锋利的外表导致大肠杆菌细胞结构的完整性被其破坏,GQDs的光热效应和光动力效应产生的ROS,破坏了大肠杆菌的新陈代谢,胞内的物质,比如离子,蛋白质和遗传物质等发生了泄露,而导致大肠杆菌的形态发生异常,从而达到了抑制大肠杆菌生长的效果。
结论
(1)采用震荡冲击法制备GQDs,可有效解决GQDs量产困难的缺点,提高GQDs的制备效率,降
低制作成本。
(2)在808 nm激光照射下,探究GQDs抑菌特性,结果表明:GQDs能有效地抑制大肠杆菌的生长,光照时间和GQDs质量浓度对GQDs抑菌作用都有影响。光照时间一定,大肠杆菌的生存率随着GQDs质量浓度的增大而减小,而当GQDs质量浓度不变时,大肠杆菌的存活率随光照时长的增加而降低。若增大GQDs质量浓度或光照时长,可有效提高GQDs的杀菌效率。
(3)扫描电镜和荧光检测分析结果表明:GQDs的抑菌效果是由GQDs的光热效应、光动力效应以及GQDs自身结构的共同作用。GQDs在光热效应和光动力效应下产生的ROS与大肠杆菌胞内物质产生氧化作用,对细胞膜造成破坏,同时,GQDs锋利的边缘结构破坏细菌细胞结构的完整性,从而抑制细菌的生长。
(4)而石墨烯量子点在抑菌过程中,主要依靠ROS对细菌细胞膜的破坏起到杀灭细菌的作用,因此,·OH的产生过程、检测方法、影响因素,以及光热效应的增强情况等是我们进一步探索的方向和研究内容。
审核编辑 :李倩
-
石墨烯
+关注
关注
54文章
1552浏览量
79709 -
量子点
+关注
关注
7文章
244浏览量
25911
原文标题:石墨烯量子点的抑菌特性
文章出处:【微信号:深圳市赛姆烯金科技有限公司,微信公众号:深圳市赛姆烯金科技有限公司】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐




 简单高效且创新方法———震荡冲击法来制备石墨烯量子点
简单高效且创新方法———震荡冲击法来制备石墨烯量子点














评论