干细胞样肿瘤细胞的Midkine表达驱动mTOR
抑制和免疫抑制微环境的持续
(一)
摘要
mTORC1在多种癌症类型中异常活跃。此研究对结节性硬化综合症(TSC)与mTORC1极度活跃相关的肿瘤进行了单细胞转录组分析、配对T细胞受体(TCR)测序和空间转录组分析,并通过肿瘤调节的免疫抑制性巨噬细胞确定了一种与T细胞功能障碍有关的干细胞样肿瘤细胞状态(SLS)。雷帕霉素及其衍生物(rapalogs)是治疗TSC肿瘤的主要药物,干细胞样肿瘤细胞在体外表现出雷帕霉素耐药,这让研究者联想到这些药物对患者细胞的抑制作用。促血管生成因子midkine (MDK)在SLS群体中高度表达,并在SLS优势样本中与内皮细胞的富集相关。MDK抑制与雷帕霉素在体内外协同抑制TSC细胞系的生长。综上所述,本研究提示mTORC1高活性的干细胞样状态肿瘤细胞通过免疫抑制,存在一种自分泌雷帕霉素耐药机制和旁分泌肿瘤生存机制。
研究内容
AML 和 LAM的单细胞分析
研究者对肿瘤切除时获得的6个肾性AML肿瘤和4个正常组织进行scRNA-Seq和scTCR-Seq(图1a)。在肺移植时获得的5个LAM组织也进行了scRNA-Seq。过滤掉低质量的细胞后,共分析了来自AML的108,071个细胞和来自匹配的正常肾脏的33,136个细胞;分析了LAM肺部样本的42,202个细胞。AML组织和正常组织的免疫和基质区的主要细胞类型见图1b, c。正常肾脏含有49%的上皮细胞,而AML中只有1.1%的上皮细胞(图1d)。与正常组织相比,许多免疫类细胞在肿瘤组织中被富集,包括巨噬细胞(18.3% vs 2.7%)、树突状细胞(4% vs 0.7%)和T细胞(32.6% vs 14.1%)。在LAM组织中发现的主要细胞类型包括免疫细胞(T细胞、NK细胞、B细胞、巨噬细胞和单核细胞)、间质细胞、上皮细胞和内皮细胞(淋巴细胞和血液)(图1e)。
AML细胞中的通路和遗传调控网络的图谱
对间质细胞群的重新聚类显示了来自正常肾组织和AML肿瘤组织的独立细胞群(图1f)。除了AML细胞(如上所述),该集群还包含肿瘤相关的成纤维细胞(TAF)。通过Seurat的差异基因表达分析发现,与TAF和正常肾脏相比,160个基因在肿瘤细胞中唯一上调,包括以前报道的基因(如GPNMB、SQSTM1/p62、MMP2、PTGDS)和参与肿瘤转移的基因(如MMP11、MDK、DCN、PDPN)(图1g,补充图3b,补充数据1)。与匹配的正常间质细胞相比,两个长的非编码RNAs(lncRNAs)(MALAT1,NEAT1)在肿瘤细胞和肿瘤相关的成纤维细胞中都被上调(图1g和补充图3c),表明AML细胞重塑了成纤维细胞。为了确定AML细胞与TAF和正常肾脏的不同调节途径,研究者使用了基因集变异分析(GSVA)。标志性的基因集分析(包含50个基因集)确定了参与胆固醇平衡的基因是AML细胞中上调最多的途径,而第二大上调途径是mTORC1信号传导,这是在AMLs和LAM中TSC2损失的一个众所周知的生化效应(图1h)。研究者使用SCENIC分析发现:在AML细胞中更多的调控因子被上调。该分析还确定了与AML相关的转录因子和调节子,包括参与表观遗传调控的几个因子,如HDAC2、SIRT6、FOXN3、MEF2A(图1i,补充图3d。补充资料2、3)。所关注的具体基因包括MDK(在此新发现的在AML中高表达的基因)和GPNMB(AML的一个已知标记)。研究者使用RNA原位杂交,在AML肿瘤中检测到MDK的表达,但在邻近的正常肾脏中没有检测到(图1j)。MDK是一种肝素结合的生长因子,能促进细胞生长和血管生成。
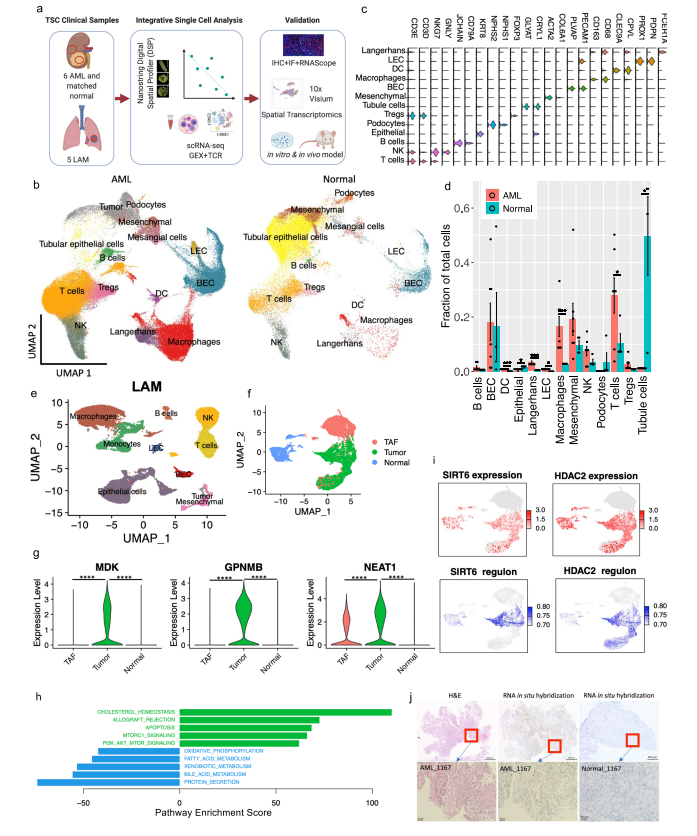
图1. 血管肌瘤(AML)和淋巴管瘤病(LAM)的单细胞图谱
AML肿瘤细胞表现为两种主要状态:干细胞样和炎性
对6596个AML细胞进行重新聚类显示了四个细胞群(图2a,b)。Custer 1显示中胚层特异性转录因子21(TCF21)的相对高表达,这是平滑肌细胞表型调节的主调控因子(图2b,补充图4b)。他们注意到几个基因(SOX4,TCF4)(图2b,补充图4c),已知是干细胞标志物。研究者计算 "干性评分"并发现:群组1显示出最高的干性分数(图2c),并显示出炎症基因的高表达(图2b,补充图4e)。基于这些特征,他们将聚类1定义为干细胞样状态(SLS),聚类2定义为炎症状态(IS)。嘌呤相关的代谢与mTORC1途径有关,高水平的嘌呤核苷酸是维持癌症干性所必需的,而外部补充次黄嘌呤则会促进肿瘤干性。研究者从单细胞转录组中产生了伪Bulk RNA-seq数据,并发现与正常对照组相比,两种肿瘤细胞状态下嘌呤途径中鸟嘌呤/鸟苷的代谢都升高了(图2d)。
人们越来越认识到,缺氧的微环境以及转移过程中诱发的压力会引发休眠状态,使肿瘤细胞对药物治疗和压力产生抗性。研究者进一步分析一组休眠标记基因,发现在SLS群体中高表达(群集1),包括转录因子NR2F1(图2e)。NR2F1通过整合静止和生存的表观遗传程序,成为诱导和维持肿瘤干细胞休眠的一个关键节点。Regulon分析证实,NR2F1 regulon活性在SLS(群集1)中被上调(图2f)。并且雌二醇处理增加了NR2F1的表达和regulon活性(图2g)。研究者通过对SLS和IS的marker(MDK和TAGLN,图2i)以及Cathepsin K(AML/LAMmarker基因)进行共染色,在肿瘤样本中鉴定到了SLS和IS群体。量化显示MDK和TAGLN几乎没有共定位,而MDK与CTSK或TAGLN与CTSK广泛共染(图2j),支持存在两个不同的AML细胞群,MDK+和TAGLN+。
LAM中出现的细胞群与AML中观察到的两种类型相似
遗传学研究显示,AML和LAM的细胞来自一个共同的前体细胞。为了确定在AML中发现的两种细胞状态是否存在于肺部LAM中,研究者使用与AML相同的标记基因组和方法分析了五个LAM肺部的57186个细胞,共鉴定了375个LAM细胞(图1e)并聚类成了4个细胞群(图2k)。与AML相似,一个集群表达SLS/调节性平滑肌标志基因(集群2),另一个集群表达IS/收缩性平滑肌标志基因(集群1)(图2l)。还确定了一个表达所有这些基因的中间状态(簇0)。SLS群体和中间状态显示出较高的干性评分(图2m)。此外,与SLS AML细胞一样,LAM细胞的SLS群也有NF2F1表达和调节子活性的上调(图2n)。在LAM细胞中,VEGFD(一种有效的LAM生物标志物)的表达远远低于MDK(一种有效的血管生成和淋巴管生成的生长因子)(图2o),表明MDK在LAM相关的淋巴管生成中的潜在作用。
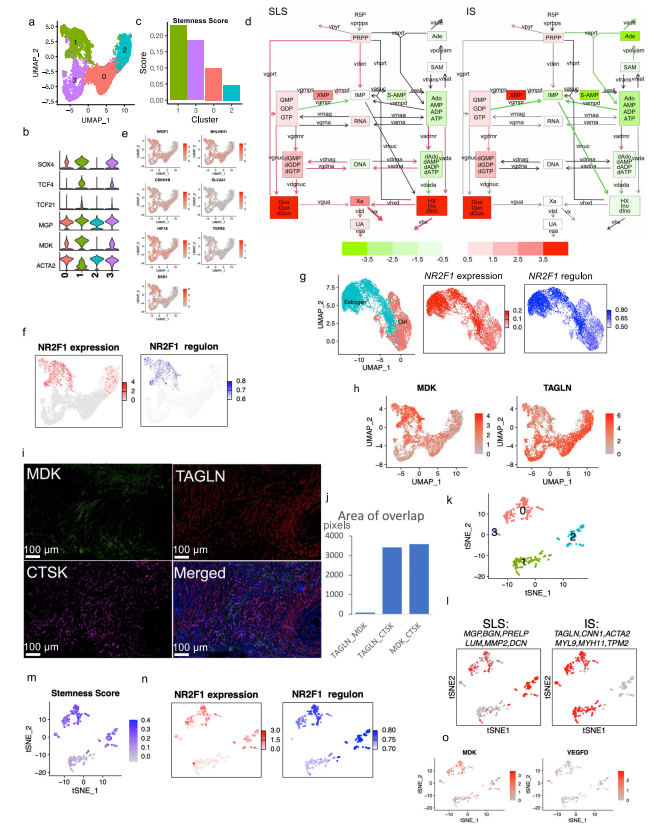
图2. AML和LAM细胞状态的异质性
未完待续
那么AML细胞的干细胞样细胞群与雷帕霉素耐药相关性、异质性肿瘤细胞状态对内皮细胞的重塑以及scRNA-Seq和scTCR-Seq的综合分析如何揭示了SLS优势肿瘤的T细胞功能障碍和抑制的克隆扩展请见下回详解。
SBC 单细胞测序平台
单细胞转录组测序(Single-cell RNA-sequencing)是指在单细胞水平上对RNA进行高通量测序和分析的新技术。公司(中心)建立的单细胞测序的主流平台——10x Genomics Chromium,可提供大规模、灵活、全面的单细胞测序服务,包括单细胞转录组、单细胞免疫组库、单细胞ATAC-seq、单细胞ATAC+转录组测序等。经过多年的积累,现已形成从样本保存、运输、单细胞悬液制备,到单细胞分选、建库和数据分析的一站式解决方案。目前已为来源于人、小鼠、大鼠、斑马鱼等多种物种的临床和科研样本提供了单细胞测序和数据分析服务。
SBC 空间转录组测序平台
空间转录组学技术能够测定组织样本中(冰冻和石蜡样本)的所有基因表达图谱,并定位具体发生的位置信息。公司(中心)建立的10x Genomics Visium空间转录组测序平台,无需进行目标预设就可以在空间上实现组织中基因表达的可视化。通过数据分析和数据可视化,将基因表达数据映射到图像上,实现对同一样品基因表达和细胞组成空间结构的表征,以从组织切片中获得生物学的全貌。
-
数据
+关注
关注
8文章
7048浏览量
89068 -
AML
+关注
关注
0文章
8浏览量
7373 -
SLS
+关注
关注
0文章
15浏览量
8923
原文标题:学术动态 | 干细胞样肿瘤细胞的Midkine表达驱动mTOR抑制和免疫抑制微环境的持续 (一)
文章出处:【微信号:SBCNECB,微信公众号:上海生物芯片】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐




 mTORC1高活性的干细胞样状态肿瘤细胞类型分析
mTORC1高活性的干细胞样状态肿瘤细胞类型分析











评论