摘要 本文采用毛细管对流 PCR 平台将毛细管安装在温度为 95°C 的加热器上,通过自然对流实现 PCR 循环。
毛细管底部(高温区域) 样品通过浮力驱动上升,同时使模板变性。样品上升过程中,因周围空气的冷却使其温度下降。
当样品到达毛细管顶部(低温区域)时,开始进行退火和延伸,随后 DNA 模板下沉并再次加热。
引物和扩增子设计对 DNA 扩增成功与否至关重要。
术语 CCPCR :Capillary Convective PCR
简介
由温度梯度内的流体密度变化引起的自然对流可用于 DNA 扩增。当样品在自然对流作用下在不同温度区域重复循环时,样品可能会在一次循环中经历 PCR 扩增的三个步骤----核酸变性,退火和延伸。
对流 PCR 可以将扩增时间从数小时缩短至 30-40 分钟。但是,当前的对流 PCR 系统使用两个或多个独立的温度控制器和复杂的系统设计,需要特定形状的管道或额外的腔室才能使流体完全循环。
此外,某些操作需要特定的技巧,如从细管中装载和卸载试剂以及密封管的两端而不将气泡困在里面。每一步操作对成功扩增都至关重要。
此外,因没有研究对比传统 PCR 和对流 PCR 在引物和扩增子设计上的差异,从而限制了对流 PCR 的广泛应用。
毛细管对流 PCR 平台
如图 1 所示,毛细管对流 PCR 采用带有温度反馈控制功能的热浴锅作为热源。样品容器为一种具有封闭式底部的商业玻璃毛细管 (100 ul),长 51 mm,其内径和外径分别为 2.3 mm 和 3.2 mm。
将两个具有不同钻孔深度(4 mm 和 30 mm)的加热块放入温度维持于 95°C 的热浴锅中。(有意思,也就是它的热源是 水 呗)
首先将装有样品的玻璃毛细管放入 30 mm 深的加热块上。在 10 min 内通过热传导将整个试管完全加热以激活 Taq DNA 聚合酶。
之后,将管子转移到 4 mm 深的加热块上,并采用塑料毛细管支架支撑。仅在底部加热试管 30 min,便可进行 DNA 扩增。

图 1 两个加热块放置在 95° 的热浴锅中
样品上部覆有10μL 矿物油。2ul 的 CPCR 产物采用 琼脂糖凝胶电泳分析。
粒子图像测速和温度测量
通过粒子图像测速技术(PIV) 对毛细管 (75ul) 中流体的流动进行了观察。其中,h / d = 7.7 ( h / d 表示毛细管中样品的高度与毛细管内径之比)。
试剂采用去离子水,直径 50μm 的polystyrene polyamide particles 作为 trace particle (:1005 )。
预热 10 min 后,采用 Nd:Yag 激光 ( λ= 532 nm ) 作为激发光,示踪颗粒在 〜585 nm 处发荧光。图像以每秒 15 帧的速率在 CCD 相机上被捕获。
试剂和油之间的温度()采用温度记录仪测量。
结果与讨论
如图 2A 所示,在此平台中,当毛细管从下端加热,上端被周围的空气冷却时,试剂中产生的温度梯度引起自然对流,使得试剂循环通过 DNA 扩增所需的热梯度。
成功应用此平台有如下两个挑战: (1)当只有一个温度控制装置时,需保证变性,退火和延伸所需流场和温度场的稳定性; (2)设计适合与平台产生的温度梯度一起使用的引物和扩增子。
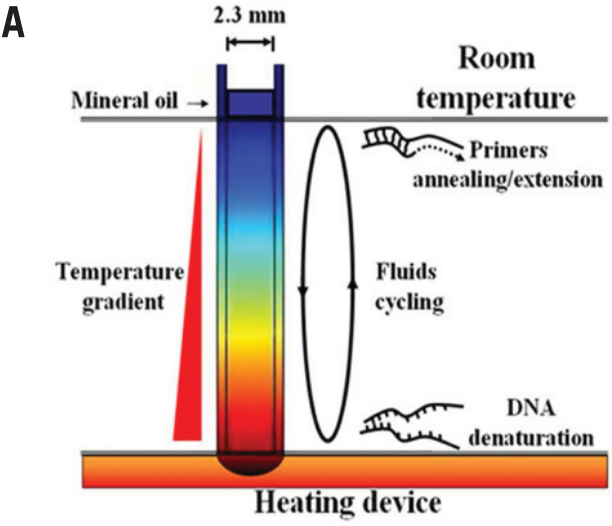
图 2A
图 1B (顶部) 显示了从毛细管下端加热,其内部试剂循环一圈温度的变化情况。(the hottest temperature) 位于毛细管底部,(the lowest temperature)位于毛细管上方 (油和试剂接触的部分)。 为确保 PCR 扩增的三个步骤发生在毛细管内部,(扩增子的变性温度)应低于,(引物的解链温度;melting temperature of the primer)应高于 。显然,在变性/退火/延伸步骤中有效反应的时间取决于温度差:和 。 Primers with melting temperatures in the range of 52-58°C generally produce the best results.
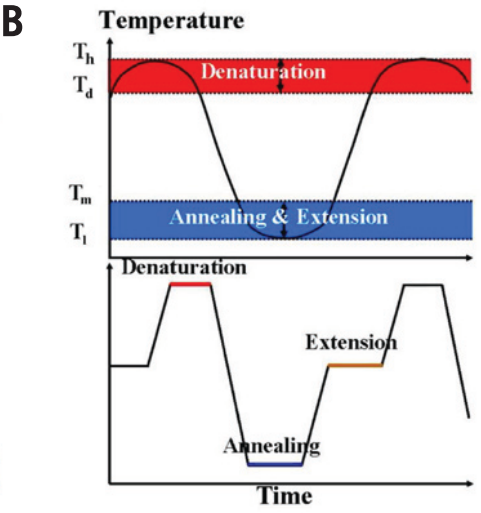
图 2B CCPCR (上图) 和传统 PCR (下图) 之间样品温度曲线的比较。传统 PCR 在每一步扩增中都保持恒定的温度,并且整个管中一次只能执行一个扩增步骤,而 CCPCR 的温度曲线沿毛细管的长度方向平滑变化,同时 PCR 扩增的不同步骤同时进行。
为了延长扩增的持续时间,可以通过调节热系统或通过设计具有高解链温度的特异性引物来调节和 。 如图 3 所示,采用不同体积的样品测量了油和试剂接触部分的温度。结果表明,样品体积越大,越低。理论上讲,可以增加更多的样本量来降低以提供更长的有效扩增时间。

图 3 当热浴锅温度设定在95°C时,油-样品区的温度随着样品体积的增加而降低
但是,如果流体路径过长,可能会激发自然对流中的第二种运动模式:也就是说,流动模式可能会分成两个或多个垂直循环路径。对于更长的毛细管,流体流动可能会变得更加紊乱。 应避免这些情况,以确保流体运动模式的稳定性。进一步,腔室体积变大会增加所需 PCR 试剂的量进而增加反应成本。因此,选择了体积为 75μL 的毛细管来维持稳定的热对流环境。

图 4 (I) 将底部厚度为 3mm 的商用玻璃毛细管放在具有直径 3.2mm ,深 4mm 孔的铝块中加热. (II) 一个塑料毛细管支架防止毛细管倾斜(支架高度(HH): 26 mm;矿物油: 10μL). (III)采用 PIV 进行流场分析. (IV) FLUENT 模拟显示当样品高度为 18 mm (体积为75μL) 时,毛细管中流场的稳定循环状况.
如图 4 所示, 采用 PIV 可视化了毛细管 (直径: 2.3 mm) 中的流体流动情况,并通过 FLUENT 仿真模拟软件进行了确认。上述设计解决了流体流动产生的第一个挑战和成功扩增所需的温度场。
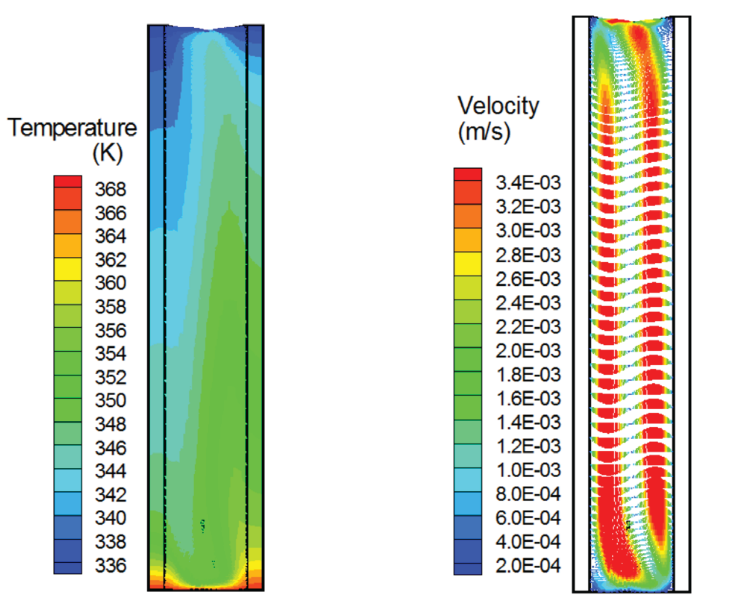
图 5 h/d = 7.7, Ra = 时,毛细管对应的温度场和速度场分布. 对于第二个问题,在固定温度条件下(°C , °C),引物的最佳值应该被测试。本文设计了 7 个在 57–80°C 范围内具有不同的引物对,通过上述平台扩增 HBV。 如图 6 凝胶电泳数据所示,CPCR不能使用≤ 70°C 的引物扩增靶 DNA,但 ≥ 72°C 的引物却可以成功扩增靶 DNA。采用 ≥ 76°C 的引物,电泳 DNA 条带的强度似乎更强。
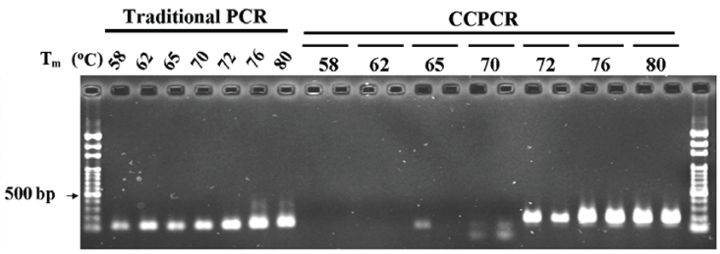
图 6
除了 之外,用于变性的 是影响 CPCR 扩增的另一个因素。如果试管中的太接近,CPCR 将失败,因为双链 DNA 不可能完全变性,这将不允许引物有效地退火至模板 DNA。这会降低平台检测长扩增子的能力,因为较长的长度或较高的 GC 含量通常会伴随较高的变性温度。 如图 7I 所示,本文对范围为 86–91°C 的四个 HBV 扩增子进行了测试,发现 CPCR 可以在 < 87°C ( > 8°C) 的情况下扩增两个扩增子 (122 和 169 bp)。 > 90°C 时 (< 5°C) 扩增其它两个扩增子 (188 和 222 bp)。为了增加 ,可以将加热温度从 95 °C 调整为 99 °C。 在图 7BII 中可得出, > 90°C 时,188 和 222 bp 的扩增子均出现弱带,表明较大的值可以成功扩增具有较高值的 DNA 模板。 应当注意,图 7BII 中122 和169 bp 扩增子的条带均比图 7BI 中的条带弱。原因可能为,当 ≤ 86°C 时,这两个扩增子的引物退火效率会因油-试剂处温度的升高而降低。
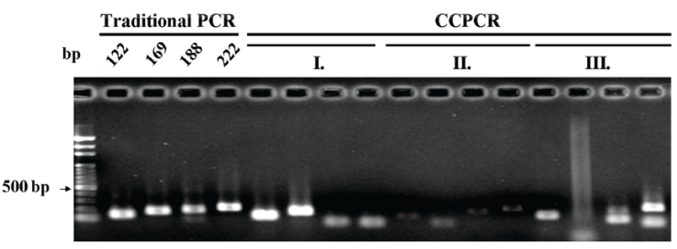
图 7
也可以使用化学方法通过添加二甲基亚砜 (DMSO) 来降低扩增子的 ,从而增强 DNA 二级结构的变性。但是,DMSO 也会影响模板上的引物退火,因为引物的降低,在某些情况下可能会对 CPCR 扩增产生不利影响 (如图 7BIII)。 保持相同的热场(°C, °C) 对于在毛细管中保持一致的流场和温度场分布很重要,而且如果可以选择具有所需的扩增子而不改变引物的会更好。 选择低是扩增长扩增子的策略,但存在加热器温度必须保持在 95°C 的限制。因此,本文尝试使用 CPCR 扩增 7 个不同长度的扩增子,从 208 到 816 bp。

图 8
如图 8 所示,CPCR 可以扩增 DNA≤500 bp 的长度。这揭示了和在 CPCR 中的重要性,而传统 PCR 则更多地依赖于。 总之,对于任何 DNA 模板,CPCR的经验法则是采用具有高的引物和低的扩增子。 为了证明这一规则,如图 9 所示,本文选择了几种 ≤500 bp (≤ 87°C,≥ 76°C ) 的不同病毒扩增子进行检测,成功的实现全部扩增。
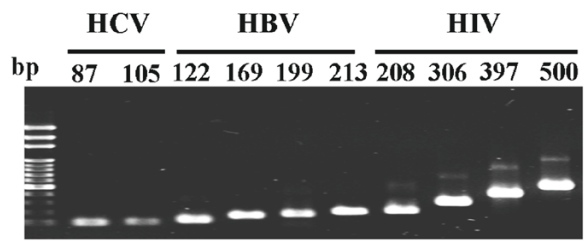
图 9
如图 10 所示,HBV 质粒DNA的测试灵敏度为每个反应 30 份。高拷贝和低拷贝 HBV DNA 序列 (分别为 3000 和 30拷贝/管) 仅在 30 分钟内通过 CCPCR 扩增。
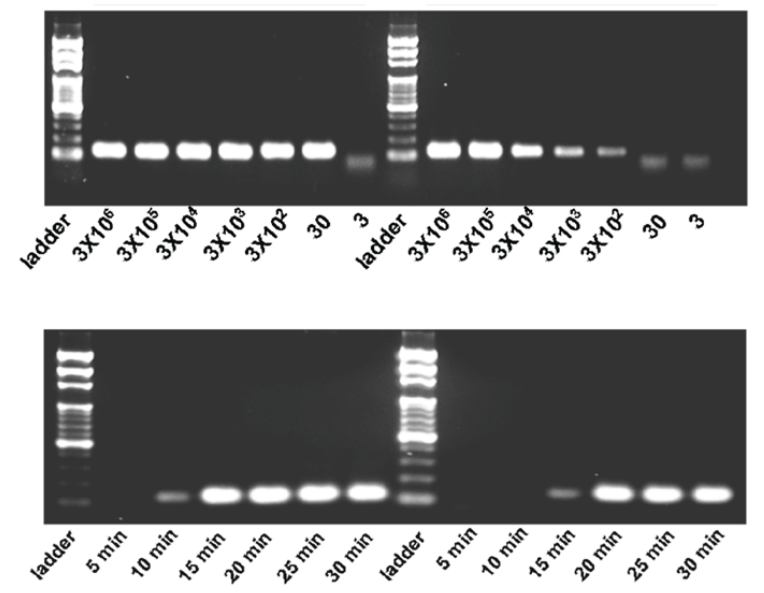
图 10 (上图) 传统 PCR (图片右半部分) 和 CCPCR (图片左半部分) 扩增从 到 3 的初始 DNA 拷贝数。传统 PCR 的总反应时间为 1 小时 40 分钟,CCPCR 为 30 分钟。(下图)使用高和低DNA浓度通过 CCPCR 进行扩增的时间流程 (初始 DNA拷贝数:3000,左;30,右) 本文研究表明,这种简单的扩增方法确实需要对扩增子和引物 (高引物和低扩增子) 进行重新设计和优化,以使其具有与传统 PCR 相当的性能。 这种优化增加了和 的相对温差,从而延长了变性/退火/延伸反应的空间和时间。
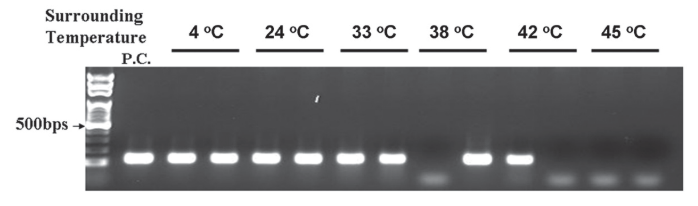
图 11 毛细管对流 PCR 在不同环境温度下的反应。初始 DNA 拷贝为1000 份
一个主要的担忧是环境温度可能会对 CPCR 产生影响,因为该平台使用环境温度作为冷却机制。 如图 11 所示,本文测试发现,CPCR 在冰箱中 4°C 和暖箱中 33°C 均有效,但当环境温度 > 38°C 时 CPCR 扩增失败。因此,除了极热的地方外,CPCR 与一般的室内操作兼容。
参考文献
Rapid DNA amplification in a capillary tube by natural convection with a single isothermal heater.
编辑:黄飞
-
温度控制
+关注
关注
7文章
286浏览量
36812 -
DNA
+关注
关注
0文章
243浏览量
31188 -
温度记录仪
+关注
关注
0文章
48浏览量
12579
原文标题:影响对流PCR扩增成功与否的因素
文章出处:【微信号:MEMS拓荒者,微信公众号:MEMS拓荒者】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
核酸检测需要用到哪些应用器件
illumina的接头结构以及基于此衍生出的设计模式
PCR技术有哪些功能与应用呢
PCR基因扩增实验室装修设计解决方案-生命科学
高通扩增实境技术将球票转化成3D游戏
一种应用于核酸超敏检测的CRISPR-Cas9链取代扩增技术
消息称东芝计划将电源控制芯片产能扩增50%
一种基于CRISRP技术的超灵敏、高通量COVID-19荧光诊断系统
基于“指数扩增反应-包覆式DNA四面体镊子”的生物传感法
恒温扩增荧光检测仪的原理以及应用范围的介绍

PCR仪温度校准装置、基因扩增仪(PCR仪)测温系统校准装置

RH108A:业务扩增数据表 ADI





 引物和扩增子设计对DNA扩增成功有何影响
引物和扩增子设计对DNA扩增成功有何影响










评论