学术动态 | 干细胞样肿瘤细胞的Midkine表达驱动mTOR抑制和免疫抑制微环境的持续 (一)
文章详情
图解摘要
我们之前详细介绍了研究者对AML 和 LAM的单细胞分析、AML细胞中的通路和遗传调控网络的图谱以及AML肿瘤细胞表现为两种主要状态:干细胞样和炎性,现对接下来中间部分的内容进行详细介绍。
03
研究内容
AML细胞的干细胞样细胞群可能与雷帕霉素耐药有关
研究者观察到肿瘤细胞亚群的干性和休眠性增强,这是耐药性肿瘤细胞的典型特征,这促使研究者直接研究雷帕霉素在AML细胞中的耐药性。他们从本研究分析的AML肿瘤之一做了原代培养,并用DMSO(对照)或雷帕霉素(实验)处理这些细胞,然后进行scRNA-Seq分析(图3a),聚类确定了7个细胞群(图3b),AML细胞占33%(图3c)。集群4包含来自对照组和雷帕霉素治疗组的AML细胞,表明它包含对雷帕霉素有抵抗力的细胞,或者至少是转录没有被雷帕霉素治疗改变的细胞。在这个集群中,许多AML肿瘤标志基因的表达不受雷帕霉素的影响,而在其他集群中雷帕霉素抑制了这些肿瘤基因的表达,例如CTSK(图3d)。此外,第4群中的细胞显示出高干性评分(图3e)和高休眠评分(图3f和补充图6c)。NR2F1调节子的活性在这个簇中也很高(图3g)。
据报道,MDK在其他肿瘤中介导耐药性,为了确定MDK是否参与雷帕霉素耐受,以及MDK是否受TSC途径的调节,研究者使用了两种TSC的细胞模型,发现与TSC2-reexpressing 621-103细胞相比,在TSC2缺陷的AML患者衍生的621-101细胞中,以及与TSC2-add back TTJ+ TSC2细胞相比,MDK的表达上调了(图3h)。与对照组相比,患者来源和小鼠来源的TSC2缺陷细胞系中的MDK水平都明显升高(图3i)。接下来,研究者用DMSO、雷帕霉素(20 nM)、iMDK(MDK抑制剂,1 µM)或雷帕霉素(20 nM)和iMDK(1 µM)的组合处理TSC2缺陷细胞(621-101,TTJ)和正常人类成纤维细胞(NHLF)。在所有3个细胞系中,单独使用iMDK处理的效果最小。当与雷帕霉素结合时,iMDK对两个TSC2缺失的细胞系有协同作用(图3j)。他们将协同作用定义为两种药物的综合效果大于每种药物的单独活性之和。为了确定iMDK是否在体内使肿瘤对雷帕霉素治疗敏感,他们使用TSC2缺陷的TTJ细胞在免疫缺陷的无胸肌裸鼠体内产生皮下肿瘤。与单独使用雷帕霉素相比,iMDK和雷帕霉素的联合治疗导致了更快的肿瘤反应的发生,以及更低的肿瘤负担,而单独使用iMDK没有明显的效果(图3k,补充图6d)。
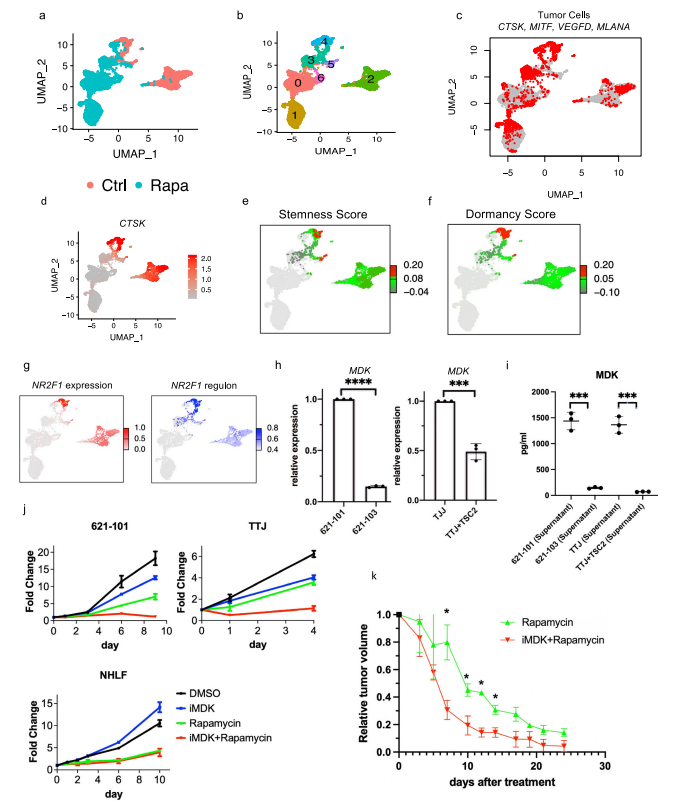
图3. AML细胞的干细胞群可能有助于雷帕霉素的抗性a
异质性肿瘤细胞状态对内皮细胞的重塑
研究者探究了SLS和IS对肿瘤微环境的潜在不同影响。在6个AML样本中,2个AML主要由IS组成(>70%),4个主要是SLS(>80%)(图4a)。以SLS为主的肿瘤有更多的内皮细胞(图4b)。为了验证这一点,他们对每个AML进行了内皮细胞标记物CD31的免疫组化(IHC)染色,发现与scRNA-Seq预测的百分比有很强的相关性(图4c),在SLS主导的肿瘤中内皮细胞的百分比更高(图4d,补充图7a)。差异表达分析显示,MDK的表达要比VEGFD高得多,MDK在群集1(SLS)中表达较高,而VEGFD在群集3(IS)中表达较高 (图4e)。这些数据表明,SLS肿瘤中促血管生成的MDK的高表达可能是该亚型AML中富含内皮细胞的原因。
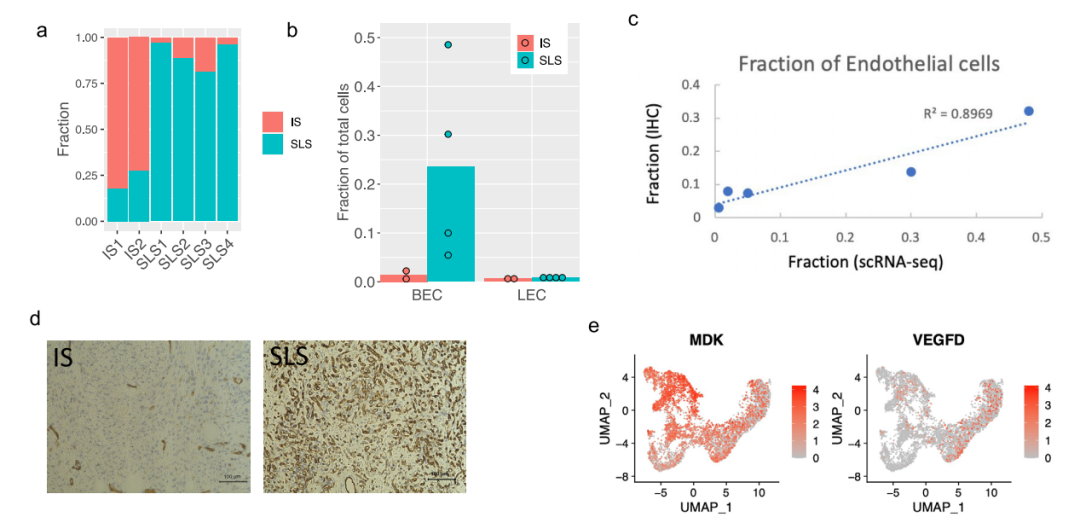
图4. 以SLS为主的肿瘤的内皮细胞重塑
scRNA-Seq和scTCR-Seq的综合分析揭示了SLS优势肿瘤的T细胞功能障碍和抑制的克隆扩展
在人类TSC肿瘤中已经观察到T细胞的浸润和衰竭,并且在小鼠模型中观察到免疫疗法的明显益处。为了确定T细胞是否受到AML中肿瘤细胞状态的影响,研究者重点研究了4个与正常肾脏配对的AML,其中2个以SLS为主,2个以IS为主。对肿瘤来源的CD8+T细胞进行重新聚类,发现了3个主要的细胞群:记忆/免疫T细胞(CD8 Tm/naive)、效应T细胞(CD8 Teff)和增殖T细胞(CD8 T-prolif),以及每个主要细胞群中的亚群,它们具有不同的免疫检查点基因或细胞毒性效应基因的表达(图5a,b)。来自SLS优势肿瘤的CD8+T细胞与来自IS优势肿瘤的CD8+T细胞相比,显示出更低的细胞毒性分数,而且每个亚群内的细胞毒性细胞(定义为表达至少一种细胞毒性效应基因)的百分比也较低(图5c)。此外,SLS主导的肿瘤衍生细胞表现出更高的衰竭分数(图5c)。尽管每个亚群中衰竭细胞的频率大致相同(图5c),但SLS主导的肿瘤中衰竭的CD8+Teff细胞的比例高于IS主导的肿瘤,而IS主导的肿瘤显示出更高的细胞毒性CD8+Teff和CD8+Tm/Naive群体的频率(图5d)。对肿瘤来源的CD4+T细胞的类似分析显示了6种CD4+T细胞的亚型(图5e,f)。虽然来自IS显性肿瘤的记忆型CD4+T细胞和CD40LG高的群体显示出较高的细胞毒性分数(图5g),但在SLS显性肿瘤和IS显性肿瘤之间没有观察到任何亚型的细胞频率的明显差异(图5h)。
肿瘤激活的淋巴细胞会发生克隆性扩增,来自同一克隆的扩增T细胞具有相同的TCR序列(克隆型)。研究者发现在以IS为主的肿瘤中,有229个克隆型在CD8+T细胞亚型中共享,319个克隆型在CD4+T细胞亚型中共享,但在以SLS为主的肿瘤中只有5个克隆型在CD8+T亚型中共享(图5i)。SLS肿瘤在CD8+T群体中显示出相当有限的亚型之间的克隆型共享,而在CD4+T群体中没有克隆型共享,而IS肿瘤在CD8+T和CD4+T群体中都显示出亚型之间广泛的克隆型共享(图5j)。CD8+ Teff亚型中75%的扩增TCRs与IS肿瘤中的CD8+ Tm/Naive亚型共享,显示了这两种CD8+ T细胞状态之间的动态联系。在IS肿瘤中,大多数增殖的CD8+T细胞与CD8+Teff群体共享克隆型,这可能意味着肿瘤抗原反应性T细胞增殖(图5j)。增殖的T细胞与两个细胞毒性Taff群体(CD8 Teff-TNF和CD8 Teff-IFNG)共享大量的克隆型。此外,在CD8 Teff和两个细胞毒性Teff群体(CD8 Teff-TNF和CD8 Teff-IFNG)之间观察到广泛的克隆共享,这表明向功能性T细胞分化的轨迹是活跃和动态的。这些观察结果表明,在IS肿瘤中观察到的高频率的细胞毒性CD8+T细胞,至少部分是由于可能的肿瘤识别效应细胞的动态分化。研究者使用RNA速率分析支持了从CD8效应T细胞到增殖T细胞以及从多个CD4+T亚群到Tregs的分化轨迹(图5k)。相反,以SLS为主的肿瘤显示出亚型之间有限的分化潜力。
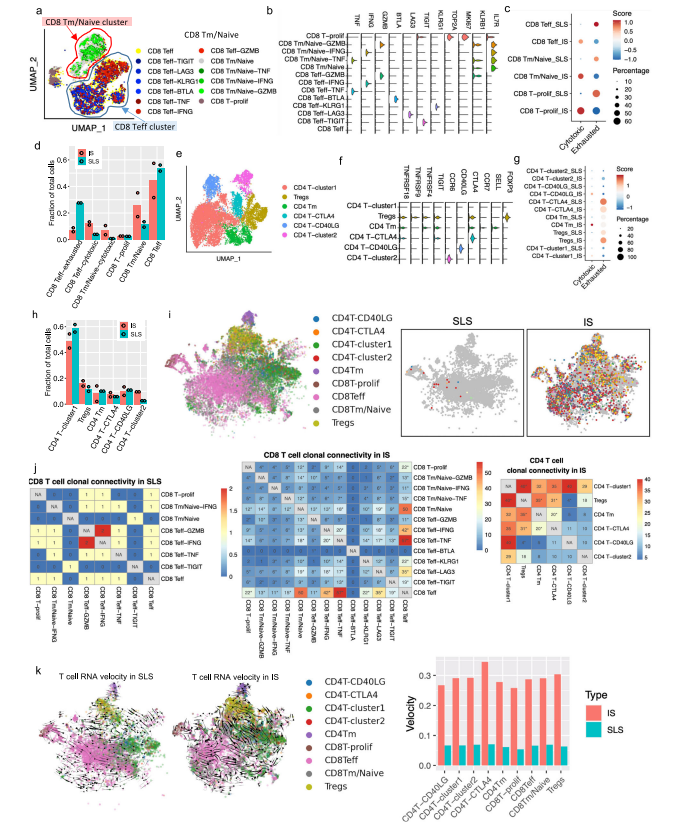
图5. 在SLS主导的肿瘤中,T细胞功能紊乱和T细胞克隆扩展受到抑制
经过今天的介绍,小伙伴们是不是对文章有了一个更深入的了解呢,在明天我们会介绍文章的最后一部分内容—研究者对SLS和IS的肿瘤免疫微环境所做的研究,让我们共同期待吧!
SBC 单细胞测序平台
单细胞转录组测序(Single-cell RNA-sequencing)是指在单细胞水平上对RNA进行高通量测序和分析的新技术。公司(中心)建立的单细胞测序的主流平台——10x Genomics Chromium,可提供大规模、灵活、全面的单细胞测序服务,包括单细胞转录组、单细胞免疫组库、单细胞ATAC-seq、单细胞ATAC+转录组测序等。经过多年的积累,现已形成从样本保存、运输、单细胞悬液制备,到单细胞分选、建库和数据分析的一站式解决方案。目前已为来源于人、小鼠、大鼠、斑马鱼等多种物种的临床和科研样本提供了单细胞测序和数据分析服务。
SBC 空间转录组测序平台
空间转录组学技术能够测定组织样本中(冰冻和石蜡样本)的所有基因表达图谱,并定位具体发生的位置信息。公司(中心)建立的10x Genomics Visium空间转录组测序平台,无需进行目标预设就可以在空间上实现组织中基因表达的可视化。通过数据分析和数据可视化,将基因表达数据映射到图像上,实现对同一样品基因表达和细胞组成空间结构的表征,以从组织切片中获得生物学的全貌。
-
数据
+关注
关注
8文章
7048浏览量
89068 -
模型
+关注
关注
1文章
3248浏览量
48859 -
SLS
+关注
关注
0文章
15浏览量
8923 -
干细胞
+关注
关注
0文章
7浏览量
2639
原文标题:干细胞样肿瘤细胞的Midkine表达驱动mTOR抑制和免疫抑制微环境的持续(二)
文章出处:【微信号:SBCNECB,微信公众号:上海生物芯片】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
骨软组织肿瘤与TAP检测
微流控技术如何有效提高肿瘤化疗效果
牛海涛团队首先利用微流控芯片模拟肿瘤微环境体外建立仿真实验系统
研究人员利用微流体技术构建3D肿瘤组织模型
深圳先进院在在微纳生物机器人治疗肿瘤研究中取得进展
基于原子力显微镜的肿瘤转移过程中单细胞及微环境机械特性的探测与表征
基于微纳操作机器人的肿瘤转移过程中多尺度机械特性研究综述论文
基于重编程外泌体的智能递送和个体化肿瘤治疗研究获进展
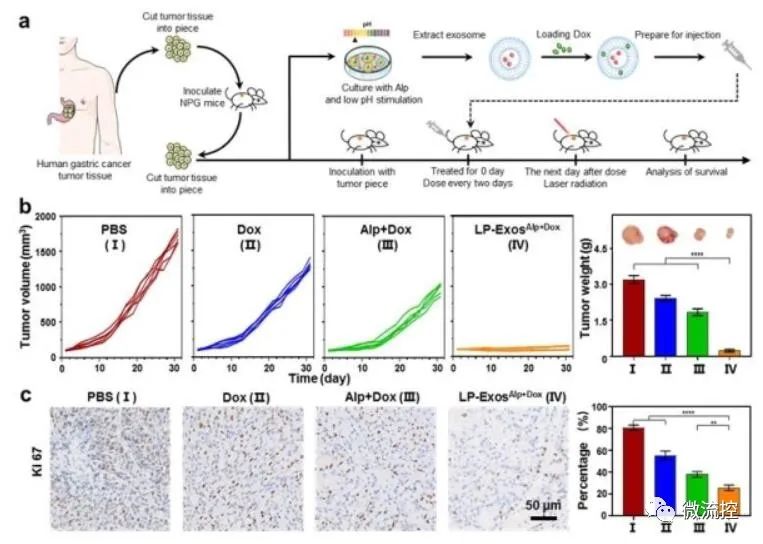
一种基于微流控的微型肿瘤芯片
如何重现体内肿瘤生态位?微流控芯片来帮你
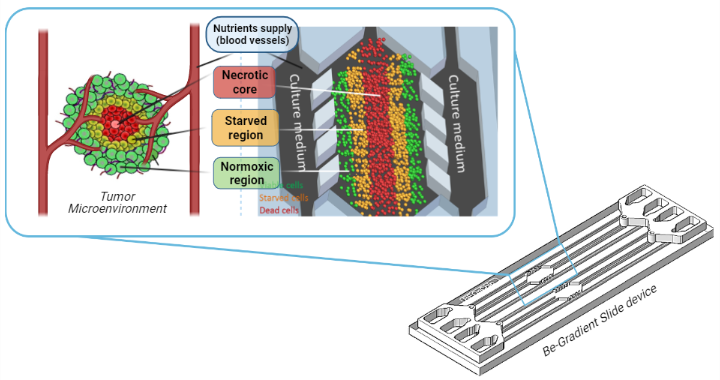
乳腺癌微环境的时间分析揭示胶原蛋白XII是肿瘤转移的驱动因素
mTORC1高活性的干细胞样状态肿瘤细胞类型分析
SLS 3D打印技术简介
研究者如何研究SLS和IS的肿瘤免疫微环境
微针系统在肿瘤疫苗中的研究进展




 SLS和IS对肿瘤微环境的潜在不同影响
SLS和IS对肿瘤微环境的潜在不同影响










评论