作者:郝翔, 李依明, 傅爽, 李旸晖, 许迎科, 匡翠方, 刘旭
20世纪90年代以来,科技的进步突破了光学显微镜的衍射极限,使三维超分辨显微成像技术得以实现。其中,基于两个对置物镜的4Pi显微架构及其超分辨版本的出现是一个重要的里程碑,并在材料科学领域和细胞生物学领域得到广泛应用。
中国工程院院刊《Engineering》2022年第4期刊发浙江大学郝翔教授研究团队的《4Pi荧光超分辨显微术综述》一文,综述了4Pi超分辨显微术的近期进展。文章指出,4Pi超分辨显微镜为透明样品观测提供了一种能够突破衍射极限、非侵入、各向同性的三维分辨率的技术手段。针对目标开关和随机开关两个主要的4Pi超分辨显微术版本,文章深入讨论了其架构、原理、应用和未来发展趋势。

一、引言
自1873年Abbe等推导出衍射极限以来,光学显微镜的分辨率在接下来的一个多世纪中未能取得根本性突破。然而,对于高分辨率的追求从来就没有停止。最终,经过不懈努力,科学家在20世纪90年代取得突破。由于衍射极限的存在,可见光波段范围内的显微镜分辨率一直被限制在250 nm以内。超分辨显微术的出现使得人类终于打破这一桎梏。得益于过去20年超分辨显微术的进步,现阶段已经可以实现在xy平面和沿z轴将分辨率分别提升6~10倍。需要强调的是,超分辨显微术并非特指某项技术,而是若干种不同技术方案的总称。但是,无论具体实现方式如何,这些技术在本质上是相通的:各种技术都由光强调制,并且非线性地开关荧光染料分子以实现对荧光辐射的操控,继而在时间上依次记录整个观察区域内的细节。正是由于这些技术能够提供突破衍射极限的分辨率,才使首次使用光学显微镜进行许多生命科学研究成为可能。
由于大部分生物结构都具备三维空间分布,因此,将超分辨率成像扩展至三维水平,可以清晰地显示这些生物体结构或记录分子运动。将原有的二维超分辨显微成像扩展至三维水平有多种技术实现路径。对于单分子定位显微术(SMLM),如光激活定位显微术(PALM)、随机光学重构显微术、荧光激活定位显微术(fPALM)而言,可以采用双焦面成像或者点扩散函数(PSF)操控的方法;对于以受激发射损耗显微术(STED)、可逆饱和光学荧光跃迁显微术为代表的目标开关超分辨显微术而言,最常用的策略则是同时使用两个相位板,通过非相干叠加的方式来创造一个三维中空的STED/RESOLFT聚焦光斑。
通过以上两种技术路径都可以在理论上获得无限小的分辨率。然而,在这些不受衍射极限限制的技术中,光的衍射现象实质上仍然发挥作用。然而,无论使用哪种技术,最终能达的分辨率仍然取决于显微镜聚焦光斑的锐利程度。这一事实导致的后果便是:相对而言,轴向分辨率的提高比横向(焦平面内)分辨率的提高更加困难。因此,即使通过超分辨显微术可以将横向分辨率提升到20~40 nm,但是同一架构下达到的轴向分辨率仍然比横向分辨率低(后者约是前者的2.5倍)。
相对而言,各向同性的三维分辨率受到更多青睐;因为各向同性的三维分辨率能够提供更加自然的视野,并且基于这样的图像进行数据分析,得到的结果也更加精确。然而,由于使用单个透镜只能覆盖半个球面波波前,除非刻意牺牲横向分辨率,否则要做到三维各向同性是非常困难的。另外,如果存在一个光学系统,能够收集焦面之后的另外半个球面波波前,由于对称性的恢复,系统PSF的形状就可以(基本上)保持为一个球形。基于上述思想,在20世纪90年代早期,Hell等发明了基于两个对置物镜的4Pi显微镜。在实际应用中,一个物镜大约只可以覆盖65°的半孔径角,使用两个物镜则可以几乎完整覆盖整个4 π的立体角(实际应该为2.5 π~3 π)。如图1所示,在4Pi显微术中,逆向传播的两束相干照明光分别经过两个对置物镜在共焦面上聚焦,并产生叠加干涉条纹的PSF。这种实现方式被称为A型4Pi架构。另一种实现方式,即B型4Pi架构,则通过对置物镜反向收集荧光信号并让它们在探测器上发生干涉。由于引入了共焦面附近的干涉,上述两种方式都可以在轴向上显著压缩PSF的尺寸——这也是构成扫描型4Pi显微镜的基础。如果只保证激发光(A型4Pi架构)或荧光(B型4Pi架构)相干,则可以将轴向分辨率提高3~4倍。如果同时使激发光和荧光相干(C型4Pi架构),则可以将轴向分辨率提高约7倍。除此之外,由于4Pi架构可以从两个方向收集荧光,可收集的荧光光子数可翻倍,最终可以提高图像的信噪比(SNR)。与之类似,非相干干涉照明图像干涉显微术可以被理解为是4Pi显微术基于相机的宽视场版本:包含两个对置物镜,在焦面附近采用驻波干涉作为照明,并以相干的方式收集荧光信号。因此,它的分辨率也与4Pi显微镜类似。

图1. 4Pi显微镜的简化架构与原理示意图。(a)简化架构示意图。(b)在轴向平面(xz平面)内的4Pi显微镜PSF。上下两个物镜的PSF相干叠加压缩了整个PSF的轴向尺寸。(c)不同4Pi架构的有效PSF。从左至右:A型架构,激发光相干;B型架构,发射光(荧光)相干;C型架构,两者同时相干。APD:雪崩光电二极管;BS:50/50分光镜;DM:二向色镜;L:透镜;M:反射镜;SM:扫描镜。
4Pi显微术与超分辨显微术的结合可以进一步提高系统的三维分辨率,特别是轴向分辨率。与单物镜版本的超分辨显微术类似,4Pi超分辨显微术也可以分为目标开关型(isoSTED、4Pi-RESOLFT)和随机开关型(iPALM、4Pi-SMS、4Pi-SMLM)两类,如图2(a)所示。在目标开关型4Pi超分辨显微术中,分别来自对置物镜逆向传播的两个波前发生干涉相消,使得STED/RESOLFT聚焦光斑的中央光强极小值区域在轴向得到显著压缩[图2(b)]。因此,荧光信号的发射被限制在焦点附近非常小的区域内。而4Pi-RESOLFT和isoSTED技术的主要区别在于前者主要使用具有可逆开关效应的荧光蛋白(RSFP)来提供超分辨显微术所需要的亮态和暗态。对于随机开关型的4Pi超分辨显微术,轴向分辨率的提高则主要利用算法提取隐藏在干涉条纹中的轴向(z方向)位置信息[图2(b)]。为了求解位置信息,对于不同的设计可以同时记录三幅(iPALM)或四幅(4Pi-SMS、4Pi-SMLM)干涉相位图。

图2. 4Pi超分辨显微术的简化架构和原理示意图。(a)isoSTED/4Pi-RESOLFT(左)与4Pi-SMLM(右)显微镜的简化架构示意图。两种架构在成像时都将样品放置在物镜共焦面上。围绕光路的小图标显示出在光路不同位置(由带圈I‒XI号标出)光的偏振态。特别地,在位置VII、VIII和XI处,同一幅图中的虚线箭头相对于实线箭头有π/2的相位延迟,该延迟是由系统中的石英楔造成的。左图:在isoSTED/4Pi-RESOLFT显微镜中,两束STED光,即STEDxy(横向)和STEDz(轴向)互不相干并保持垂直的偏振态。两束光通过一个偏振分光棱镜(PBS)合束后,再经过一组扫描镜进入4Pi干涉腔。合束后的光经第二个PBS分束后,在物镜的共焦点位置分别生成STEDxy(横向)和STEDz(轴向)损耗光聚焦光斑[如图(b)从左起第一和第二列所示]。两个光斑的中央光强极小值(即焦点)位置互相重合,并通过受激发射对荧光发射现象产生各向同性的损耗作用[如图(b)从左起第三列所示]。这种作用是通过迫使被STED光照射的荧光分子持续性地处于暗态的方式发挥效用的。同时,焦点附近的荧光信号被两个物镜反向收集。收集到的荧光光子在一片二向色镜上发生反射,并最终进入探测器。右图:在4Pi-SMLM显微镜中,荧光光束被一组分束器反复分束和合束,以形成一系列具有不同干涉相位的光波波前。这些光波波前的相互干涉图样最终被位于干涉腔之后的相机同时接收。虽然在不同的设计中,具体的光路和探测器的数量不同,但所使用的单分子定位原理都是相通的,即经过干涉条纹调制后的PSF相比原有的PSF含有更多的高频信息,因此利用4Pi-PSF进行定位计算,所得到的结果可以更加精确。(b)4Pi超分辨显微镜中的PSF轴向平面(xz平面)强度剖视图。从左至右:isoSTED/4Pi-RESOLFT显微镜中的STEDxy、STEDz、合并后的STED(红色),以及有效PSF(绿色);4Pi-SMLM显微镜中相对相位差ϕ = 0、90°、270°、180°时的荧光干涉PSF。为了更准确地描述isoSTED/4Pi-RESOLFT显微镜及4Pi-SMLM显微镜的各种PSF,在相应图片的右上角给出了在探测器(APD或相机)上测得的横向平面(焦平面,即xy平面)内的荧光强度分布。GW:玻璃窗口;HWP:半波片;Q:石英楔;VP:0~2 π涡旋相位板;s/p: s偏振光/p偏振光。
下面将详细讨论4Pi超分辨显微术的两种架构和它们的具体应用。需要强调的是,图像干涉非相干结构光照明干涉显微术(image interference and incoherent-illumination-interference structured illumination microscopy, I5S)并不在本文的讨论范畴。与I5M相比,I5S显微术在横向上利用结构光照明,实现了对有效PSF的三维压缩。但是,从原理上讲,I5S显微术并不依赖任何荧光的开关效应,即该技术既不需要目标开关也不需要随机开关。这使得I5S几乎可与任何荧光分子兼容,因此在具体应用上会拥有相当的优势。然而,也正因为如此,在理论上,I5S相对于宽视场显微术也仅能将分辨率提高两倍。为了进一步提高分辨率,则需要在显微镜中引入诸如荧光饱和的各种荧光非线性效应。但是遗憾的是,基于荧光饱和的I5S(或称为“I5SS”)至今仍未实现。
二、基于目标开关的4Pi超分辨显微术
STED超分辨显微术是基于1994年提出的理论模型发展起来的。该技术首先于1999年被实现并被用于材料学研究,并随即在2000年实现了在生命科学领域的应用。自此,STED彻底改变了荧光成像的范式。STED是首个被实现的基于目标开关原理的超分辨显微术。其基本工作原理是:在某一确定位置,通过荧光发射损耗效应将荧光发射限制在其周围一个亚衍射极限的区域内。当工作时,一个光强最强点位于中心的激发光斑和一个环形的STED光斑相互嵌套并扫描样品上的整个成像区域,在此期间,通过一个与焦点共轭的点探测器顺次读取信号并生成最终的图像。为了提高STED显微术的分辨率,STED光斑中心点之外的荧光发射都必须得到有效损耗。因此,一个高质量、中央光强为零的环形光斑对于提升STED显微镜的表现显得尤为重要。
过去15年的技术进步已经使STED显微术迈进了三维成像的新纪元。在众多具体的实现方法中,基于两个对置物镜的4Pi架构,由于可以在轴向生成非常锐利的STED聚焦暗斑而尤为引人注目。虽然其分辨率优势没有得到充分的发挥,但是早期的所谓STED-4Pi显微术已经能够在焦平面附近提供约33 nm的轴向分辨率。而作为其改良版本的isoSTED显微术则已能提供各向同性的三维高分辨率图像[图2(a)]。为了实现各向同性的三维荧光压缩,isoSTED显微术同时使用了两个光强零点重合的STED聚焦光斑:其中一个用于横向(STEDxy)压缩,而另一个则用于轴向(STEDz)压缩,如图2(b)所示。通过对两个聚焦光斑的光强分配进行调节,可以实现PSF大小(即分辨率)的精细操控。其中,为了生成STEDz聚焦光斑,需要将分别来自于两个对置物镜、相向传播的光波波前在焦平面上完美重合并形成干涉相消。由于单物镜PSF中的光强和相位对于焦平面高度对称,干涉相消除了在焦面中央产生一个光强零点外,在焦面上下都会产生一系列周期性分布的光强零点。这些次级光强零点会与激发光和探测光(荧光)PSF相重合。由于在这些次级光强零点附近,STED光没有荧光发射损耗能力,进而造成荧光信号泄漏,最终产生了有效PSF中的旁瓣,并造成使图像质量明显恶化的轴向“鬼影”(ghost images)现象。更为严重的是,当使用这样的有效PSF扫描整个样品时,由于上下光路光程差的存在,PSF中的光强极大值点会在PSF的包络下产生轴向飘移。因此,任何试图使用一成不变的PSF进行反卷积运算以消除旁瓣的努力都是徒劳的。理论上,基于可变PSF的反卷积运算可能会减轻“鬼影”现象,但是该方法仅适用于可以精确估计PSF并且图像信噪比很高的场合(这在现实中都很难做到)。为了消除有效PSF中旁瓣的影响,一种有效的策略是加入离焦量,使两个物镜的聚焦光斑产生反向偏移,从而破坏STEDz聚焦光斑中的对称性。这个策略可以通过使用相位板添加附加相位的方法实现。虽然类似的效果也可以通过直接调节两个对置物镜间的距离,从而破坏二者的共焦性的方式实现,但是使用相位板不会造成荧光信号和横向分辨率的损失。因而相比较而言,使用相位板的策略更加有优势。与STEDz聚焦光斑类似,STEDxy聚焦光斑也是通过分别来自于两个对置物镜、相向传播的光波前干涉实现的,但需要利用干涉相加而非相消。值得注意的是,虽然与单物镜系统相比,isoSTED显微镜中的STED聚焦光斑光强分布和所使用的总功率都比较接近,但是由于干涉的作用,其峰值光强是使用单物镜STED显微镜的两倍。基于改进版的Abbe公式可知:在这种情况下分辨率大约可以提高![]() 倍。
倍。
与一般的共聚焦显微镜相比,isoSTED显微镜的荧光光斑大小大概只有前者的1/1500,意味着isoSTED显微镜的三维分辨率可以达到20~50 nm。不断增强的成像能力使得isoSTED显微镜成为专门针对透明样品进行纳米级三维成像的强大平台。迄今为止,isoSTED显微术已在多个领域得到了广泛应用。在其发明后不久,一台isoSTED显微镜就被用于材料科学领域对微结构的自组装效应进行研究。这些结构由嵌段共聚物系统[苯乙烯-嵌段-2-乙烯基吡啶,图3(a)]形成,其中的乙烯基吡啶被Atto 647N特异性标记,以提供荧光对比度。当共聚焦显微镜无法完全分辨时[图3(b)],相关细节在isoSTED显微镜下得到完美呈现[图3(c)]。特别是,除了表面信息外,isoSTED显微镜还提供了一种非侵入式的成像手段,用于展现样品的内部的三维形貌,而这种成像能力是之前电子显微镜所无法提供的。
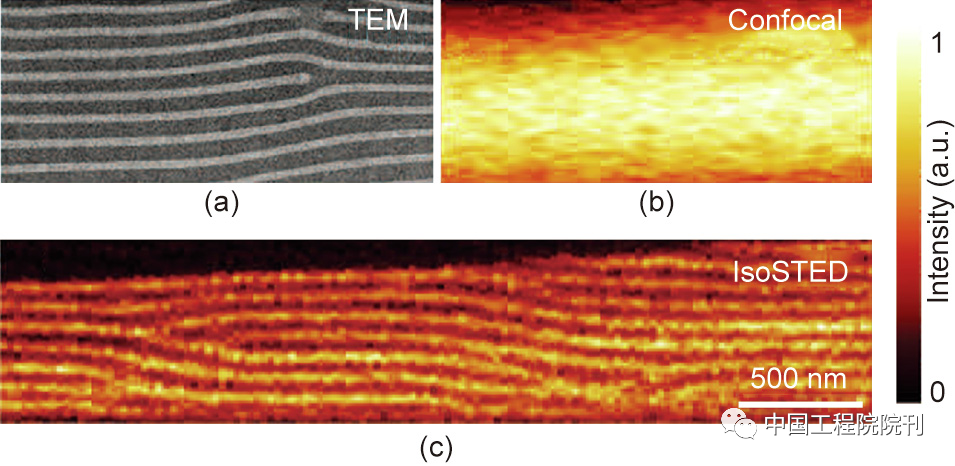
图3. isoSTED显微镜在材料科学中的应用。(a)透射电镜(TEM)下所展现的溶剂退火薄膜的层状结构。(b)相同样品在共聚焦显微镜下的成像结果,未显示任何细节。(c)在isoSTED显微镜下层状结构得到清晰展现。图中标尺:500 nm。经American Chemical Society许可,转载自参考文献,2009。
除了在材料科学领域的应用外,isoSTED显微术的重要性在细胞生物学领域也得到体现。线粒体是一种在能量产生过程中起重要作用的细胞器,是isoSTED显微镜的第一个成像目标。正如20世纪50年代电子显微镜(EM)所显示的那样[图 4(a)],在isoSTED显微镜下,线粒体也显示由两种不同的膜包围,且其直径为200~400 nm。isoSTED显微术的发展使科学家能够分析纳米级生物结构。通过对整个线粒体中直径约35 nm的PSF扫描成像,isoSTED显微镜成功绘制出F1F0-三磷酸腺苷合酶(ATPase)[图4(b)]和线粒体外膜转位酶20(TOMM20)[图4(c)] 的分布。在另一个应用中,科学家专注于突触小泡,突触小泡是神经元细胞中一种平均直径为39.5 nm的低电子密度泡状结构。这些突触小泡位于神经元突触前末端,用于储存神经递质,对于在神经元之间传播神经冲动至关重要。受益于isoSTED显微镜的能力,科学家还成功对海马体周围活动区表面池的空间分布进行成像。

图4. isoSTED显微镜在细胞生物学中的应用。(a)线粒体的直径示意图。野生型PtK2细胞中的F1F0-ATPase(b)和TOMM20(c)在isoSTED显微镜下的成像结果。本图经ACS许可,转载自参考文献,2009。
尽管isoSTED显微术的轴向切片成像能力远强于常规STED显微术,但对于活体生物学应用来说,其所需要的激光衰减功率仍然过高。为了实现活体样本成像,科学家进一步发明了4Pi-RESOLFT显微术。作为isoSTED显微术的衍生技术,4Pi-RESOLFT显微术与原版的最大不同在于,使用可开关荧光蛋白(RSFP)取代STED显微术中常用的荧光染料对样品进行标记。这种改进使得RESOLFT显微术尤其适用于活体细胞成像,原因是RESOLFT显微镜需要的激光衰减功率通常要比常规STED显微术低两个数量级,进而实现对可开关荧光蛋白的操控。
三、基于随机开关的4Pi超分辨显微术
SMLM的光学分辨率已经达到几个纳米,因此能够对纳米生物结构进行光学分析。SMLM利用宽视场激发和探测来随机激发和精确定位单个分子,从而实现超分辨能力。由于SMLM易于在传统的宽视场显微镜中实现,因此这种方法目前被广泛使用。通常通过评估PSF的横向信息和形状来实现3D-SMLM。或者,亦可以通过同时对多个焦平面成像来获得单分子的轴向位置。取决于探测的不同光子,这种技术可以实现20~30 nm的横向分辨率,而获得的轴向分辨率相对来说略低。
与传统的单物镜3D-SMLM系统相比,4Pi-SMLM通过利用由两个对置物镜所检测的荧光信号的干涉来显著提高轴向分辨率。两个对置物镜通过收集几乎完整的球面波波前,使孔径角增加并使探测到的光子数量加倍。此外,当两个轴向成像光路的光程长度在相干长度内时,重叠两个探测光路会导致单个光子的自干涉。随后同时记录单个分子的三个或四个不同干涉相位图。由于干涉相位对荧光团的轴向位置高度敏感,利用4Pi-SMLM得到的轴向分辨率比使用单物镜系统获得的轴向分辨率高6~10倍,在某些情况下甚至超过了横向分辨率。
单物镜纳米显微镜的轴向分辨率可达约60 nm,但需要使用明亮的合成荧光染料。使用较暗的荧光蛋白(FP)获得的表现通常较差。相比之下,理论上4Pi-SMLM通过在每个物镜中收集单个荧光团的250个光子便可实现亚10 nm的三维分辨率。因此,4Pi-SMLM适用于成像被更暗的光活化荧光蛋白(PA-FP)标记的生物样品。特别是在活体细胞成像中,内源性表达的PA-FP相对于合成荧光染料有几个关键优势:它们可以被更温和地固定,并且细胞可以被重新置于生理性培养基中。与合成荧光染料相比,荧光蛋白不需要除氧成像缓冲液和可能引起干扰的清洁试剂或处理来控制单分子的光物理特性。
即使使用荧光信号更暗淡的PA-FP,4Pi-SMLM的三维分辨率仍可以达到小于20 nm,从而使生物学家能够在三维空间更清晰地观察生物样品的细节信息。细胞外基质和肌动蛋白细胞骨架的细胞黏着斑(FA)的连接在形态建成、免疫和伤口愈合中至关重要。在细胞边缘突出期间,FA形成小于250 nm的簇状整联蛋白、FA激酶和桩蛋白。FA的多层蛋白质结构对于理解其功能至关重要。对于FA中不同蛋白质复合物的三维结构成像,最理想的方法是,将4Pi-SMLM与用PA-FP标记的FA结合。利用4Pi-SMLM的三维各向同性的纳米级分辨率能力,Kanchanawong等发现在不同大小和形状的FA中,每个FA成分的轴向分布高度一致,表明蛋白质在FA中的位置可调节其活性和功能。Case等则使用类似的策略调节黏着斑蛋白的激活和功能。
此外,对于许多不同生物系统,特别是那些需要超高分辨率的生物系统,4Pi-SMLM还提供了深刻的定量生物学阐释。转运所需的内体分选复合物(ESCRT)的纳米级结构[被人类免疫缺陷病毒(HIV)劫持]已经在病毒出芽点被4Pi-SMLM解析。ESCRT亚单位的空间结构表明,HIV释放的驱动力可能来源于病毒芽内部ESCRT亚单位的初始支架。两个离散的桶状结构(每个桶状结构由几十个单独的Nup188簇组成)也被4Pi-SMLM在细胞纤毛基底位置成功解析。这种结构特征证明了Nup199将中心粒包裹在桶状结构中的假说。此外,三维的4Pi-SMLM图像被用于量化分泌机制中蛋白质的数量。Zhang等展示了分泌系统中PrgH蛋白在细菌细胞膜附近形成的各种大小的三维分子簇(图5)。最近,4Pi-SMLM也已被成功用于解析异质纳米级交联的三维组织,为微凝胶形成动力学提供了深刻的见解。

图5. 使用4Pi-SMLM对不同生物样品进行超高分辨率三维成像。(a)由细菌细胞膜附近的分泌系统蛋白PrgH形成的分子簇的三维成像。(b)来自58个细菌细胞的PrgH簇的累积4Pi-SMLM图像。本图经National Academy of Science许可,转载自参考文献,2017。
除了在生物学和材料科学领域的应用,4Pi-SMLM在其他领域也得到不断发展,目前也具备越来越高的成像能力。当4Pi-SMLM概念被首次实现时,成像深度被限制在一个干涉周期内(发射波长的一半,约250 nm)。这是因为干涉光强是周期性的,属于相邻干涉条纹的光强峰值无法被区分。两种方法可以解决上述问题:第一种方法是在4Pi-PSF中引入像散。因此,PSF的整体形状可以用于展开不同周期中的干涉相位,从而将成像深度扩展到与基于散光的3D-SMLM方法所能提供的同样深度(约1 µm)。第二种方法基于发射的波前是球形的而非平面的概念,利用第零中心矩和第三中心矩的光强振荡不同的特点,精确地定位不同周期中的z位置。最近,自适应光学已经被引入4Pi-SMLM,从而实现了全细胞成像(图6)。此外,多色成像也被引入4Pi-SMLM。第一次双色4Pi-SMLM成像的实现是通过发射光中的s偏振光与p偏振光的比率来判定荧光团颜色。最近,利用由激发二向色镜反射的回收荧光实现了三色4Pi-SMLM成像。另一个令人兴奋的进展是4Pi-SMLM和电子显微镜的关联成像。4Pi-SMLM的高分辨率和高分子特异性与电子显微镜结合大大缩小了荧光显微镜和电子显微镜之间的分辨率差距,实现了荧光信号与电子显微镜图像更好的重叠。
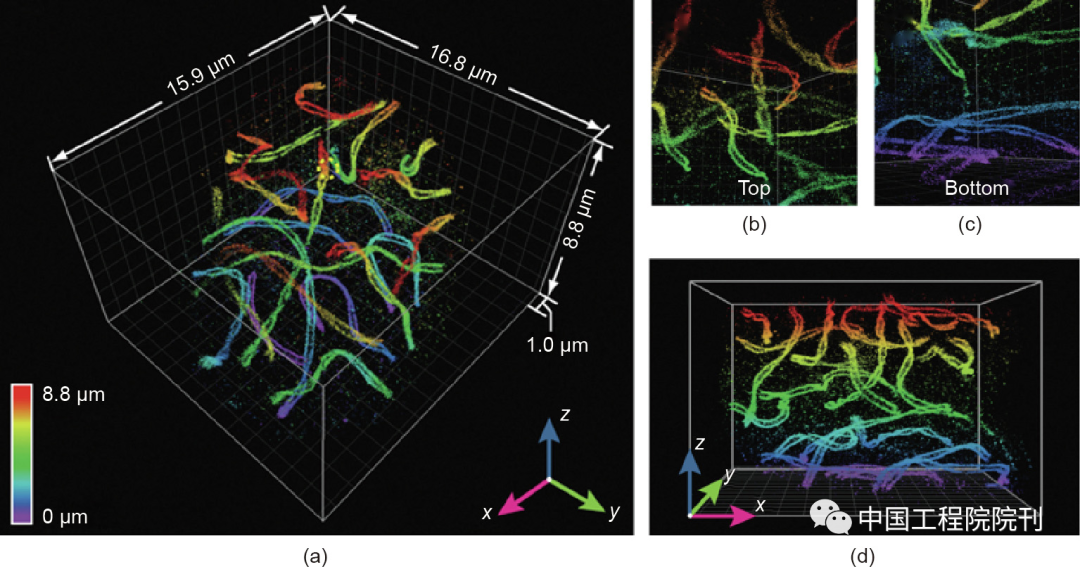
图6. 小鼠精母细胞联会复合体的4Pi-SMLM成像。(a)利用21个光学切片重建的全细胞的整体图像。精母细胞内部顶部(b)和底部(c)位置的4Pi-SMLM图像。(d)(a)图中的x—z视图。本图经Elsevier许可,转载自参考文献,2016。
用于单物镜3D-SMLM的理论极限精度已经可以通过基于荧光球的实验PSF模型和极大似然估计来实现,然而传统的基于相对光强的4Pi-SMLM的数据分析方法并不能达到理论分辨率极限。这是因为基于相对光强的方法并没有利用条纹状干涉4Pi-PSF中的高频信息来提升分辨率。三次样条插值的相位恢复的4Pi-PSF模型的开发,使得4Pi-SMLM可以达到理论分辨率极限。然而,由于4Pi-PSF本质上是四维的(x、y、z和相位),简单的多通道三维PSF模型不适合用于描述4Pi-PSF。Li等最近提出的4Pi-PSF模型将4Pi-PSF的三维位置和相位项进行解耦。他们不直接使用四维4Pi-PSF模型,而是通过三个三维矩阵和一个简单的相位项的结合来完整描述四维4Pi-PSF,使得四维4Pi-PSF的实验校准在实践中易于实现,从而发挥4Pi-SMLM的全部潜力。
四、讨论与展望
利用荧光的特异性标记能力,光学超分辨显微术已被证明是一种用于在亚细胞结构中探寻分子细节的有效方法。相关技术仍然在不断发展,以期提供多色、三维、活体细胞成像的纳米级显微成像能力。针对本文之前的讨论,图7给出了4Pi显微术的技术演进路线。现阶段,大多数超分辨显微术已有能力提供50~100 nm的空间分辨率。然而,如果空间分辨率能够在此基础上进一步提升一个数量级,那么生物学家就有望能直接观察大型分子复合体内的单个分子基团的三维图像。如果这一梦想得以实现,生物学家就可以对细胞内的分子机制进行原位成像,观察其结构和分子组成。这种能力对于许多的生物学研究至关重要,例如,在这样的分辨率下可以对DNA构象进行三维观察,以理解染色体DNA的包装和基因调控。在现阶段,为了具备这种能力,理论上可以通过在随机开关纳米显微镜中,将单个荧光发射器的光子数量增加两阶,或在靶向开关超分辨显微镜中将STED激光衰减功率提升两个数量级。然而,如此高剂量地增加光子数或激光强度,通常不利于实际的生物实验。相比之下,如果基于双物镜4Pi而非单物镜架构,相同超分辨显微术在轴向的分辨率几乎可以提高3~10倍。在此基础上,进一步将分辨率提高一个数量级,而且不需要满足荧光标记的严格特性或苛刻的成像条件。

图7. 4Pi显微术技术发展路线图。
除了4Pi超分辨显微术外,其他技术也可能将轴向分辨率提高到亚50 nm的水平。例如,用于纳米形貌的点累积成像(PAINT)技术及进一步发展的DNA-PAINT技术便是其中之一。该技术在样品制备过程中用荧光配体的随机结合代替了永久结合的荧光团的随机光活化。另一种通过样品制备提升分辨率的方法是样品膨胀显微术(ExM)。通过使用可鼓胀的聚合物网络放大样品,ExM允许研究人员识别其中的微小结构。除此之外,在仪器学发展方面,最小化荧光光子通量显微术(MINFLUX)是迄今最先进的用于精确定位荧光分子的方法。一般SMLM通过算法定位一幅图像中稀疏分布的荧光光斑的质心或最强点位置来实现单分子功能,而MINFLUX则通过激发光斑中央的暗斑来进行定位的。除此之外,人工智能技术的发展也为将衍射受限的输入图像转变为超分辨图像提供了另一种途径,或者显著降低了利用超分辨显微术进行活体细胞成像时的照明光剂量。
到目前为止,这些新兴技术的使用效果仅在单物镜架构的显微镜中得到了验证。值得注意的是,并不存在上述技术无法与4Pi架构兼容的障碍。如果类似的结合一旦成功,人们一样可以期待它们能够提供更高的三维分辨率或更好的信噪比之类的技术优势,就跟目前在isoSTED和4Pi-SMLM显微术中已经实现的一样。然而,主要挑战来自于系统复杂性的增加:4Pi架构除了需要针对这些新兴概念进行专门的额外系统优化外,还需要对大量并行参数进行细致的调整。如果处理不当,此类问题会严重影响系统性能。事实上,大多数4Pi显微镜或超分辨显微镜都只能在全球少数实验室中得到有效维护和使用。为了使更多的非光学专业人士能够使用4Pi显微镜,有必要进一步公开4Pi显微镜的设计图纸、软件、操作和样品制备方法,同时,应进一步简化现有4Pi显微镜的设计。令人欣喜的是,科学家已经在这方面取得了显著进展。例如,在isoSTED显微镜的初始设计中,需要两个独立的STED激光光束来分别生成STEDxy和STEDz聚焦光斑。显而易见,如果能够使用单一激光器作为STED光源,可以有效降低系统复杂度,提高成像过程中的稳定性。基于此,科学家提出了两种方案:一种是引入基于空间光调制器的双反射架构来分别编码激光光束中两个正交的偏振分量,从而同时实现STEDxy和STEDz聚焦光斑;另一种则是在光路中插入一个分段的、具有高度波长选择性的波片元件。两种设计都已实现并证明其可以有效地实现isoSTED成像。
考虑到4Pi显微镜中干涉腔的高度对称性,一种更为“激进”的策略是完全去除其中一个物镜,并使用一个反射镜取代通常用来托住样品的载玻片。这样的设计被称为镜面辅助分辨率提升技术(MEANS)。在MEANS显微镜中,入射光和反射光可以模拟常规4Pi显微镜中两束反向传播的光束,进而在镜面上产生局部干涉以限制PSF的轴向尺寸。虽然MEANS的初始设计仅能够在紧贴镜面的二维平面内提高轴向分辨率,但是其优越性在于,这种架构可能既可以用于目标开关超分辨显微术也可以用于随机开关超分辨显微术。总之,MEANS显微镜提供了一种用于提高单物镜系统轴向分辨率的一般性策略,因此,有望改造许多现有的单物镜系统,从而以一种虚拟的方式为更多实验室提供使用4Pi显微镜的可能。
由于各类不同的4Pi超分辨显微术已经实现,相关的理论体系亦已建立完备,下一阶段的研究重点将是如何使得相关技术以更好地解决实际的科学问题。不难理解,如果要发挥4Pi双对置物镜架构的最大效能,观察样品必须是完全透明的。为了在整个成像过程中保持稳定的干涉模式,4Pi显微镜对由样品折射率不均匀引起的像差很敏感。尽管已有少量关于4Pi显微镜被用于细胞学研究的报道,但是相关技术在厚样品的应用还几乎完全没有被研究,如生物组织方面。为了实现4Pi显微术在生物组织中的应用,需要解决样品像差问题。因此,必须首先建立一个用于描述像4Pi这类具有多个非连续圆形入瞳的显微镜像差的数学模型。同时,还需要在系统中引入自适应光学用于对样品像差的补偿。相关的理论已经启发了一些将4Pi显微术用于全细胞和组织切片样品成像的前瞻性工作。虽然致力于将4Pi显微术用于厚样品成像的研究工作已经开始,但其全部潜力还远未被发掘。在这个进程当中尤为关键的一步则是如何将4Pi显微术运用到活体样品成像中。
审核编辑:郭婷
-
二极管
+关注
关注
148文章
9859浏览量
168459 -
探测器
+关注
关注
14文章
2670浏览量
73523
原文标题:浙江大学郝翔等 | 4Pi 荧光超分辨显微术综述
文章出处:【微信号:信息与电子工程前沿FITEE,微信公众号:信息与电子工程前沿FITEE】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
荧光显微镜原理特点及使用
电子显微术(Electron Microscopy,EM)的分类以及基础知识
荧光显微镜
基于LabVIEW软件的显微荧光光谱成像系统设计
什么是NSOM(近场光学显微术)
什么是MFM,磁力显微术是什么意思
电子显微术(Electron Microscopy,EM)
场离子显微术(Field Ion Microscopy,FI
超分辨定位显微光学成像技术详述
超分辨显微镜3D成像模块的应用

用SPAD 23在共聚焦显微镜中实现波动对比度的超分辨率





 4Pi荧光超分辨显微术综述
4Pi荧光超分辨显微术综述










评论