神经系统功能的维持需要消耗大量的ATP。线粒体通过氧化磷酸化产生ATP,是神经元细胞能量的主要来源。由于神经元轴突高度特化的结构以及ATP在轴突中有限的扩散能力,轴突线粒体的稳态对于维持神经元轴突的能量代谢与功能至关重要。在成熟的中枢神经系统神经元中,轴突一旦受到急性损伤,轴突线粒体的功能与运输均出现异常,导致受损轴突局部面临能量缺失的压力,最终将导致轴突退化以及再生失败。受限于研究方法,在动物模型中很难对损伤后轴突中的线粒体动态以及能量代谢变化进行实时观察。2005年Taylor等人报道了利用微流控芯片分离神经元轴突的方法,为研究轴突损伤后线粒体稳态与能量代谢的分子调控机制提供了有力的研究工具。
近日,美国国立卫生研究院盛祖杭课题组在Cell Regeneration上发表了题为“Microfluidic devices as model platforms of CNS injury-ischemia to study axonal regeneration by regulating mitochondrial transport and bioenergetic metabolism”的方法论文章。该研究主要通过结合微流控芯片装置与活细胞动态观察技术,为研究中枢神经系统损伤后轴突内线粒体运输、能量代谢、蛋白质合成等细胞生物学事件提供了新的研究方法。

首先,研究人员参考Taylor等人的报道设计微流控芯片,并利用该装置将体外培养的中枢神经系统神经元的轴突与胞体和树突分离。随后,使用机械损伤、低糖低氧等方法模拟体内轴突损伤和脑卒中等急性应激,观察神经元轴突急性损伤后退化和再生的过程。与之前在动物模型中的研究一致,成熟的中枢神经系统神经元在受到急性损伤后出现明显的轴突退化、再生失败等表型。
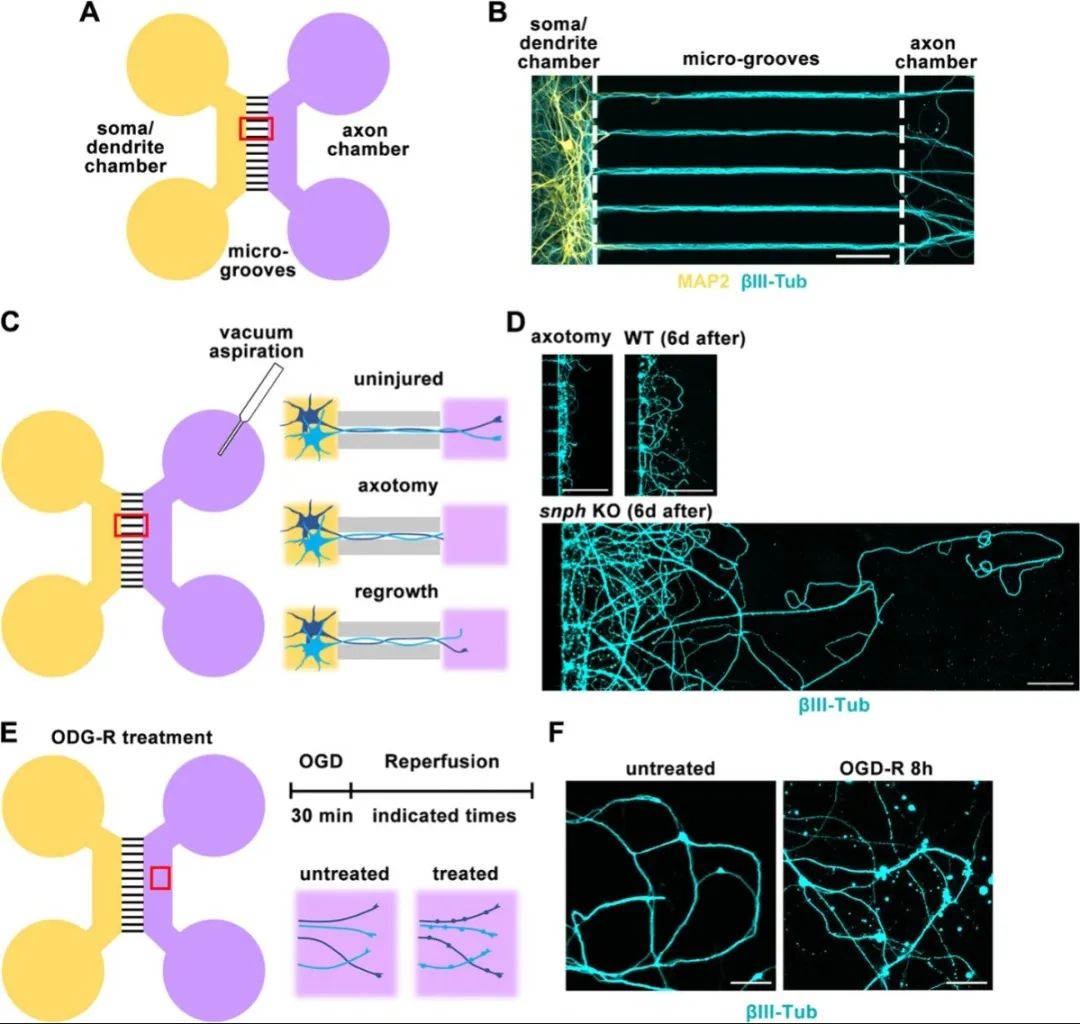
使用微流控芯片建立神经元损伤与低糖低氧模型
接着,使用荧光探针GO-ATeam2实时指示神经元中的ATP水平后发现,轴突损伤和低糖低氧状态下,轴浆、轴突末端、神经元胞体的ATP水平呈现出不同的变化趋势和应答时序。使用荧光蛋白标记轴突线粒体后发现,轴突损伤阻断轴突线粒体的双向运输,并且在损伤12小时后难于恢复;而低糖低氧刺激后,轴突线粒体的逆向运输相比于正向运输表现出明显的回复趋势,暗示着神经元在两种应激之间不同的分子应答机制。
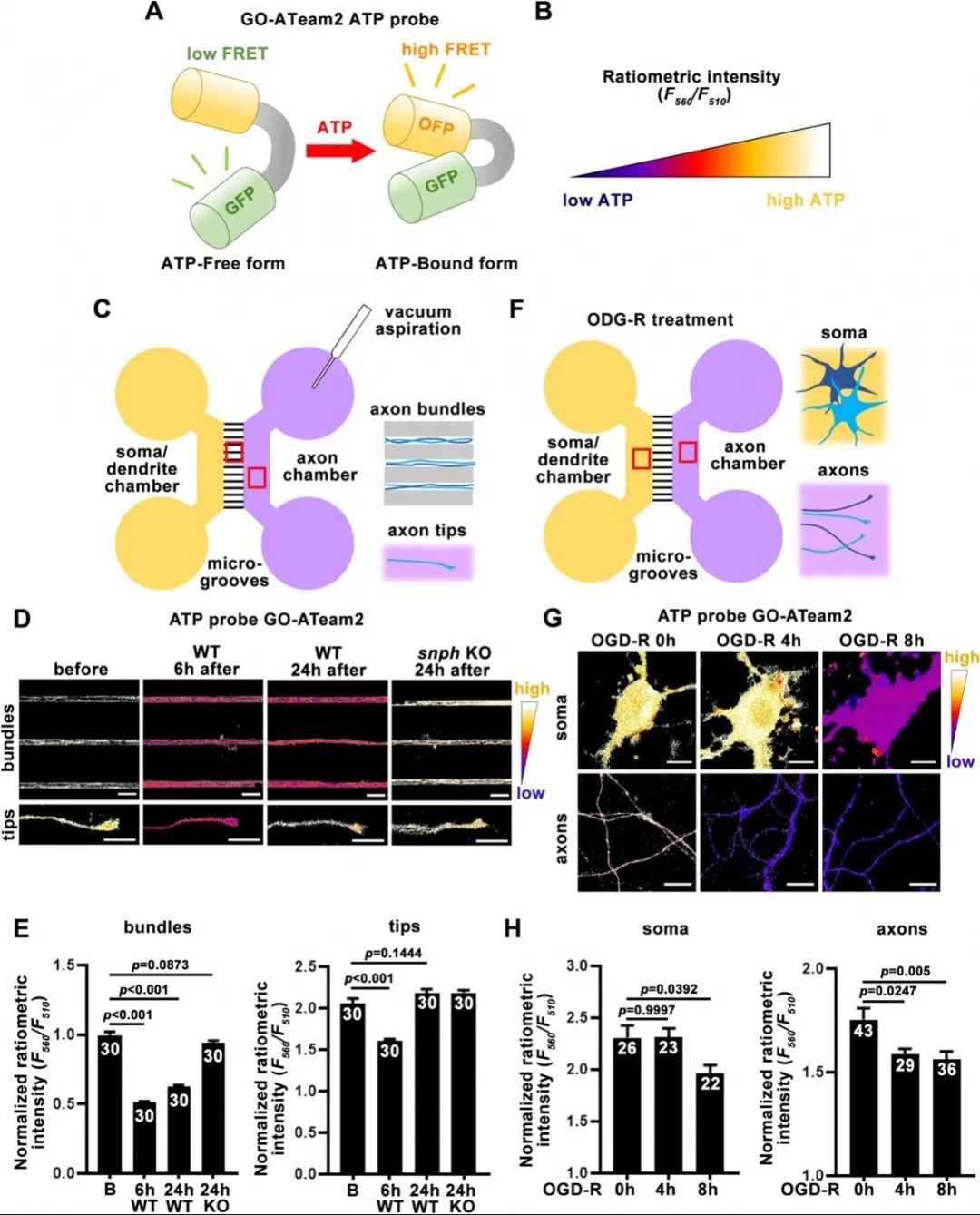
使用ATP探针Go-ATeam2检测神经元不同损伤后能量代谢的动态变化
最后,利用嘌呤霉素-近端标记技术对轴突中特异蛋白的合成进行了原位检测。结果显示在低氧低糖状态下,线粒体激酶PAK5在轴突中的蛋白合成水平明显增高,8小时后逐渐恢复,而线粒体蛋白Miro-1在轴突中的蛋白合成水平没有显著变化。
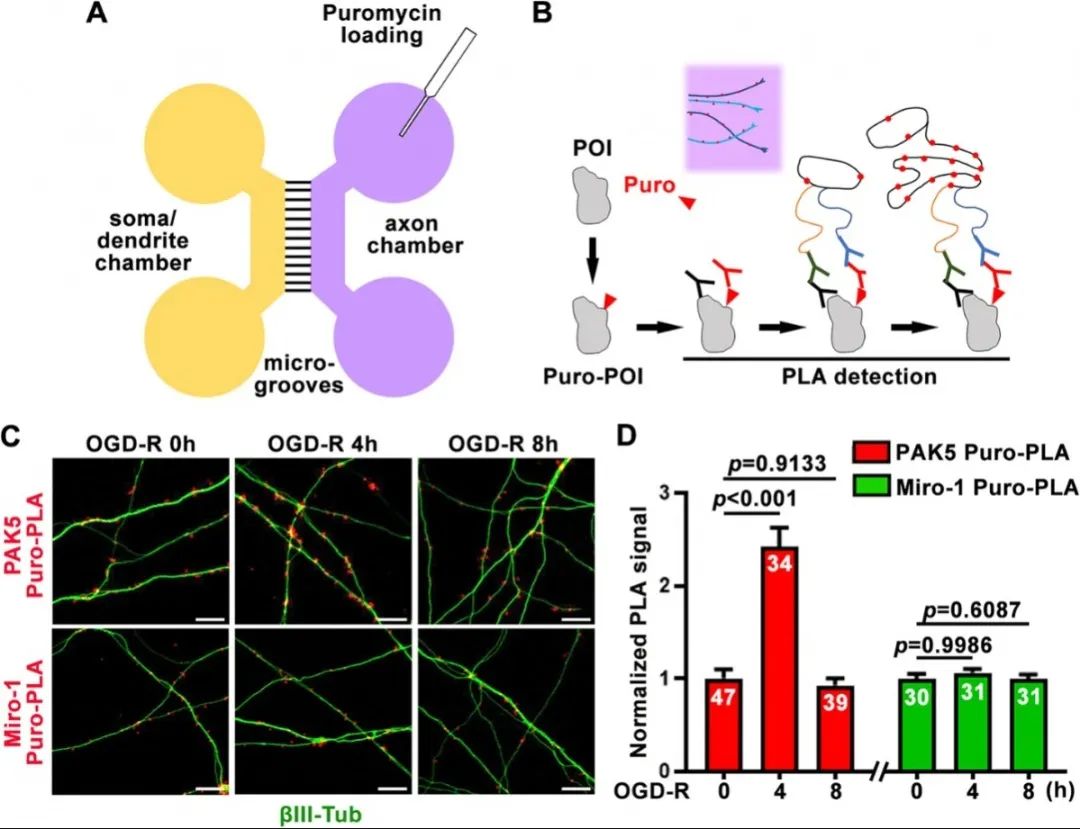
使用Puro-PLA技术原位监测神经元损伤后轴突中蛋白合成的动态变化
综上所述,与中枢神经系统的体内损伤模型相比,借助微流控芯片装置建立的体外损伤模型易于实现、重复性高,并且可以结合活细胞成像实时观察受损神经元中的动态变化。通过高内涵成像技术,损伤轴突中的线粒体运输以及能量代谢可以作为神经损伤修复相关药物筛选的重要指标。
审核编辑:郭婷
-
芯片
+关注
关注
457文章
51345浏览量
428254
原文标题:微流控芯片+活细胞成像,用于神经元轴突损伤机制研究
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
活细胞的“聚光灯”——前沿活细胞成像的案例分享





 微流控芯片装置与活细胞动态观察技术用于神经元轴突损伤机制研究
微流控芯片装置与活细胞动态观察技术用于神经元轴突损伤机制研究










评论