高通量筛选技术已经成为合成生物学等领域中突变体酶、突变体菌株筛选过程中不可或缺的技术,其应用前景广阔。目前,高通量筛选方法所需仪器主要依赖流式细胞仪、液滴微流控等,这些技术可以实现突变体库的超高通量筛选。但是,目前对于很多待分析物,仍缺乏直接的高通量筛选方法。
据麦姆斯咨询报道,为解决上述难题,近日,Biosensors and Bioelectronics在线发表了江南大学未来食品科学中心和生物工程学院陈坚院士团队刘龙教授课题组的研究成果“Directed evolution of diacetylchitobiose deacetylase via high-throughput droplet sorting with a novel, bacteria-based biosensor” 。该研究首先构建了一种响应氨基葡萄糖(GlcN)浓度的生物传感器;接着,将其与液滴微流控高通量筛选技术结合构建GlcN的高通量筛选方法。并且,以产生GlcN的关键酶—己丁二糖脱乙酰酶(Dac)突变体库的筛选为例,对所构建的筛选方法进行了验证,实现了液滴内Dac酶活性的高通量检测,显著提升了Dac的酶活性(图1)。
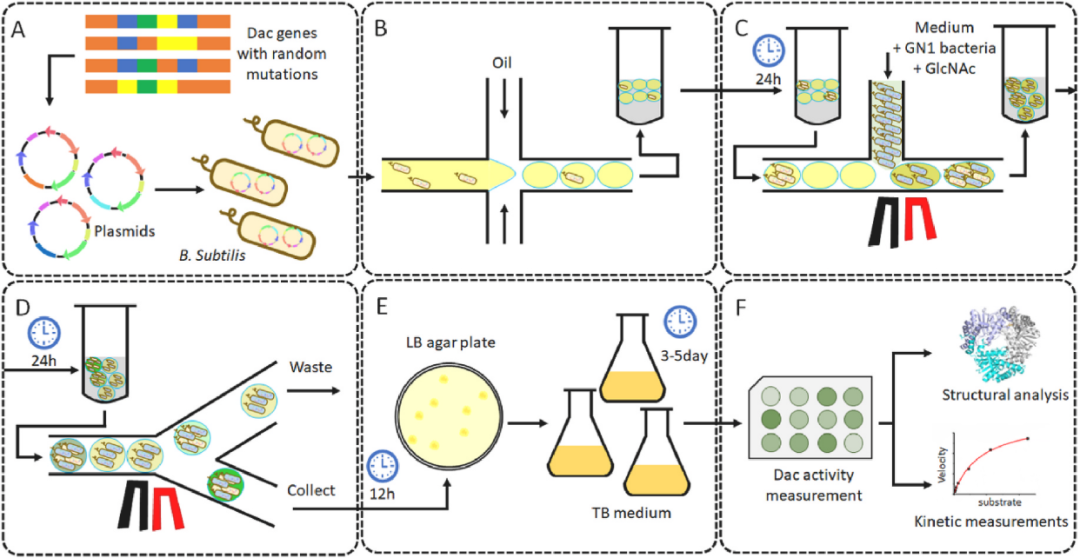
图1 结合生物传感器与液滴微流控筛选Dac突变体酶示意图
构建响应氨基葡萄糖的生物传感器
该研究设计构建了一种可以响应GlcN浓度的生物传感器,该生物传感器可以将GlcN的浓度转化为绿色荧光信号,其荧光表达强度与GlcN浓度正相关,进一步可以指示关键酶Dac的酶活水平。
首先,在孔板体培养系中,通过添加不同浓度的GlcN,验证了检测菌GN1(包含有生物传感器)对GlcN的响应情况,证实了其可在适当范围内(0-1.5g/L)线性响应GlcN的浓度,且不会被底物乙酰氨基葡萄糖(GlcNAc)干扰。并且,利用表达不同Dac突变体(酶活性不同)的菌株(M0-无酶活、M1-低酶活、M2-高酶活)模拟了突变体酶的筛选过程。结果表明,含有传感器的检测菌株,可以通过荧光表达强度的高低,区分出酶活性的高低,证实了所构建的筛选方法在实际的突变体库筛选过程中的可行性。
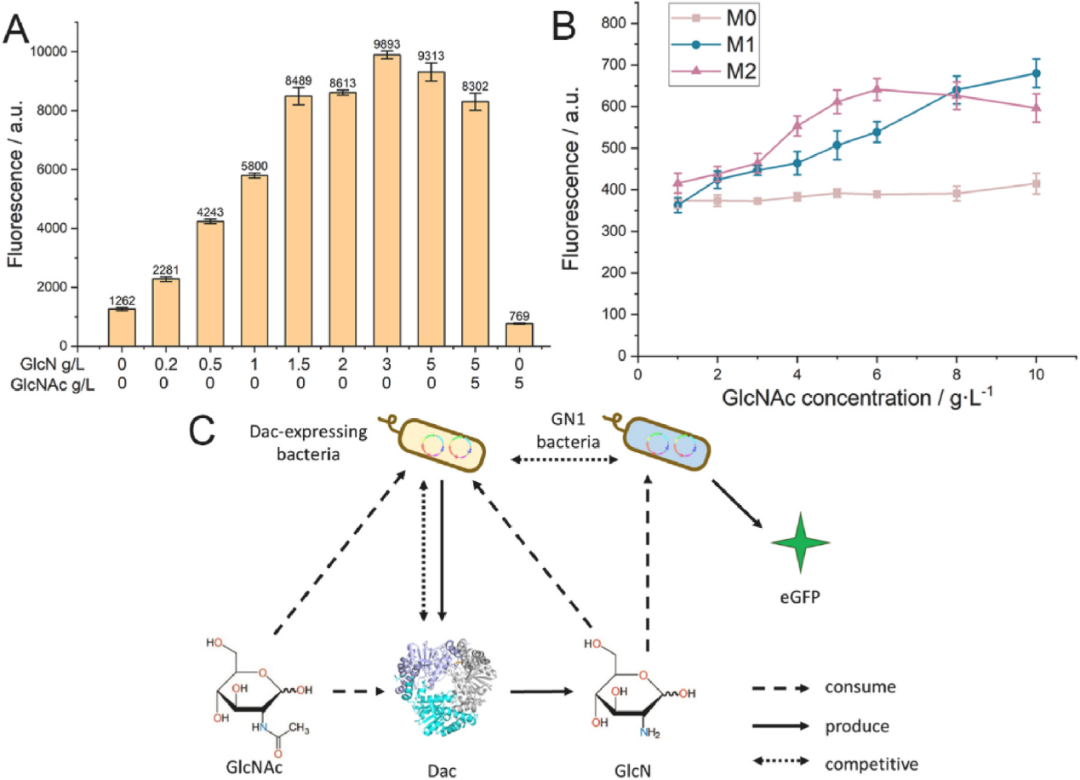
图2 孔板体系中生物传感器对GlcN浓度、Dac酶活性的响应情况
液滴体系下传感器的验证
孔板中验证了筛选方法的可行性后,进行下一步的液滴分选实验。按照1:1的比例,将表达Dac的菌株与含有生物传感器的检测菌株GN1混合培养,接着进行液滴分选。图3A显示了各种液滴的平均荧光强度,荧光强度与GlcN的浓度呈正相关。为了验证Dac在液滴中能否正常表达、发挥活性,分别将表达Dac突变体M0、M1和M2的菌株封装在液滴中,孵育24小时,并加入GN1检测菌株和底物GlcNAc,进行荧光信号的表征。如图3B所示,菌株M0、M1和M2的荧光信号分别为886.9 ± 79.4、1396.7 ± 133.0和1820.5 ± 192.9。结果表明,所构建的GlcN生物传感器同样也适用于Dac突变体的高通量液滴分选。
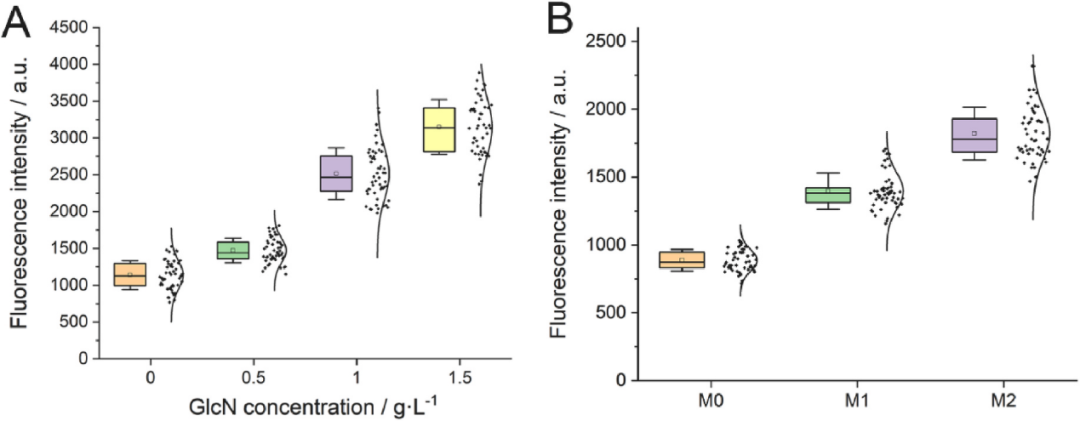
图3 液滴体系中生物传感器对GlcN浓度、Dac酶活性的响应情况
关键酶Dac的定向进化
首先通过易错PCR技术,构建关键酶Dac的突变体文库。随后,利用建立的高通量筛选方法,对含有不同Dac突变体的菌株库进行筛选,共筛选了约20万个突变体;经复筛验证,得到了最佳的突变体M7,其酶活由突变前的27.2 ± 1.8U/mL(M2)提升至48.6 ± 1.5U/mL(图4)。
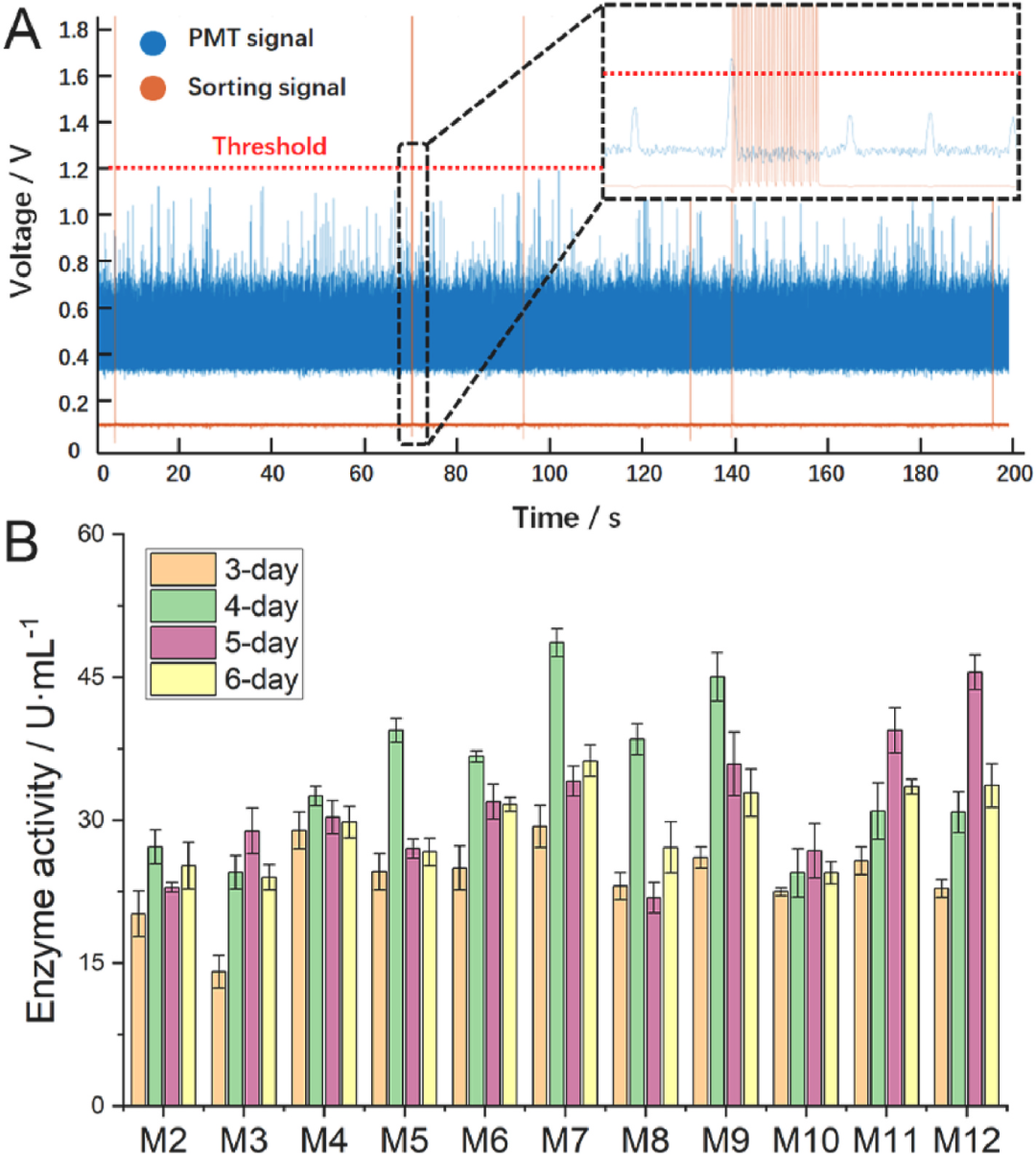
图4 筛选阈值设定与酶活水平检测
突变体的表征
通过测定M2和M7的动力学常数Km和Vmax。如图5A和B所示,M7的Vmax(755.9 ± 24.0μm/s)是M2(368.8 ± 19.2μm/s)的两倍,这与M7酶活性增强的结果一致。根据突变位点分析,M7在M2(R157T)的基础上增加了S60I和F168S突变点,进一步提升了酶活。
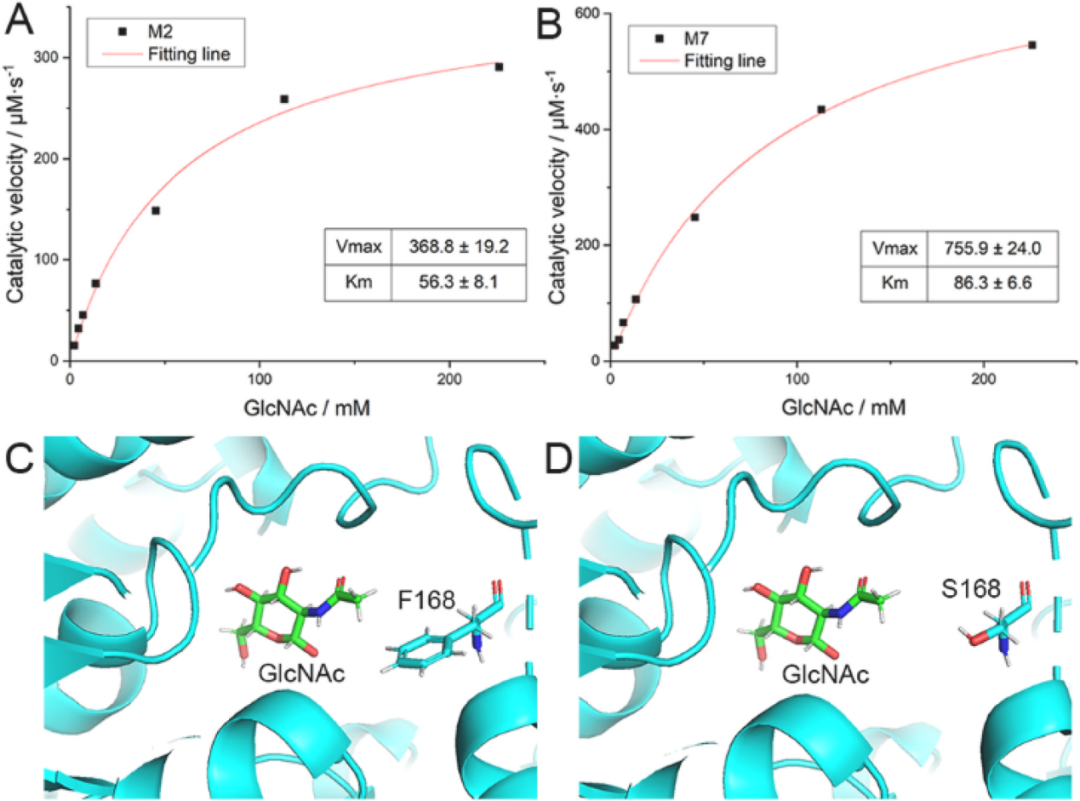
图5 最佳Dac突变M7与突变前(M2)的比较
综上所述,该研究开发了一种新型生物传感器,将GlcN浓度与绿色荧光信号相关联,并将其应用于GlcN合成关键酶Dac的定向进化。结合高通量液滴分选系统,成功获得了酶活比原始突变体提高了1.8倍的Dac突变体。生物传感器与高通量液滴分选系统在Dac定向进化方面的成功应用,进一步助力了氨基葡萄糖的工业化生产。
论文链接:
https://pubmed.ncbi.nlm.nih.gov/36327560/
审核编辑 :李倩
-
传感器
+关注
关注
2551文章
51091浏览量
753487 -
生物传感器
+关注
关注
12文章
369浏览量
37376
原文标题:基于新型细菌生物传感器的高通量液滴分选,实现Dac酶定向进化
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
沈阳农业大学:研究一种基于硼酸二醇识别的原位和体内检测糖的新型电化学传感器
宁波大学:通过电热薄膜刺激汗液分泌的可穿戴生物传感器,用于静息状态下汗液葡萄糖持续分析
生物传感器:科技前沿的生物监测利器
高可调性材料:Haydale生物传感器油墨,打造灵活定制化印刷解决方案
从糖尿病管理到环境监测:葡萄糖传感器的多元应用探索
微针葡萄糖传感器贴片 可至皮肤深层持续监测
MIT/三星研究人员利用活体拉曼光谱直接观察葡萄糖指纹图谱

Aigtek功率放大器如何帮助纳米电子生物传感器更好的研发和生产
电化学生物传感器在生物检测领域的显著优势
三郡科技:电化学生物传感器电极与生物芯片的异同
便携快速检测的电化学生物传感器:颠覆性变革生物检测方式
科普|生物传感器
气体传感器有哪些种类 气体传感器的原理与应用





 一种响应氨基葡萄糖(GlcN)浓度的生物传感器
一种响应氨基葡萄糖(GlcN)浓度的生物传感器










评论