由新冠病毒(SARS-CoV-2)引起的新冠肺炎(COVID-19)已在全球迅速蔓延,世界正承受着相当大的健康、社会和经济负担。因此,快速准确地识别和监测SARS-CoV-2感染对于预防疾病传播和最终挽救生命至关重要。由于具有同时切割靶向核酸和非靶向核酸(用作报告分子)并输出信号的特性,CRISPR-Cas系统近期开始被应用在核酸检测中,在新型生物传感器构建中表现出了巨大的潜力。同时,电化学分析方法具有的高灵敏度、快速响应和成本效益优势使电化学生物传感器成为医学诊断中强大的分析工具。
据麦姆斯咨询报道,近期,深圳大学光电工程学院研究人员于Nano-Micro Letters期刊发表题为“CRISPR-Cas12a-Empowered Electrochemical Biosensor for Rapid and Ultrasensitive Detection of SARS-CoV-2 Delta Variant”的研究论文。该研究开发了一种基于CRISPR-Cas系统的新型电化学生物传感器,用于检测SARS-CoV-2德尔塔(Delta)变异株。
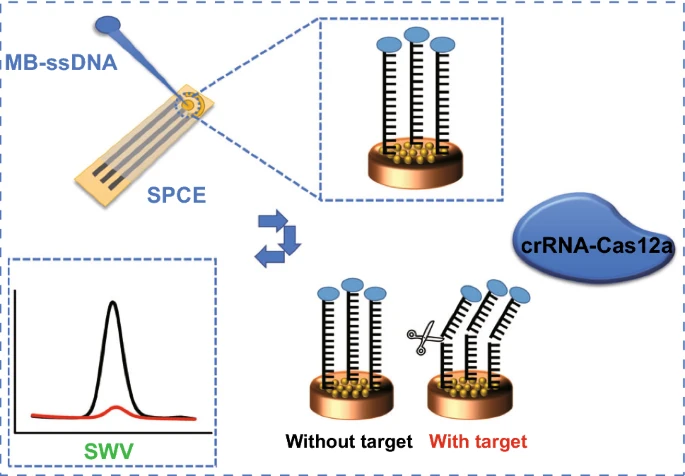
为了增强传感性能,工作电极(AuE)使用电沉积高质量金纳米颗粒修饰得到AuE-AuNPs,以增加导电性和活性比表面积。然后用亚甲蓝单链DNA(MB-ssDNA)修饰AuE-AuNPs。为了稳定的电化学信号和长时间存储,选择了Cas12a蛋白来制造生物传感器。当生物传感器被Cas12a-crRNA-靶标DNA混合溶液处理时,在特异性识别靶标DNA的作用下,Cas12a的反式切割活性激活,MB-ssDNA将从电极表面被切割。因此,AuE-AuNPs和ssDNA上的氧化还原介体(MB)之间的电子转移在切割前后发生了变化,而这种变化可以通过电化学转导和检测。研究分别通过生物学和电化学策略检验了该传感器的可行性,并继续传感器的检测限(LOD)、特异性、稳定性以及在即时检测(POCT)中的性能和应用潜力。
金纳米颗粒辅助CRISPR电化学生物传感器的原理
首先将MB-ssDNA报告基因固定于修饰电极表面。基于靶标的前间区序列邻近基序(PAM)以及靶DNA与crRNA的互补性,设计了导向Cas12a/crRNA双链体,以特异性识别SARS-COV-2的靶标DNA。在没有目标DNA的情况下,Cas12a-crRNA的切割活性未被激活,MB-ssDNA报告分子保留在修饰电极表面,从而产生了明显的MB电化学信号。在靶标DNA存在的情况下,Cas蛋白识别PAM序列,Cas12a的反式切割活性被激活,因此MB-ssDNA报告基因被从电极表面非特异性切割,导致MB的电化学信号降低。得益于金纳米颗粒的大比表面积,可以将目标识别事件转化为电极上ssDNA报告基因的大量切割,用于设计高灵敏度的电化学核酸生物传感器。
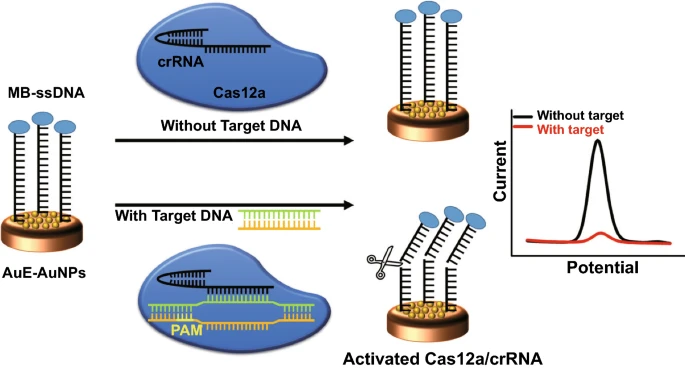
图1 金纳米颗粒辅助CRISPR电化学生物传感器的原理示意图。CRISPR电化学生物传感器的生物可行性探究为了检验基于CRISPR-Cas12a的电化学生物传感器用于核酸检测的可行性,在设备上检测之前进行了验证实验。如图2A所示,设计了不同的目标模板并将其插入pUC57质粒中。使用琼脂糖凝胶电泳确认顺式和反式切割。如图2B所示,观察到完整dsDNA模板的条带(表示为“T”)。在图2C中,只有Delta变体的DNA模板与CRISPR系统发生反应并观察到强荧光。此外,FAM-ssDNA-BHQ探针被用作Cas12a的报告基因,用于荧光检测具有不同浓度(从100fM到10nM)的目标Delta DNA,计算检测下限约为100pM(图 2D)。
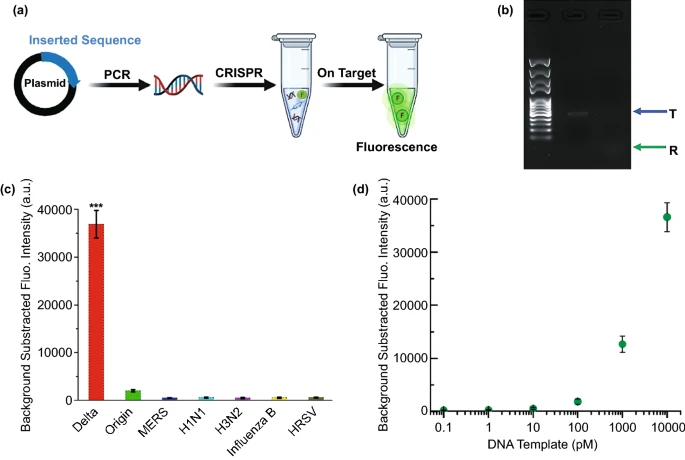
图2 (A)CRISPR反应示意图;(B)通过琼脂糖凝胶电泳验证反式和顺式切割;(C)crRNA的特异性;(D)荧光浓度结果,灰线表示检测限。CRISPR电化学生物传感器的电化学可行性探究首先对生物传感器不同阶段的电化学阻抗谱(EIS)进行了验证,如图3A所示,AuE-AuNPs具有优异的电化学电导率(黑色曲线)。在将MB-ssDNA固定在AuE-AuNPs上后,Ret值显著增加至4795Ω(红色曲线),在用Cas12a-crRNA-靶DNA混合溶液处理后,由于Cas12a的活化切割活性,大部分MB-ssDNA已被切割并与AuE-AuNPs分离导致Ret在蓝色曲线中大幅下降(约1612Ω)。SWV如图3B所示,当生物传感器用Cas12a-crRNA混合溶液处理没有靶DNA时,在-0.27有明显的MB的氧化还原峰(黑色曲线);当生物传感器用Cas12a-crRNA与靶DNA一起处理时,MB的氧化还原峰显著降低(红色曲线),这进一步证实了MB-ssDNA的成功切割和MB在生物传感器表面的释放。图3C显示了MB的氧化还原峰的SWV,靶DNA浓度范围为100fM至10nM,其中随着靶DNA浓度的增加,电流逐渐减小。在图4中,电流变化(ΔI%)与目标 DNA浓度的对数得到的回归方程为:ΔI% = 14.37lgC + 192.67,R²和LOD分别计算为0.987和50fM。
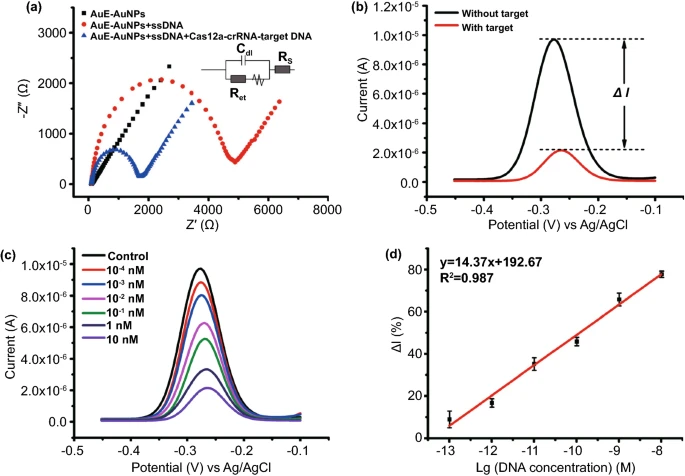
图3 (A)电化学阻抗谱(EIS)表征;(B)方波伏安(SWV)曲线;(C)不同浓度靶DNA的SWV曲线;(D)电流变化(ΔI%)与目标DNA浓度的对数之间的线性关系。
CRISPR电化学生物传感器的特异性探究
如图4所示,当靶标DNA被来自原始SARS-CoV-2病毒的核酸取代时,观察到明显降低的ΔI%(16.1%),这证实了crRNA靶向Delta变体的特异性。此外,MERS、H₁N₁、H₃N₂、B型流感和HRSV均表现出不明显的信号变化(ΔI% < 10%),而仅来自Delta变体的靶标DNA表现出显著的电化学响应(ΔI% = 77.9%)。该实验结果表明建立的电化学生物传感器能够以高特异性检测SARS-COV-2 Delta变体。
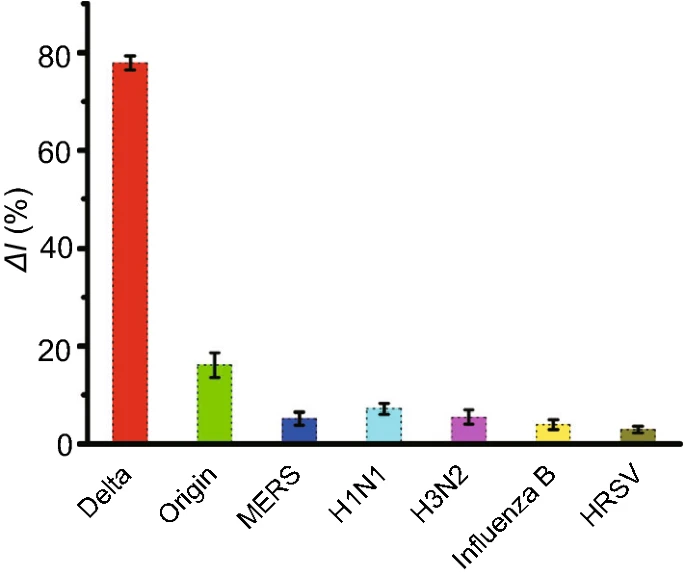
图4 AuNPs辅助E-CRISPR对SARS-COV-2 Delta变体的特异性分析。根据SWV电流计算信号变化,分别添加目标DNA(10nM)和非目标病毒(10nM)。
CRISPR电化学生物传感器的即时检测应用探究
微型电化学工作站由智能手机连接直接控制,实验数据可通过蓝牙及时传输。迄今为止,丝网印刷技术对于SPE的制备已经成熟,因此SPE成本非常低。POCT检测中靶标DNA的浓度选择为10nM,以证明POCT微电化学工作站检测SARS-COV-2变异株的可行性。如图5所示,从SWV曲线得到的MB的氧化还原峰电流分别为933.05nA(不含靶标DNA)和280.11nA(含靶标DNA),ΔI%计算为69.97%,与从传统电化学工作站获得的相应ΔI%相比仅10%的差异。显然,MoECS结合微型电化学平台可用于POCT进行快速SARS-CoV-2 Delta变体的诊断,无需繁琐的样品处理。
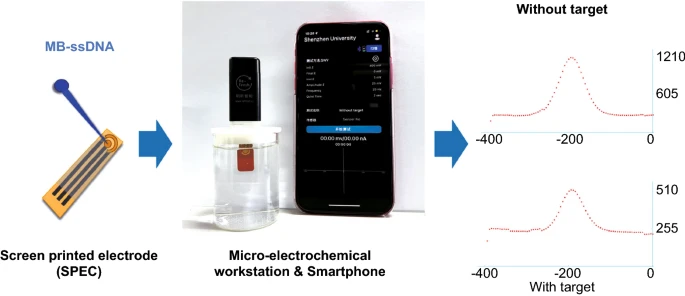
图5 传感器在POCT中用于SARS-CoV-2 Delta变异检测的示意图、初步分析照片和实验结果。
论文链接: https://doi.org/10.1007/s40820-022-00888-4
审核编辑 :李倩
-
电化学
+关注
关注
1文章
315浏览量
20565 -
生物传感器
+关注
关注
12文章
366浏览量
37327
原文标题:新型电化学生物传感器,用于快速和超灵敏检测新冠病毒德尔塔变异株
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
生物传感器:科技前沿的生物监测利器
电化学气体传感器信号放大调试经验
热烈祝贺三郡科技电化学生物传感电极芯片扩产能三亿支
关于电化学储能的BMS可行性方案
电化学生物传感器在生物检测领域的显著优势
便携快速检测的电化学生物传感器:颠覆性变革生物检测方式
用于原位监测汗液标志物的全打印、多模态可穿戴生物传感器阵列
科普|生物传感器
深度解析ADuCM355+LTC6078 电化学测量系统





 基于CRISPR-Cas系统的新型电化学生物传感器
基于CRISPR-Cas系统的新型电化学生物传感器










评论