一直以来,病原体快速和多重检测都是全球卫生安全领域关注的重点方向。在现有检测方法中,二代测序(NGS)可提供病原体详细信息,但检测时间久且成本高;PCR技术可以实现病原体多重检测,但荧光探针发射光谱经常重叠,且易混淆识别目标,使单次可检病原体数量受限;而当前被广泛使用的、基于CRISPR技术所研发的高特异和高灵敏分子诊断方法(CRISPR-Dx)也存在多重检测受限和高成本等问题。
基于以上挑战,中国科学院精密测量院杨运煌团队展开研究,于近期在Nature Communications上发表了题为“Microfluidic space coding for multiplexed nucleic acid detection via CRISPR-Cas12a and recombinase polymerase amplification”的文章,提出一种名为“MiCaR”的高性能多靶标检测平台。

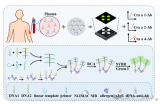
“MiCaR”平台检测原理
“MiCaR”多靶标核酸检测技术基于微流控空间编码和CRISPR-Dx技术,可在40分钟内检测30种不同的病原体,灵敏度达到了0.26 aM。“MiCaR”检测平台特点可总结为:(1)有效且正确扩增多个(如 ≥ 4个)核酸靶点;(2)在合适的温度下扩增和识别靶标;(3)精确识别靶标,不受任何干扰;(4)准确区分信号并将其与对应靶标进行关联。研究人员通过有效地检测9价HPV疫苗对应的9种HPV亚型,证明了“MiCaR”的实用性以及其在感染性疾病诊断和流行病学监测方面的潜力和应用价值。
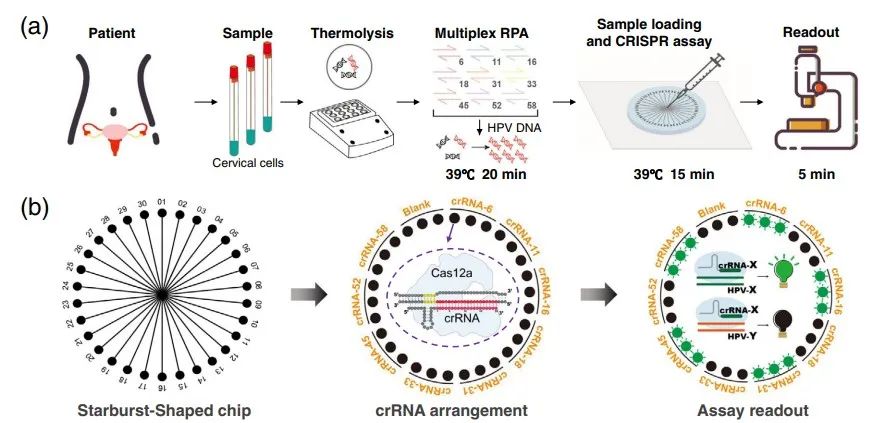
“MiCaR”平台HPV检测流程
研究人员以HPV亚型检测为例,演示了“MiCaR”平台的使用流程。首先进行取样,加热样本释放核酸,将释放的核酸直接进行重组酶聚合酶扩增(RPA),最后将扩增产物和CRISPR检测液加入到放射状芯片(SS-Chip)中,加热后读取结果。其中SS-Chip由30个孔位轮状辐射分布并与中央孔位相连,CRISPR检测液提前加入30个孔位,样本从中央孔位加载,每个孔位都能独立进行CRISPR检测。
“MiCaR”平台对九种HPV亚型检测
为验证“MiCaR”平台对九价疫苗里9种HPV病毒亚型检测能力,该研究将含有9种HPV亚型各自特定片段的质粒和9种crRNA进行交叉反应,结果显示其检测特异性高(如下图所示);制备9种不同浓度的HPV亚型靶标质粒(10⁻¹² M、10⁻¹³ M、10⁻¹⁴ M、10⁻¹⁵ M、10⁻¹⁶ M、10⁻¹⁷ M、10⁻¹⁸ M、0 M)验证其灵敏度,结果显示对所有靶标检测限达10⁻¹⁷ M至10⁻¹⁸ M。
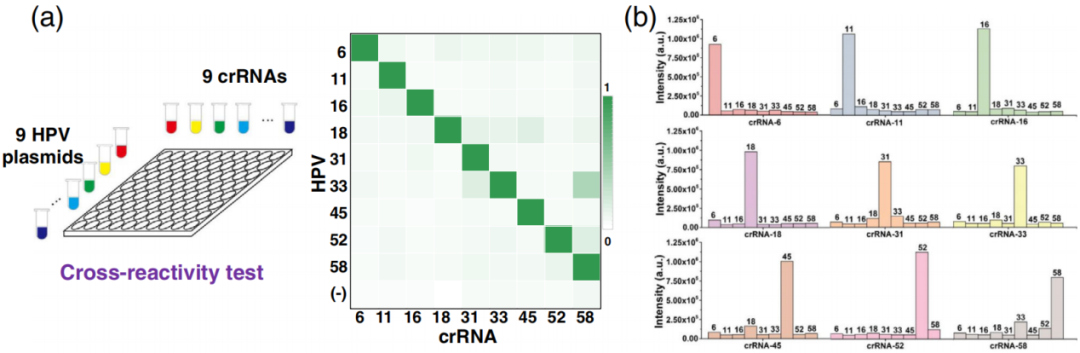
9种HPV质粒和9种crRNA交叉实验
进一步对100例HPV临床样本分型检测,结果显示“MiCaR”检测性能良好,阳性和阴性预测一致性分别为97.8%和98.1%,灵敏度和特异性分别为97.8%和98.1%。
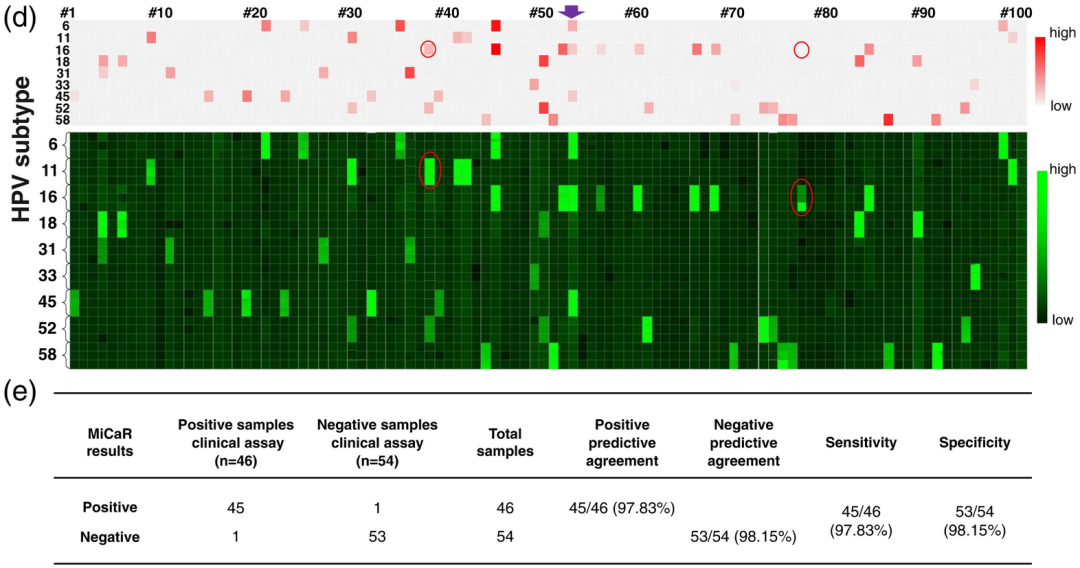
HPV临床检测(红色)和“MiCaR”检测(绿色)结果比对
对八种呼吸道病毒检测板(RVP)进行检测
研究基于“MiCaR”的方法检测8种最具临床相关性的呼吸道病毒,包括B型流感病毒(FLUBV)、人冠状病毒NL63(HCoV-NL63)、人冠状病毒OC43(HCoV-OC43)、人呼吸道合胞病毒(HRSV)、人冠状病毒HKU1(HCoV-HKU1)、SARS-CoV-2、人副流感病毒3型(HPIV-3)和人偏肺病毒(HMPV),通过对8种RVP靶标质粒与8种crRNA进行交叉反应实验,和对8种RVP靶标混合质粒与8种crRNA分别进行CRISPR检测,结果均表明“MiCaR”对RVP靶标检测强特异性,进一步证明“MiCaR”方法可以作为一种多病原体核酸检测的通用平台。
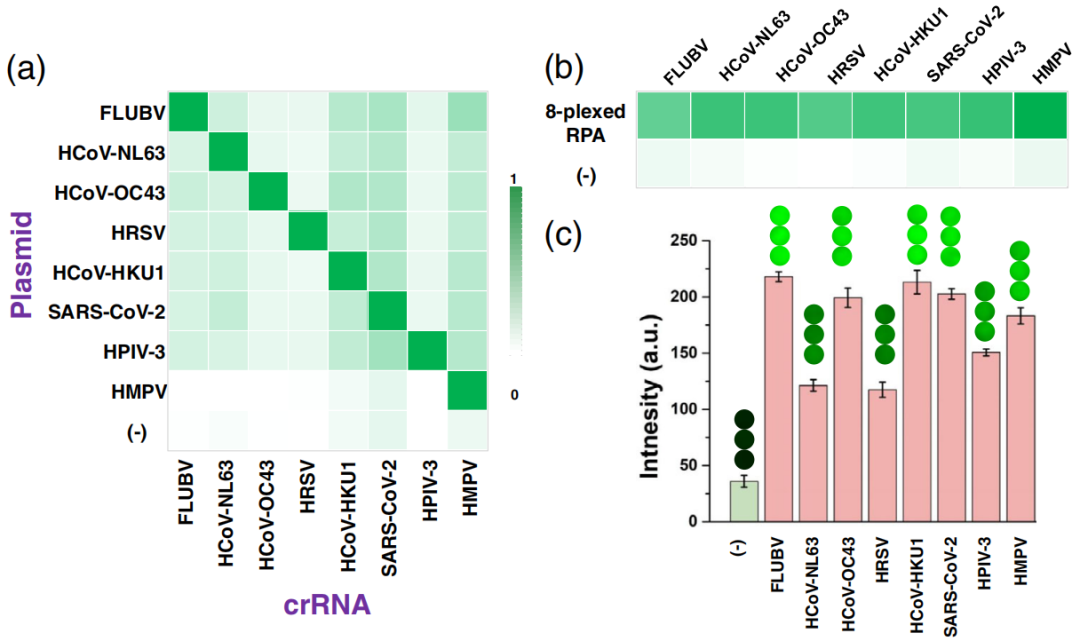
8种RVP靶标检测特异性结果
该研究团队表示,“MiCaR”充分展现了多重RPA的扩增、CRISPR/Cas12a系统在靶标识别方面的高特异性,以及微流控装置在液体处理方面的显著作用。该研究虽然只通过9种HPV亚型和8种呼吸道病毒验证“MiCaR”检测平台的通用性,但其单次检测靶标数量可达30个。团队将继续优化“MiCaR”扩增和检测条件及微流控装置,以实现一管法和自动化操作。
原文链接:
https://doi.org/10.1038/s41467-022-34086-y
审核编辑:刘清
-
微流控芯片
+关注
关注
13文章
270浏览量
18829
原文标题:基于微流控空间编码和CRISPR-Dx的多靶标核酸检测技术
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
高通任命新首席技术官
0.3s高灵敏NTC温度传感器用于消费电子
低电平灵敏专用仪器的技术原理和应用场景
安泰功率放大器应用领域:微流控技术和分子结合的体外诊断研究
闪光科技高灵敏超快成像及燃烧诊断技术交流会在西北工业大学成功举办

用于单分子无标记定量检测的数字胶体增强拉曼光谱技术

电缆隧道红外测温装置:红外技术测温|测温快、准确高、灵敏高
高光谱成像技术原理及其优势

电感耦合等离子体质谱+DNA纳米机器人用于HPV病毒的高效检测
如何使用高光谱成像技术进行作物健康监测?






 基于CRISPR技术的高特异和高灵敏分子诊断方法CRISPR-Dx
基于CRISPR技术的高特异和高灵敏分子诊断方法CRISPR-Dx











评论