01、导读
锂氧电池(LOB)的理论能量密度高达3500 wh·kg-1,被认为是下一代储能系统强有力的竞争者。作为一种开放式电池系统,LOB在实际应用面临着诸多棘手问题:氧还原反应/析氧反应 (ORR/OER) 缓慢,可逆性较差,超氧化物(如Li2O2)导致副反应的发生,锂负极容易被腐蚀。
究其根本,“罪魁祸首”是Li2O2在正极表面的不均匀沉积。它的沉积堵塞了正极孔结构,阻碍了电子和Li+快速、均匀传输,在ORR过程中很难完全分解,使得反应动力学和电化学性能显著下降。
为了解决这一问题,有的研究者采用氧化还原调控剂,同时提高正负极反应动力学,导致了更多副反应的发生,使问题复杂化。
02、成果背景
为了简便有效的解决LOB中Li2O2带来的诸多问题,松山湖材料实验室王欣、厦门大学/嘉庚创新实验室乔羽、厦门大学孙世刚团队合成了一种多功能的电解液添加剂,聚(2,2,2-三氟甲基丙烯酸乙酯,PTFEMA),只需加入0.02wt%,LOB的长期循环性能就可提高8倍。PTFEMA与Li+发生了溶剂化,使其在正负极上的通量更均匀,实现了Li2O2在正极表面的均匀沉积,并且在OER过程中可以完全分解,PTFEMA还能保护锂负极免受O2、超氧化物及其副产品穿梭带来的腐蚀。这一研究成果为解决LOB中Li2O2问题提供了一种简便有效的方法。相关工作以“Enhancing the Reaction Kinetics and Reversibility of Li–O2Batteries by Multifunctional Polymer Additive”为题发表在AdvancedEnergy Materials上。
03、关键创新
研究者设计了一种多功能的电解液添加剂PTFEMA,通过与Li+的溶剂化效应,使Li+在电极上的流动更均匀,解决了Li2O2给LOB带来的不利影响,只需加入0.02wt%,电池的循环稳定性就提高了8倍。
04、核心内容解读
1、稳定的PTFEMA
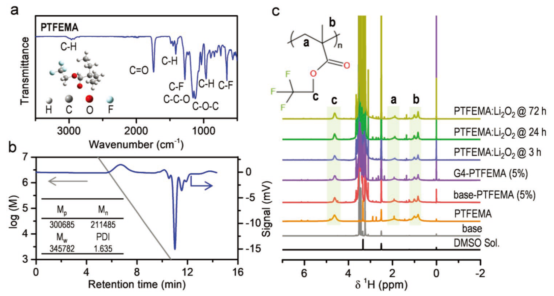
图1.PTFEMA的表结构征。(a)红外光谱;(b)GPC谱图;(c)1H-NMR和对Li2O2的稳定性。@Wiley
研究者通过自由基聚合,在二甲基甲酰胺中进行了甲基丙烯酸三氟乙酯的聚合,得到了PTFEMA,利用FTIR和1H-NMR对其结构进行了表征。
图1a中,3000-2850和1745 cm-1为C-H和C=O吸收峰,1280、654和740 cm-1是-CF3伸缩、弯曲和摇摆振动特征峰。凝胶渗透色谱(GPC)表明,PTFEMA的重均分子量(Mw)为3.4×105g·mol-1,数均分子量(Mn)为2.1×105g·mol-1,多分散性指数(PDI)为1.6 (图1b)。在1H-NMR中,4.8-4.3、2.2-1.3和1.3-0.7ppm的化学位移表示O-CH2、-CH2和-CH3(图1c)。他们又在PTFEMA的溶液中加入5 wt%的Li2O2,结果其特征峰没有变化,表明PTFEMA分子稳定性好,没有遭受Li2O2的亲核进攻。
2、PTFEMA的神奇功效
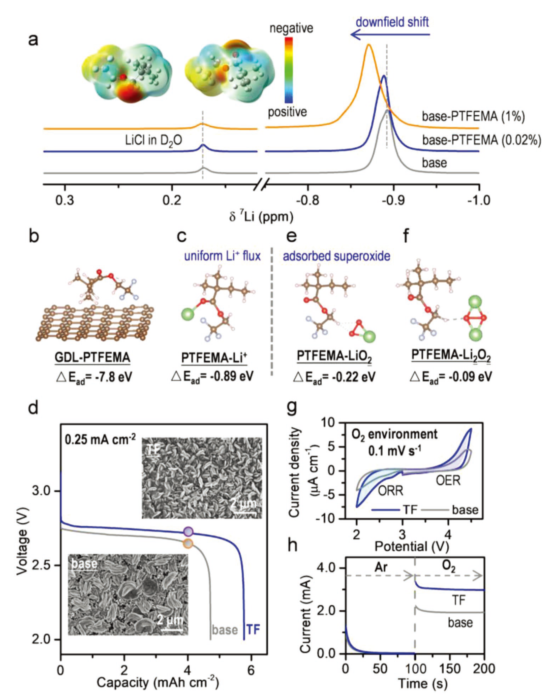
图2.在有/无PTFEMA的LOB电池中的ORR性能。(a)含PTFEMA(0.02和1wt%)电解质的7Li-NMR谱图;(b)正极气体扩散层(GDL)-PTFEMA和(c)PTFEMA-Li+络合物的优化结构和吸附能;(d)LOB有(蓝色)/无(灰色)PTFEMA情况下的全放电曲线(截止电压2.0 V,电流密度0.25 mA·cm-2);(e)PTFEMA-LiO2和(f)PTFEMA-Li2O2络合物的优化结构和吸附能;(g)在O2气氛,0.1 mV·s-1的扫描速率下,有/无PTFEMA的循环伏安曲线;(h)从Ar到O2气氛,在2.2 V(VsLi+/Li)下有/无PTFEMA的恒定切换电位实验。@Wiley
为了确定PTFEMA中原子的电荷密度分布,研究者用密度泛函理论(DFT)计算了它的表面静电势(ESP),发现负电荷几乎集中在PTFEMA的C=O官能团的O原子上,其次是C-O基团的O原子和C-F基团的F原子上,这有利于缺电子Li+的配位(图2a)。随后,他们又计算了PTFEMA与Li+之间的相互作用,发现正极气体扩散层(GDL)-PTFEMA的吸附能(∆Ead)为−7.8 eV,表现出强吸附作用。溶解在电解液中的PTFEMA可以均匀吸附在GDL上,分子中的负电荷中心吸引了Li+,促进了Li+的均匀分布(图2b)。
4.0mAh·cm-2的固定容量下,作者又利用SEM研究了放电LOB中Li2O2的形貌,发现有PTFEMA的电池中,Li2O2颗粒均匀分布在GDL表面。在没有PTFEMA的情况下,Li2O2颗粒聚集在正极侧,即PTFEMA的存在促进了Li2O2的均匀分布。放电电压平台的差异进一步表明,PTFEMA促进了ORR反应动力学(图2d)。
计算表明,PTFEMA-Li2O2络合物的吸附能远小于PTFEMA-Li+或PTFEMA-LiO2,这意味着Li2O2可以很容易从络合物中解吸,并参与OER过程(图2f)。在O2气氛下,循环伏安(CV)曲线中的ORR电流密度和气氛切换时i-t曲线的电流相应增加,均进一步证实了PTFEMA加速了ORR过程动力学(图2g)。
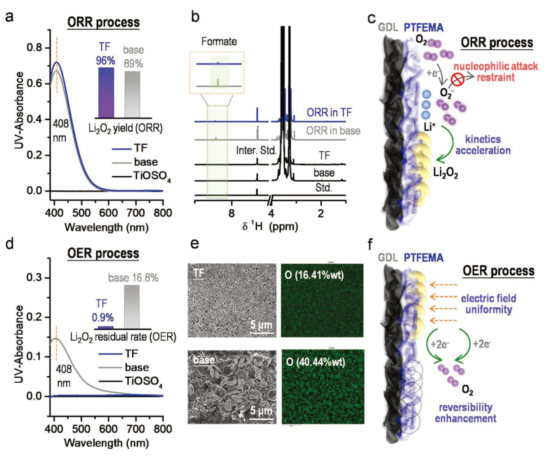
图3.ORR/OER过程中有无PTFEMA的LOB充电性能比较。(a)采用TiOSO4-UV-vis滴定法分析Li2O2浓度(电流密度为0.1 mA·cm-2,放电容量为1.4mAh);(b)从放电正极和隔膜中D2O提取物的1H-NMR谱图,固定放电容量为1.4mAh,电流密度0.1 mA·cm-2;(c)有PTFEMA的LOB中ORR过程示意图;(d)OER过程中正极和隔膜的UV-vis滴定吸收光谱(电流密度为0.1 mA·cm-2,充电容量为1.4mAh);(e)用SEM和EDS表征有/无PTFEMA的GDL;(f)含PTFEMA的LOB中OER过程示意图。@Wiley
研究者采用TiOSO4-UV-vis化学滴定法分析了Li2O2的浓度,发现在PTFEMA的存在下,Li2O2的生成量达到了理论量的96%,远高于没有PTFEMA的89%(图3a),1H-NMR和19F-NMR也证实了这一结论(图3b),这是由于PTFEMA促进了Li2O2的生成(图3c),在充电过程中Li2O2接近完全分解,残留率仅有0.9%,表明PTFEMA的加入提高了LOB的可逆性,而在无PTFEMA的情况下,残留率高达16.8%(图3d),这在SEM图中清晰可见(图3e)。
3、电化学性能
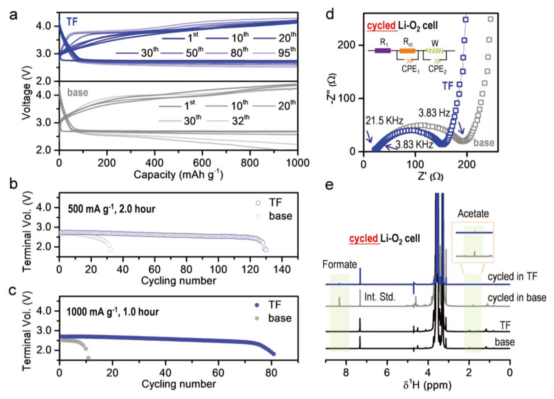
图4.LOB的电化学性能。(a)容量为1000mAh·g-1(电流密度为500 mA·g-1)的LOB在有(蓝色)无(灰色)PTFEMA下的恒流放电-充电曲线;在(b)500和(c)1000 mA·g-1的电流密度下,有无PTFEMA的LOB循环曲线,截止电压2.0-5.0V;(d)循环20次后,LOB的交流阻抗谱和(e)1H-NMR谱图,电流密度:0.25mA·cm-2,固定容量0.5mAh·cm-2,截止电压2.0V-5.0V。@Wiley
研究者发现在PTFEMA存在下,在500 mA·g-1电流密度下,LOB循环次数超过120次,在没有PTFEMA时,循环30次电池就失效了(图4b)。在1000 mA·g-1的大电流密度下,加入PTFEMA后,电池循环性能提高了8倍(图4c)。
20次循环后,含有PTFEMA电解液的电荷转移阻抗值为136Ω,低于不含PTFEMA的165Ω,也说明PTFEMA的加入,加速了电荷转移,增强了电化学动力学(图4d)。他们利用NMR分析了循环后的正极和隔膜,发现加入PTFEMA后,Li2O2诱导羧酸盐和LiF的生成反应均被抑制(图4e)。而且,PTFEMA的加入显著抑制了Li2O2的亲核进攻副反应,缓解了产物穿梭对负极的腐蚀。
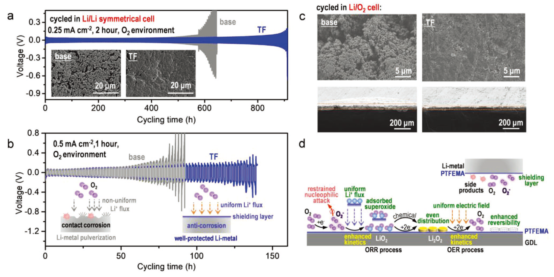
图5.锂金属在氧气中的循环稳定性和PTFEMA存在下LOB的工作机理。在(a)0.25 (2h)和(b)0.5 mA·cm-2(1h),氧气环境,有无PTFEMA情况下,Li/Li对称电池的恒流循环性能;(c)在LOB中锂金属的前视和侧视图(0.25 mA·cm-2,2 h,截止电压2.0~5.0V);(d)PTFEMA存在下LOB的ORR/OER过程示意图。@Wiley
在O2环境下,在0.25和0.5 mA·cm-2电流密度下,PTFEMA的存在提高了Li/Li对称电池的循环性能,这是由于PTFEMA的存在抑制了锂金属表面枝晶和裂纹的产生(图5a-b)。在负极侧,由于Li+和PTFEMA的溶剂化作用,PTFEMA促进了Li+的均匀分布,循环20次后,加入PTFEMA的电池,没有发生负极粉化和副产物的积累现象(图2c)。
05、成果启示
研究者合成了一种LOB电解液添加剂PTFEMA,简便高效的解决了Li2O2导致的电极反应缓慢、可逆性差、负极易被腐蚀等问题。PTFEMA与Li+的溶剂化,提高了Li+传输的均匀性,Li2O2被PTFEMA分子锚定,阻止了它的亲核进攻副反应,促进了它的转化和ORR反应动力学。在1000 mA·g-1的电流密度下,加入PTFEMA后,LOB循环性能提高了8倍。
审核编辑:郭婷
-
电解液
+关注
关注
10文章
846浏览量
23086 -
电池
+关注
关注
84文章
10530浏览量
129387
原文标题:AEM:0.02wt%电解液添加剂,一举解决锂氧电池循环稳定性难题
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
一种新型的钠金属电池负极稳定化策略
钙钛矿太阳能电池稳定性测试的最大功率点跟踪(MPPT)

锂电池电解液如何影响电池质量?锂电池电解液成分优势是什么?
表面活性剂在电池材料中的应用
锂离子电池电解液有什么作用?
揭示谷氨酰胺添加剂对高可逆锌金属阳极的多功能调节作用





 多功能电解液添加剂解决锂氧电池循环稳定性难题
多功能电解液添加剂解决锂氧电池循环稳定性难题
















评论