癌症的最佳治疗需要诊断方法来促进治疗选择,以防止无效治疗。直接评估活肿瘤标本的治疗反应可以填补这一诊断空白。鉴于此,荷兰鹿特丹伊拉斯姆斯大学Dik C. van Gent教授团队设计了一个微流控平台,用于在精确控制的生长条件下使用肿瘤组织切片评估患者治疗反应。优化的芯片上癌症(CoC)平台在7天内可以维持乳腺和前列腺肿瘤切片的生存能力和持续增殖能力。
在此时间范围内,未观察到组织形态学或基因表达模式的重大变化,这表明CoC系统提供了一种可靠和有效的方法来评估肿瘤的内在化疗敏感性。定制的CoC平台分别准确预测了乳腺癌和前列腺癌异种移植模型中顺铂和阿帕鲁坦的治疗反应。
此外,乳腺癌的培养期可延长至14天,而组织形态和生存能力不会发生重大变化。这些培养特征能够评估治疗结果,并为详细的机制研究提供可能性。
该团队开发了一种微流控芯片,该芯片由嵌入聚二甲基硅氧烷(PDMS)膜中的微流体通道组成。PDMS膜由硅框架支撑,框架还包括一个入口和一个出口,分别通向薄膜中的通道。每个通道完全隔离并限制在PDMS膜中,并通过微孔阵列与开放井接触。
每个井都提供了足够的空间来容纳组织切片,并使用热可逆水凝胶固定组织切片,通过微通道和界面顶部的持续灌注和扩散,可以在清除废物和补充营养的同时维持组织切片。底部通过光学窗口PDMS层的气体交换增强组织切片的氧化作用。整个CoC平台连接到微流体流动控制系统,在整个培养期间监测每个孔道的流体速度。
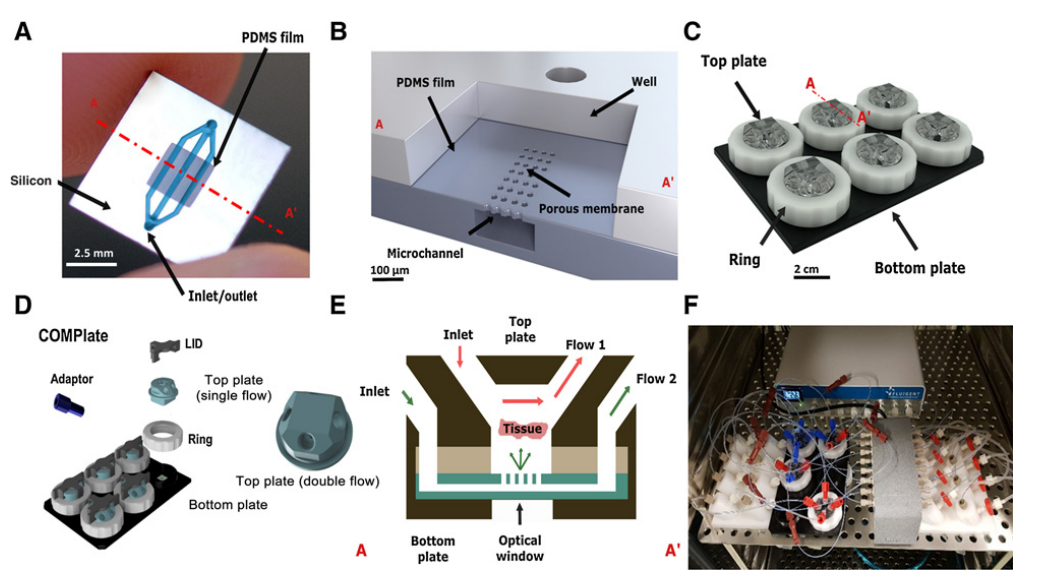
图1 微流控CoC平台设计与概述
接着,该团队对在体外和CoC平台上使用顺铂敏感和人源性组织异种移植(PDX)耐药模型预测治疗反应。结果表明,顺铂治疗3天后TUNEL阳性(凋亡)细胞增多,Edu阳性(复制)细胞减少;而抗顺铂PDX组织切片中EdU和TUNEL信号没有明显变化。实验中还发现了顺铂治疗72小时后,与顺铂耐药肿瘤切片相比,顺铂敏感的PDX中53BP1病灶的积累要高得多,这可能是敏感模型中DNA损伤修复失败的结果。 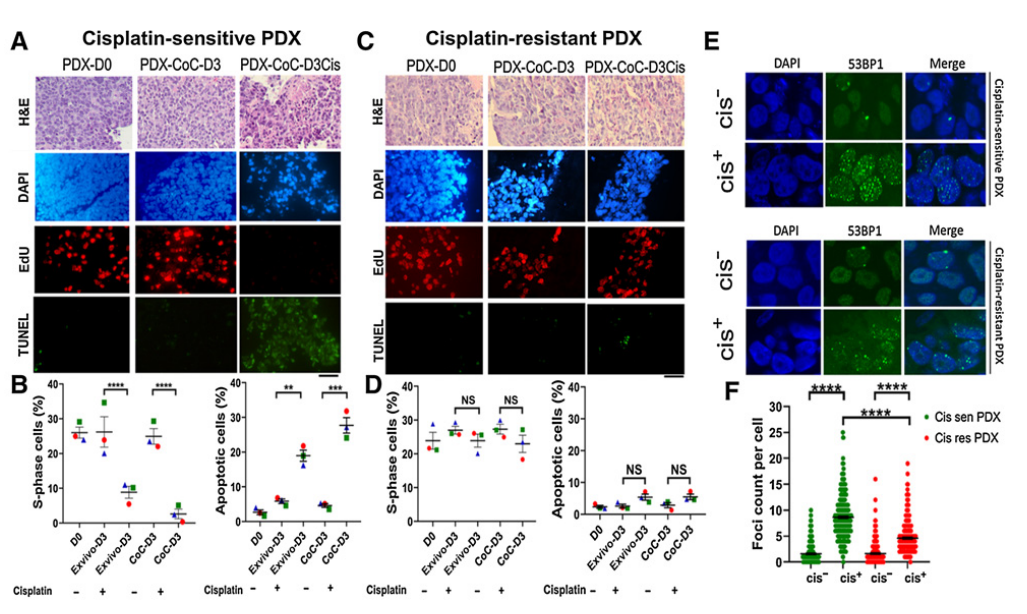
图2 使用顺铂敏感和耐药PDX在体外和CoC平台预测治疗反应
接着,该团队利用雄激素依赖性前列腺肿瘤PC82来评估CoC平台在完全不同肿瘤类型中的性能。他们将肿瘤组织切片在添加或不添加抗雄激素阿帕鲁胺的情况下培养7天。结果发现,暴露于阿帕鲁胺后,AR表达显著降低,TUNEL阳性细胞增加,Edu阳性细胞显著减少,这与抗雄激素治疗在体内和体外培养中的效果非常相似。
总之,CoC培养概括了在体内已知敏感性的乳腺和前列腺肿瘤模型中两种不同治疗方法的肿瘤反应。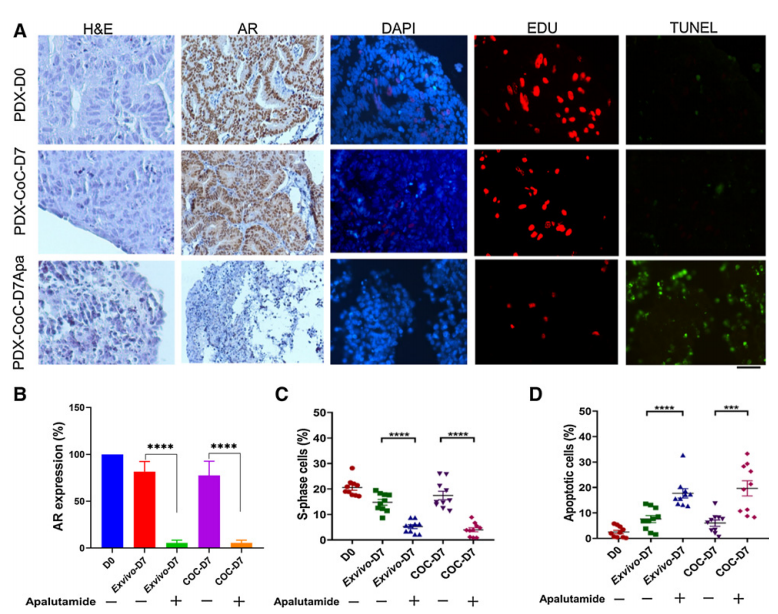
图3 CoC平台阿帕鲁胺治疗的疗效
体外培养的主要限制之一是保持最佳增殖能力和组织结构的最大培养时间。研究者们将体外和CoC平台长期肿瘤组织切片培养进行比较。结果发现,细胞在第0天的生长速度与在CoC平台培养7天的生长速度没有太大的差异,且高于体外培养。14天后,结果更加明显。
在Geminin的测定中,结果发现,CoC平台的Geminin细胞率高于体外。这些数据表明,CoC平台为延长(超过7天)肿瘤组织切片的培养时间提供了比体外系统更好的培养条件,即使在7天后,两种培养方法之间也可能已经存在微妙的差异。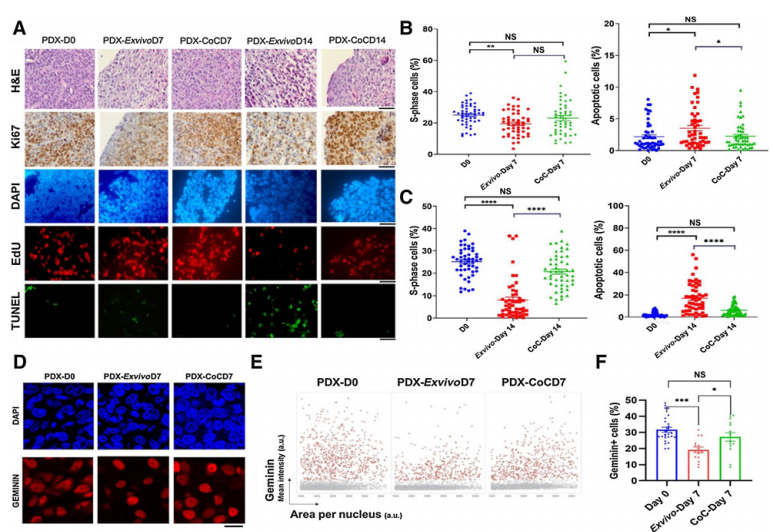
图4 乳腺PDX肿瘤组织切片在离体条件下和CoC平台中培养14天
最后,研究者们进行了RNA分离与测序、生物信息学分析、路径分析以及统计分析,结果在这些途径没有观察到任何有统计学意义的变化,表明两种培养条件均未引起肿瘤生长特征发生重大变化。基因表达分析表明,体外条件下免疫反应(如IFN信号通路)受到影响,但在CoC平台中不受影响。
接着,研究者们在两种培养条件下,分别在第0天和第7天进行53BP1免疫染色,分析肿瘤切片DNA损伤情况。结果发现在体外和CoC条件下观察到一个大病灶的细胞,以及多个小病灶的细胞。然而,在离体条件下培养的肿瘤DNA损伤明显高于CoC。
因此得出结论,体外培养条件诱导了免疫激活,并且在体外培养7天后存在更多的DNA损伤,使得CoC系统更忠实地代表原发肿瘤,并成为研究治疗反应的首选系统。
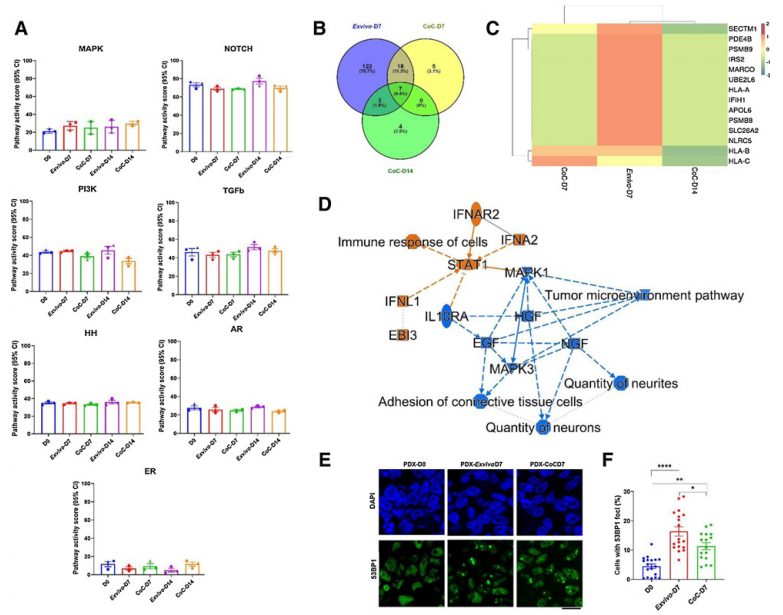
图5 体外及CoC平台培养乳腺PDX肿瘤基因表达分析
综上,这种微流控芯片上癌症平台可以用于乳腺癌PDX切片维持细胞活力、增殖和组织形态至少14天,且能准确预测乳腺癌顺铂治疗反应和前列腺癌PDX肿瘤切片抗雄激素治疗反应。进一步验证结果表明,该平台具有预测肿瘤化疗药物治疗反应的潜力,虽然目前的研究主要集中在乳腺癌和前列腺癌的PDX模型,但CoC平台也可以应用于其他实体肿瘤。该CoC平台易于使用,操作灵活,占地面积最小,是功能基因组学、药物筛选和个性化医疗离体研究的多功能工具。
审核编辑:刘清
-
微流控芯片
+关注
关注
13文章
281浏览量
18928 -
DNA
+关注
关注
0文章
243浏览量
31160 -
RNA
+关注
关注
0文章
46浏览量
9749
原文标题:微流控芯片上癌症平台,用于化疗药物治疗反应预测
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
微流控芯片在细胞培养检测中的应用
引领未来的微通道连续流反应器的优势与应用
玻璃微流控芯片的特点
掌握未来化工技术——微流控反应器及其优势
常用的微流控芯片类型
使用原代肿瘤细胞进行药物筛选的数字微流控系统




 微流控芯片用于化疗药物治疗反应预测
微流控芯片用于化疗药物治疗反应预测











评论