癌症的筛查、早期诊断、预后监测等一直是科学难题。最常见的癌症诊断方法主要是基于组织活检,这种侵入性方法非常耗时,并且在某些患者中存在潜在风险,因此不适合用于监测肿瘤的发展过程。
此外,组织活检会增加癌症转移的可能性,并且部分肿瘤并不总是易于活检取样。
因此,监测癌症的持续发展,需要利用具有高灵敏度、特异性且低成本的“液体活检”技术来解决。
液体活检作为一种非侵入式的血液检测技术,能监测肿瘤或者转移灶释放到血液的循环肿瘤细胞(CTC)、细胞外囊泡(EV)和蛋白标志物,是检测肿瘤和癌症辅助治疗的突破性技术。
与传统的组织活检相比,液体活检以速度快、样本易获取,损伤小等特点成为了一种新兴的癌症诊断方法,近年来备受关注。
中山大学药学院张元庆教授团队长期开发各类微流控芯片进行液体活检的研究,主要针对循环肿瘤细胞和外泌体等生物标志物的检测,通过引入一系列的DNA纳米技术的信号放大策略实现高灵敏的靶标检测。
许多研究表明,肿瘤来源细胞外囊泡(tEVs)生物标志物可以反映癌细胞的表型,在癌症的诊断和治疗中具有很大的潜力。
然而,tEVs表现出高度的异质性,由于其低表达,快速、敏感地识别tEVs生物标志物仍然具有挑战性。
荧光光谱的重叠也显著限制了荧光探针对tEVs生物标志物的多重分析。
因此,开发一种高灵敏多表型tEVs的分析方法可以提高疾病诊断的准确率和实时监测疾病的进展,从而为患者制定精准治疗的方案,以达到最佳的临床效果。
目前用于tEVs分析的方法大多还侧重于单个生物标志物的特异性识别,忽略了tEVs的异质性,并可能遗漏有关疾病进展的重要信息,导致其tEVs识别的准确性不足。
此外tEVs的异质性也会阻碍tEVs的识别和信号读出。
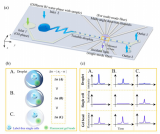
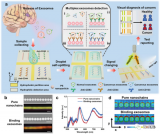
近期,张元庆教授课题组与中山大学中山医学院吴敏昊教授课题组以及美国杜兰大学胡晔教授课题组合作,利用微流控芯片中不同尺寸间隙的微栅栏结构对不同尺寸的微球进行排布和分选的策略,开发了一种简便灵活的多重tEVs表型分析方法,实现了高选择性和敏感性的tEVs的原位捕获,进而实现多个信号的同时读出。
该方法使用特异性发夹探针编码不同尺寸的微球,从而可以捕获不同表型的tEVs。
此外,在芯片中设计了不同尺寸间隙的微栅栏结构对微球进行排布和分选,以生成特定位置的信号,指示不同tEVs生物标志物的水平。
同时,进一步利用原位滚环扩增技术对这些微球上的tEVs生物标志物信号进行放大。
该策略允许通过荧光同时检测多种tEVs表型,而不受光谱重叠的限制。
该研究表明,该方法能快速、高灵敏度地同时检测6种不同的tEVs表型。
由于传感平台的可编程性,该方法可以快速适用于检测不同tEVs表型的替代检测生物标志物。
值得注意的是,临床研究表明,该策略可能为癌症患者的精准诊断和个性化治疗提供新的思路。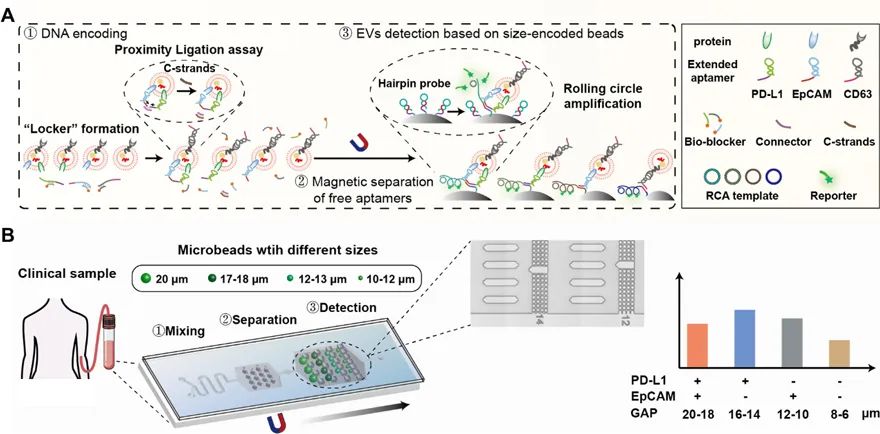
图1 利用尺寸编码的亲和微球鉴定肿瘤来源的细胞外囊泡的表型
这项工作是基于该课题组几个月前发表在Angew Chem Int Ed Engl.上的一个工作的延伸和发展。
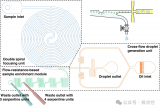
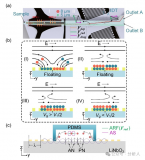
该课题组先前提出了一种基于芯片中不同尺寸间隙的微栅栏结构对微球进行排布和分选的策略,该策略利用颜色和尺寸编码的微球开发了一种简便灵活的多重免疫分析方法,进行新冠肺炎血清学抗体和炎症标志物的定量检测(图2)。通过将两种不同颜色的量子点按不同比例导入到不同尺寸的聚苯乙烯微球中,构建了基于颜色和尺寸双重编码的微球库。
随后在芯片中通过不同尺寸间隙的微栅栏结构对微球进行排布和分选,并利用滚环扩增方法在微球的免疫复合物上偶联有大量荧光分子的长DNA串联体,进而对靶标分子进行信号放大,达到比常规方法更低的检测限。
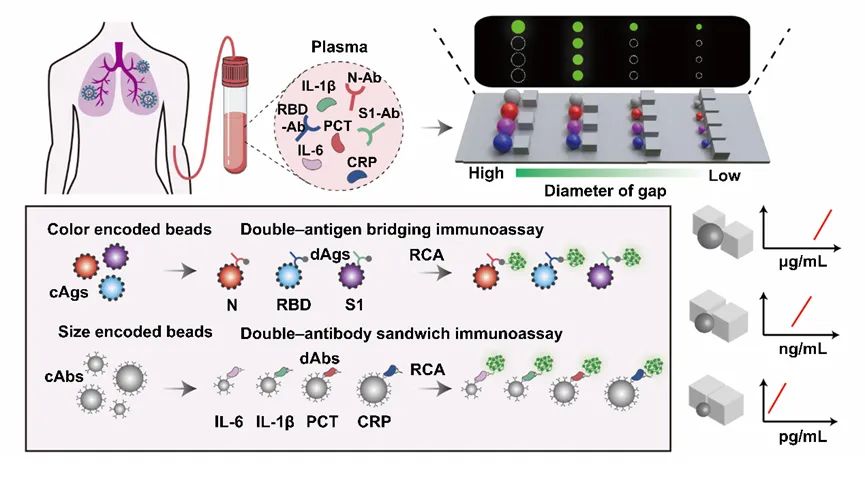
图2 一种基于双重编码微球和滚环扩增的多重分析方法用于新冠血清学评估
审核编辑:刘清
-
编码器
+关注
关注
45文章
3579浏览量
134055 -
微流控芯片
+关注
关注
13文章
260浏览量
18804
原文标题:基于微流控芯片的异质性细胞外囊泡精准分离和定量分析
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐




 浅析基于微流控芯片的异质性细胞外囊泡精准分离和定量方法
浅析基于微流控芯片的异质性细胞外囊泡精准分离和定量方法












评论