近日,常州大学药学院招秀伯教授与蔡志强教授联合团队运用微流控技术开发了一种近红外光响应的脂质体纳米药物递送平台,为抗肿瘤药物的靶向递送和大规模工业化生产提供了一种新的策略。
该研究成果发表于国际期刊《Nanoscale》,招秀伯教授与蔡志强教授为共同通讯,常州大学药学院研究生金毅为第一作者。
安丝菌素P-3(Anamitocin P-3,AP-3)是一种具有高细胞毒性的疏水抗肿瘤药物,对多种癌细胞系具有较强的抗肿瘤活性。
在真核细胞中,AP-3作用于β-微管蛋白在间期和有丝分裂期间抑制微管组装和染色体分离,导致细胞凋亡。然而,AP-3的水溶性差,给药困难。
将AP-3包裹进脂质体的磷脂双分子层中可以有效提高其药物浓度,减轻其对正常组织的毒性,并能使药物更容易在肿瘤部位聚集。
尽管脂质体制剂具有巨大的潜力,但制造过程中重复性差、稳定性差等问题阻碍了许多有前途的脂质体配方从实验室转化为大规模工业化的生产。
招秀伯教授先前开发了一种新型微流控技术,该技术可以精确控制脂质体、纳米颗粒的性质(例如尺寸、多分散性和包封率),并显著提高了生产速度。
该研究使用该微流控技术制备了包裹安丝菌素P-3的光响应热敏脂质体并用于乳腺癌治疗。
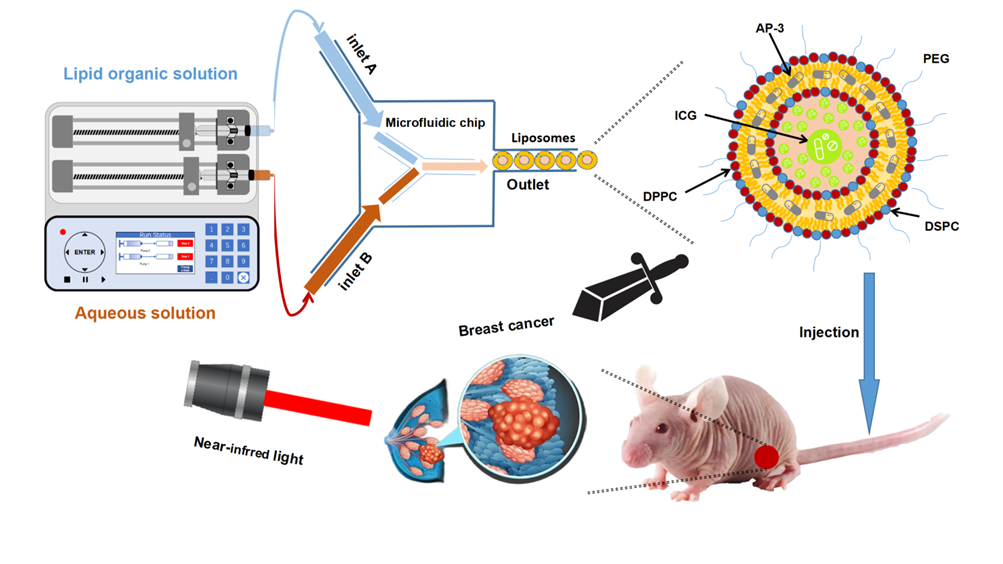
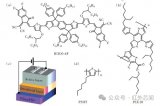
图1 微流控技术制备安丝菌素P-3光响应脂质体的过程与应用
该纳米递送体系的制备过程简单来说是将含有AP-3与磷脂的有机溶液以及ICG水溶液按一定的流速分别同时注入微流控芯片的两个入口,在芯片内部组装成脂质体。
该微流控技术能连续生产尺寸均一的纳米颗粒,单个芯片最大生产速度可以达到320 mL/min,通过多个芯片并联可以实现大规模生产。
生产出来的脂质体具有较高的包封率、合理的粒径与较小的多分散性指数(0.05)、较好的稳定性,并且体外光热效果显著(如图2所示)。
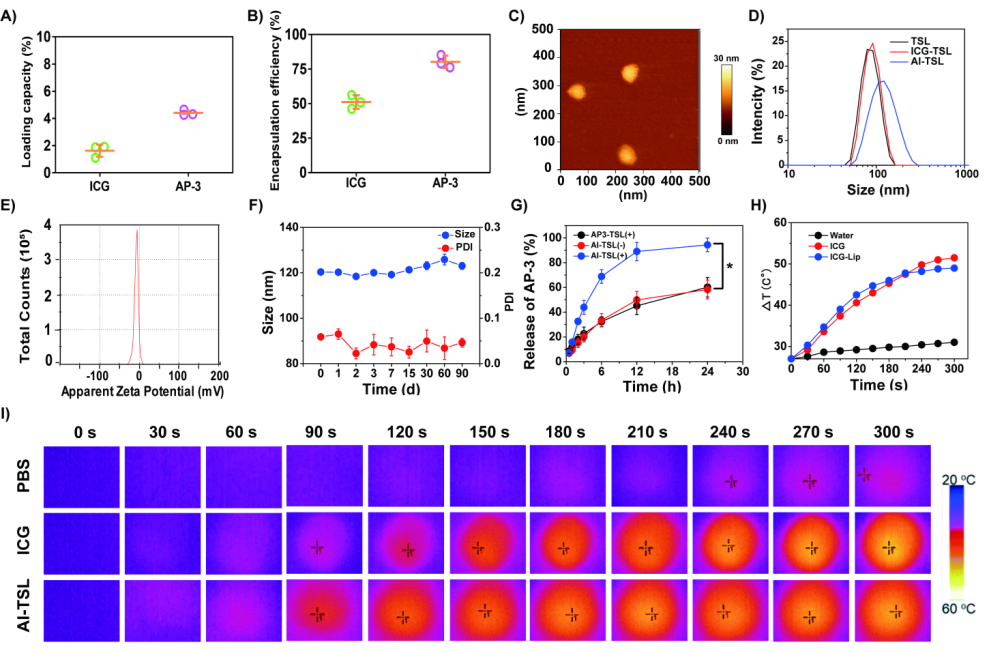
图2 脂质体的形态学表征以及体外光热实验
该纳米递送平台相比起游离药物,更易被细胞所摄取。细胞与AP-3脂质体孵育后未见β-微管蛋白聚集。
免疫印迹实验发现AP-3影响Akt与Wnt信号通路中的蛋白表达,包裹进脂质体并没有改变其作用靶点(如图3所示)。
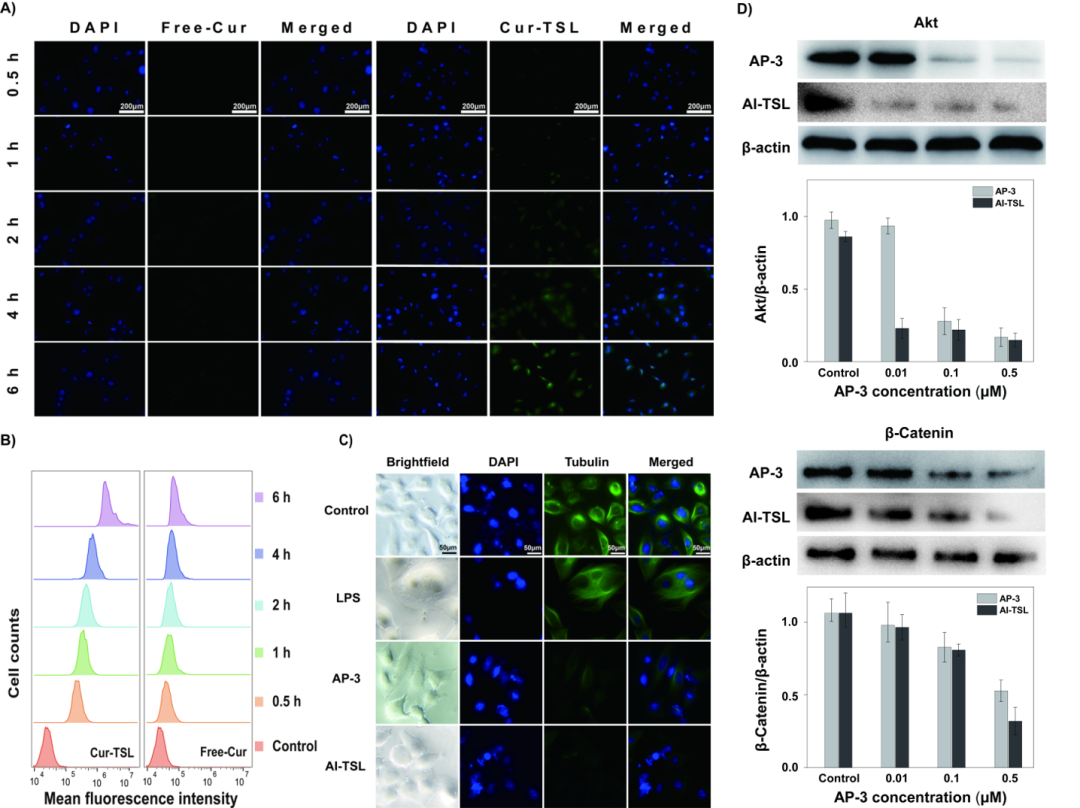
图3 体外细胞摄取效果的验证以及作用机制的探索
此外,该纳米递送平台具有略高于体温的相变温度,在正常体温下药物释放缓慢,进入细胞后毒性很小,通过近红外激光照射后,ICG响应并产生热量使局部温度升高从而增强了脂质膜的流动性,大量药物透膜释放杀伤癌细胞(如图4所示)。
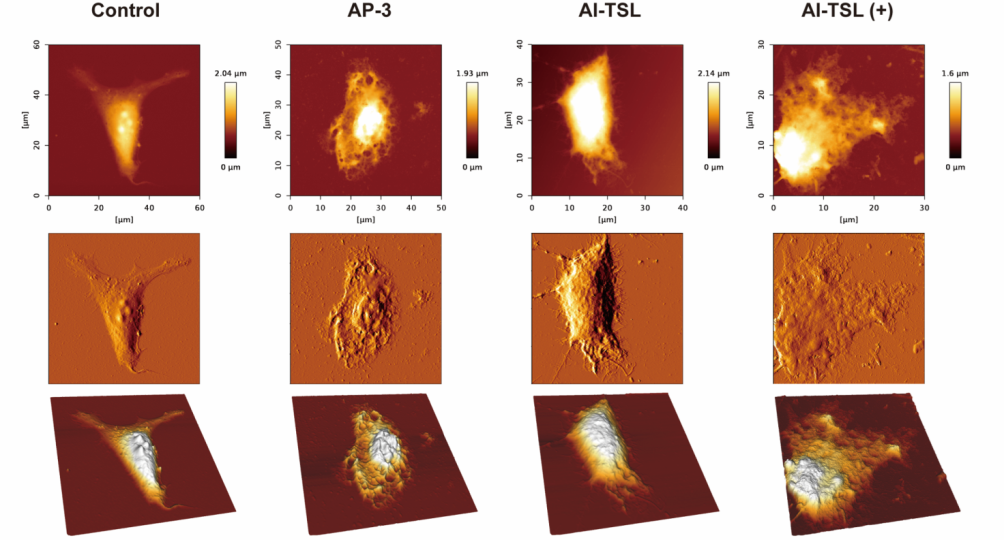
图4 作用于细胞后细胞形态的研究
动物实验表明,AP-3光响应脂质体更易在实体肿瘤中富集,具有良好的光热效应(如图5所示),并显著减少了游离的AP-3对肝、脾、肺等主要器官的毒性,增强了对靶部位肿瘤细胞的杀伤效果(如图6所示)。
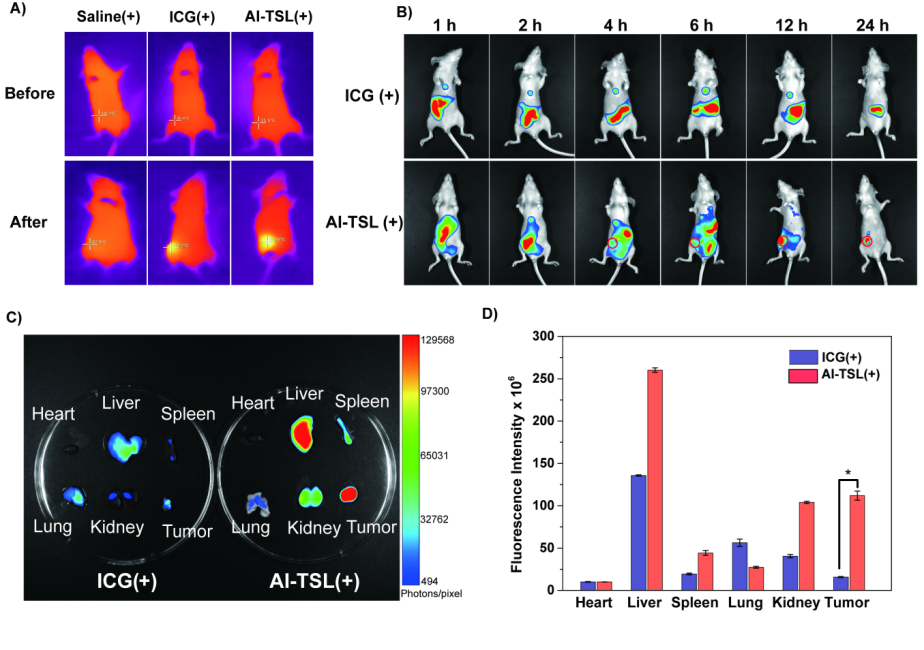
图5 动物体内光热效应以及体内分布的研究
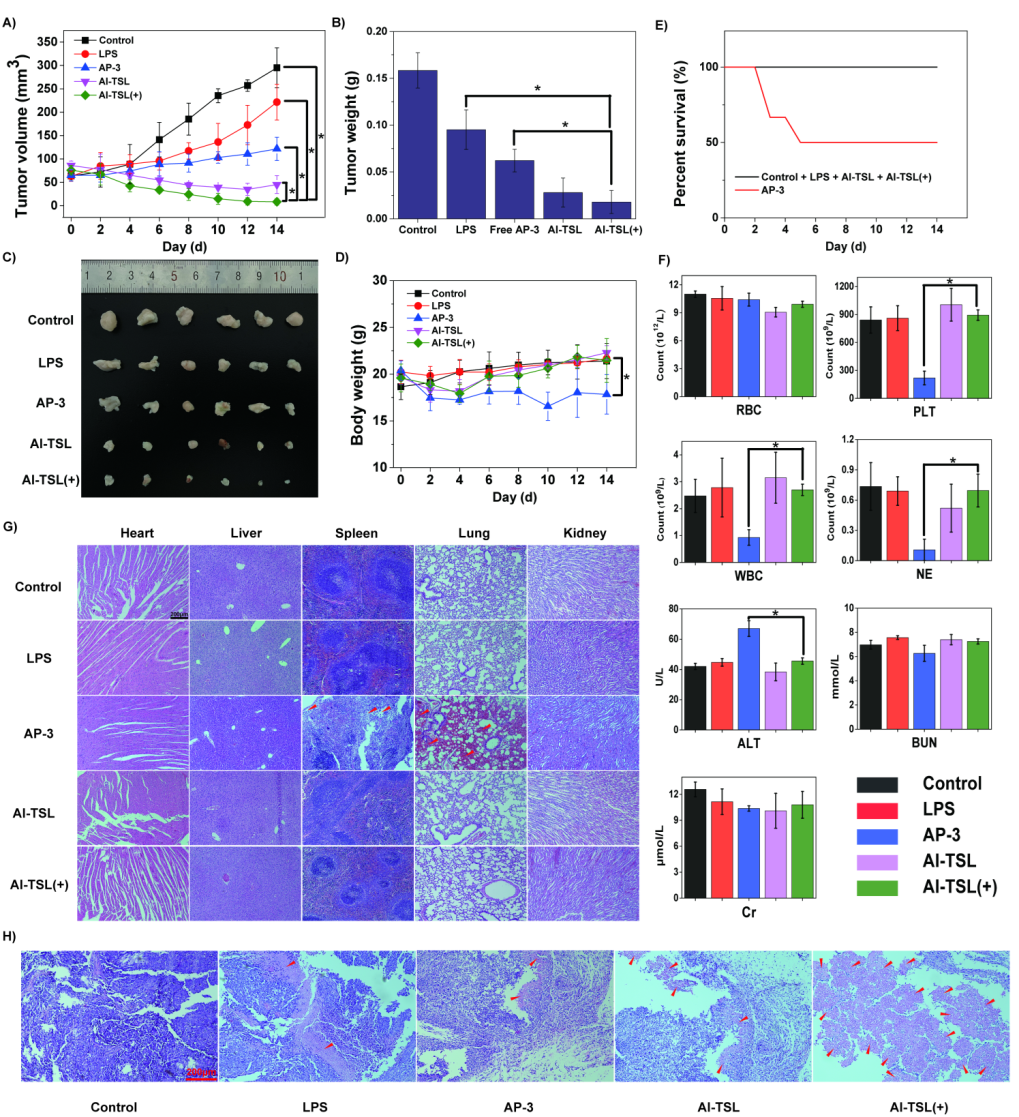
图6 在动物肿瘤模型中的抗肿瘤效果以及组织学结果
虽然安丝菌素具有优异的抗癌效果,但目前市场上的安丝菌素药物较少。安丝菌素脂质体还未见报道。其衍生物被用作抗体药物偶联物赫塞莱(Kadcyla)的“弹头”部分。
而该研究设计了“遥控炸弹”,ICG作为内部的“火药”通过近红外光触发,使光敏脂质体解体,释放AP-3药物。两种药物递送体系旨在减少药物的副作用并增强药效。
该工作使用简单安全的材料,首次将AP-3药物负载到脂质体中,并使用红外光触发药物释放,具有良好的生物相容性和安全性。
动物实验显示其具有优异的体内抗肿瘤效果。运用微流控技术能够大批量生产尺寸均一,包封率高的AP-3脂质体,使其不仅仅局限于实验室的研究,在未来更具有产业化和临床应用前景。
审核编辑:刘清
-
微流控系统
+关注
关注
1文章
76浏览量
1869
原文标题:基于微流控法制备的光响应脂质体纳米药物递送平台,用于乳腺癌治疗
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
近红外光谱仪的原理和工作机制
近红外光谱的新曙光
使红外光可见:新设备利用2D材料转换红外光
傅里叶变换红外光谱仪技术在光伏材料性能表征中的应用与优化





 一种近红外光响应的脂质体纳米药物递送平台开发
一种近红外光响应的脂质体纳米药物递送平台开发











评论