准确了解生物组织中氧分压对患者的护理和缺血性疾病的治疗至关重要。然而,目前测量组织中氧分压的方法有诸多局限性,通常需要训练有素的专业人员操作程序复杂的设备。
此外,角质层的屏障功能虽阻挡了皮肤氧气交换,但也阻碍了透过表皮直接测量组织中快速变化的氧分压。
为此,来自美国哈佛医学院的Conor L. Evans教授团队开发出一种可以克服皮肤屏障功能的氧敏磷光微针阵列(MNAs),可在0~160 mmHg的生理范围内监测真皮层中的氧分压。
此外,该MNAs可以与可穿戴设备结合,实现对氧分压的无线实时监测。相关研究以“Phosphorescent Microneedle Array for the Measurement of Oxygen Partial Pressure in Tissue”为题于近期发表在ACS Sensors上。
氧敏磷光MNAs的制备和氧传感机制
MNAs由长度和间距为1000 μm的6 × 6微针阵列组成(图1a),该尺寸可以使微针有效地进入毛细血管层而不产生痛感。
研究人员选择聚甲基丙烯酸乙酯(PEMA)和聚甲基丙烯酸丙酯(PPMA)作为制备微针的材料,因为这些透明聚合物具有高氧渗透性和良好的生物相容性。
背板则采用聚乳酸(PLA),该材料也具有良好的生物相容性和透明度,且氧渗透性弱于PEMA和PPMA。
MNAs还掺入了氧敏红色磷光金属卟啉分子,氧气会使氧敏磷光分子产生能量转移,减小荧光强度和寿命,形成反比例关系。
MNAs穿透角质层后,组织间质液和毛细血管层中的氧气扩散到氧敏微针上,通过荧光强度和寿命的变化监测血氧含量(图1b)。
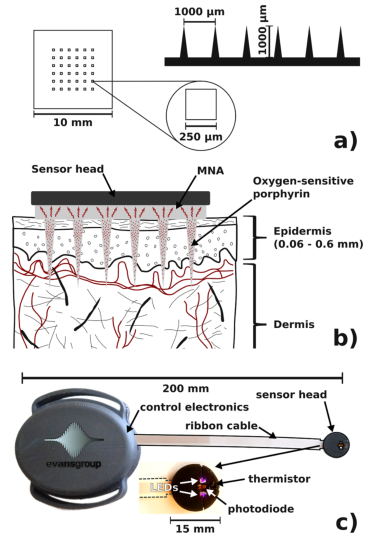
图1 (a)MNAs的尺寸;(b)皮肤中MNAs的氧传感机制;(c)光学无线可穿戴读取系统
MNAs的磷光特性
MNAs的磷光特性通过在不同氧分压环境下测得的发射光谱和磷光寿命曲线来表征。图2a展示了PEMA和PPMA磷光微针在空气和氮气中的发射光谱。
如图2b所示,在氮气中,PEMA和PPMA微针的磷光寿命分别为93.1 μs和94.0 μs。当转化为空气时,两者分别下降到44.2 μs和37.8 μs。
PEMA中较小的乙基可以减缓氧气通过聚合物基质扩散到卟啉分子的速度。因此,氧气与卟啉分子的碰撞在PEMA中不像在PPMA中那样频繁,更少的卟啉分子被氧气淬灭,因而平均荧光寿命更长。
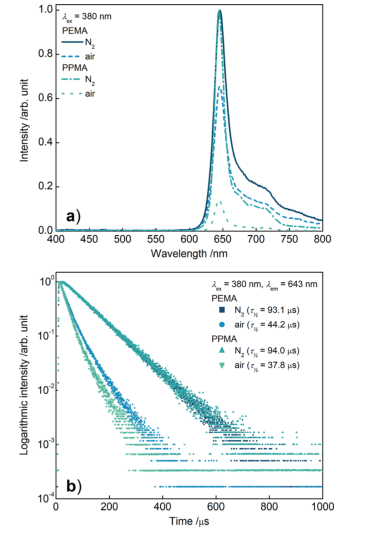
图2 PEMA和PPMA磷光微针在空气和氮气中的(a)发射光谱和(b)磷光寿命曲线
MNAs的机械稳定性和皮肤渗透力
图3a直观地证明了荧光只在MNAs微针表面而不在MNAs背板中,这表明实验所用的微针加工技术可以制备具有透明背板和发光针的MNAs,这保证了光子在背板间的高效传输并有效减小了测量背景信号。
机械稳定性则通过穿刺离体猪皮测试(图3b)。将PEMA MNAs按压在离体猪皮上,针发生了弯曲,但没有一根断裂(图3c),这表明制备微针所用的聚合物在穿透角质层时足够强健,没有丧失其机械稳定性。
此外,光学相干层析成像(OCT)(图4)显示,穿透深度在400 μm~500 μm之间,该深度足以测量皮肤毛细血管和组织间质液中的氧含量。若需到达更深的组织层和皮肤毛细血管层,可以制备尺寸更长的针。但是当针的长度增加到1000 μm~1450 μm以上,会产生痛感。

图3 (a)制备后的PEMA MNAs照片;(b)台盼蓝处理过的PEMA MNAs应用后的猪皮照片;(c)插入猪皮后的PEMA MNAs照片

图4 (a)按压PEMA MNAs时和(b)应用PEMA MNAs后猪皮的OCT图像
MNA的氧传感能力
在猪皮上测试MNAs氧传感能力之前,PEMA和PPMA MNAs先在气控箱中进行校准。在气控箱中PEMA和PPMA MNAs磷光寿命随氧分压的变化如图5a所示。
随着氧分压的增加,PEMA和PPMA的磷光寿命分别从92.3 μs和93.4 μs缩短到45.6 μs和38.1 μs。氧分压与卟啉的发射强度和磷光寿命的变化呈负相关。MNAs的灵敏度则通过Stern−Volmer公式转换的散点图得到,图5b表明PPMA MNAs灵敏度更高。
随后研究人员在离体猪皮上测试MNAs的氧传感能力。MNAs测量的氧分压(PO₂)值如图6所示,MNAs的PO₂值与皮下参考氧探针的变化趋势一致,但MNAs测得的PO₂值更低一些;与皮肤表面的参考传感器相比,MNAs的PO₂值则更高。
MNAs与参考探针测量值的差异是因为参考探针穿透深度比MNAs更深。当样本皮肤底部暴露在空气中而表面覆盖塑料薄膜时,气体交换优先发生在皮下更深的地方,更接近样本底部的参考探针自然比MNAs和皮肤表面的参考探针更早检测到氧含量的变化。与PPMA MNAs相比,PEMA MNAs的PO₂值在检测到氧分压升高前出现延迟,这种灵敏度上的差异是因PPMA比PEMA具有更好的氧渗透性。
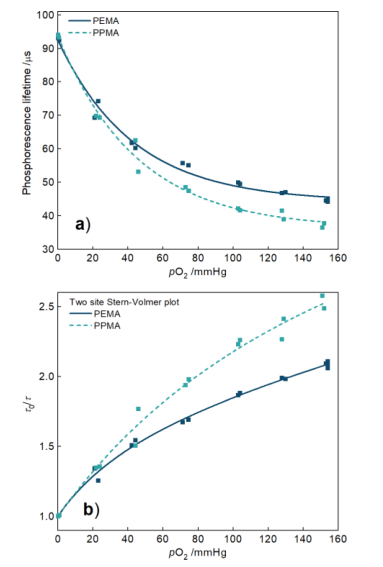
图5PEMA和PPMA MNAs的(a)磷光寿命随氧分压的变化以及(b)相应的Stern−Volmer图
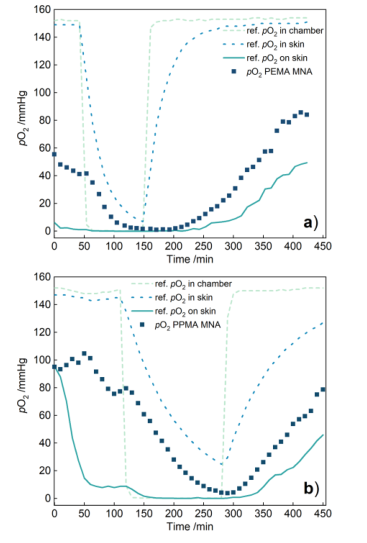
图6 (a)PEMA和(b)PPMA MNAs测定离体猪皮中的氧分压
研究人员也考虑了微针使用后的形变是否对PO₂测量有影响。结果表明,MNAs在使用前和使用28周后对氧气灵敏度没有显著差异(图7)。
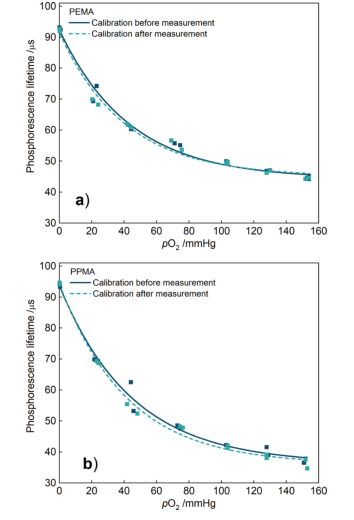
图7 (a)PEMA和(b)PPMA MNAs在皮肤上应用前和28周后的磷光寿命与氧分压的比较
MNAs与可穿戴读取系统的结合
连接有PPMA MNAs的可穿戴设备测量的氧分压如图8所示,其与皮肤内参考氧传感器的PO₂值趋势一致,但其数值低于参考值。此外,可穿戴设备的PO₂值在检测到氧分压升高时,出现了与图6a中相似的延迟现象。
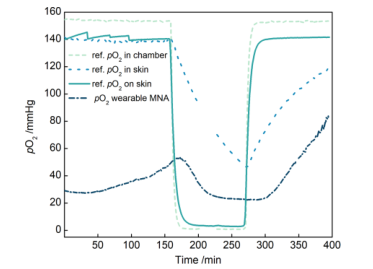
图8用PPMA MNAs和可穿戴设备测量分离猪皮的氧分压
综上所述,这款氧敏MNAs能克服角质层的屏障功能,在0~160 mmHg生理范围内测量皮下的氧分压。MNAs与可穿戴设备的结合表明这项技术可以以小型化、用户友好的形式在医院和急诊室进行血氧监测。在未来临床实验前,可先在大型动物上测试,以确保MNAs在活体复杂条件下的氧传感能力。
审核编辑:刘清
-
传感器
+关注
关注
2554文章
51636浏览量
758047 -
PLA
+关注
关注
0文章
39浏览量
17128 -
OCT
+关注
关注
2文章
33浏览量
3800
原文标题:可以克服皮肤屏障功能的氧敏磷光微针阵列,用于组织中氧分压测量
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
微透镜阵列后光传播的研究
通过微透镜阵列的传播
【敏矽微ME32G070开发板免费体验】使用coremark测试敏矽微ME32G070 跑分
【敏矽微ME32G070开发板免费体验】开箱+点灯+点亮OLED
【敏矽微ME32G070开发板免费体验】开箱及环境搭建
【敏矽微ME32G070开发板免费体验】+ADC测试与LED点亮
【敏矽微ME32G070开发板免费体验】使用JLINK的RTT功能实现类似串口printf打印功能
通过微透镜阵列的传播
半侵入式"可穿戴诊所"——微针技术的创新应用




 可以克服皮肤屏障功能的氧敏磷光微针阵列
可以克服皮肤屏障功能的氧敏磷光微针阵列












评论