血脑屏障(BBB)是指调节血液和大脑之间分子交换的物理和代谢屏障,主要由高度特化的内皮细胞、周细胞和星形胶质细胞的足部组成。对于大多数中枢神经系统疾病(包括脑癌、中风、自闭症和阿尔茨海默病)的治疗,药物的疗效往往有限,这是由于药物通过血脑屏障的穿透力差。
不幸的是,动物模型通常在屏障紧密性、转运蛋白表达和代谢活性方面表现出物种差异。因此,动物模型的预测结果不能直接外推到人类身上。此外,动物实验成本高,耗时长,药物的高通量筛选和机制研究很难在动物模型上进行。因此,迫切需要开发替代模型来更好地预测血脑屏障的药物渗透性,促进神经治疗的发展。
最常用的体外血脑屏障模型是在Transwell上培养一层脑微血管内皮细胞(BMECs)。然而,Transwell的这种静态培养缺乏机械力,保持了较大的液细胞体积比,导致细胞环境中的信号不稳定和不可控。此外,流体剪切应力作用于BMECs,对细胞生长、屏障功能、转运蛋白表达和药物渗透性有显著影响。与基于Transwell的体外血脑屏障模型相反,器官芯片(Organ-on-a-chip,OOC)技术是一种构建血脑屏障模型的动态培养平台,具有可控的生化和生物力学微环境的优势。
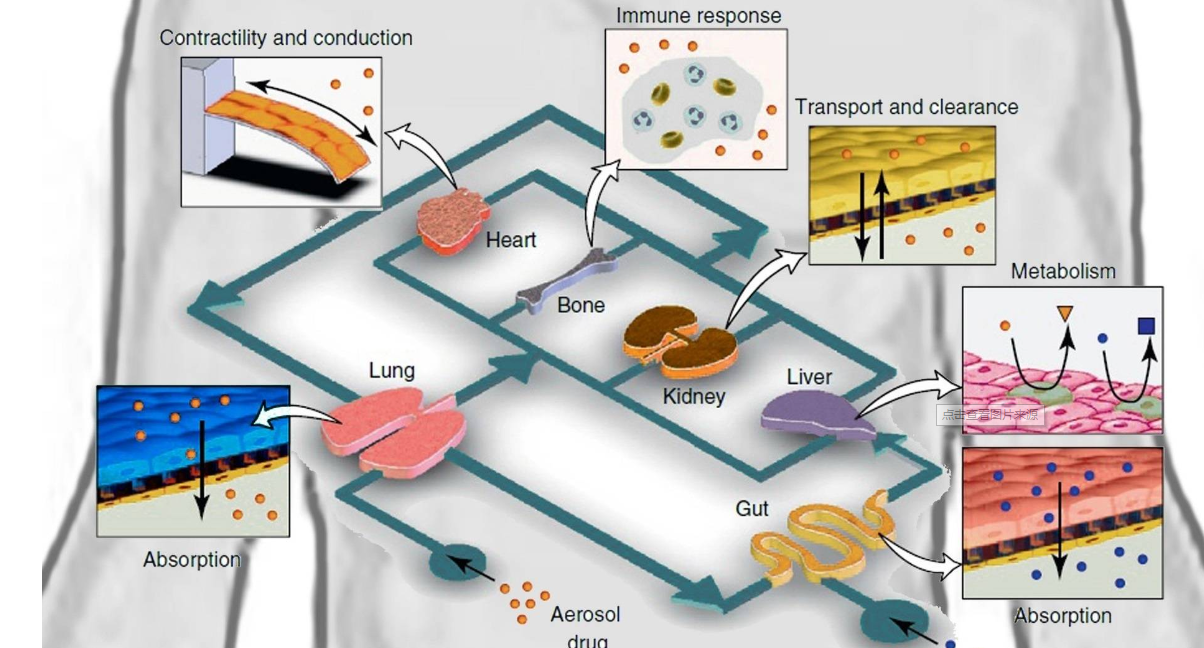
近日,北京大学艾晓妮、屠鹏飞团队设计了一个高通量恒速率灌注阵列芯片(cPAC),并基于该芯片构建了用于药物渗透性筛选的血脑屏障器官芯片模型。该成果以“Constant-rate perfused array chip for high-throughput screening of drug permeability through brain endothelium”为题,发表在英国皇家化学会期刊Lab on a Chip上,并入选为期刊的封底文章。
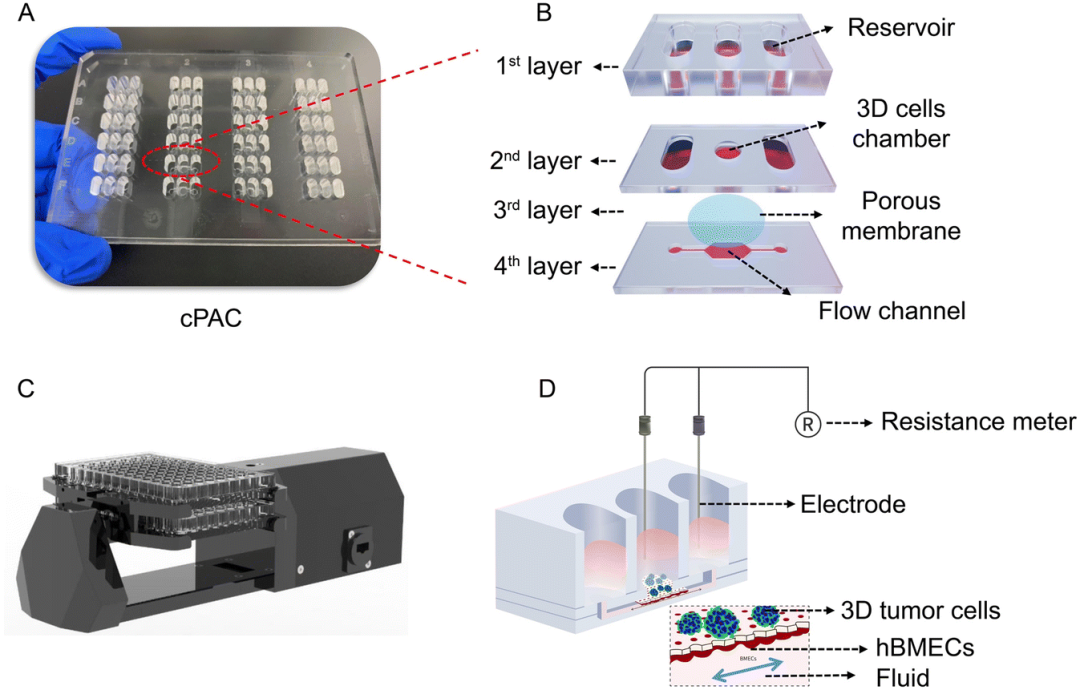
恒速率灌注阵列芯片(cPAC)的照片和原理图
研究结果表明,该恒速率灌注阵列芯片能通过重力作用实现恒流、高通量的灌注;同时兼容跨膜电阻仪,可实现屏障功能的实时监测。
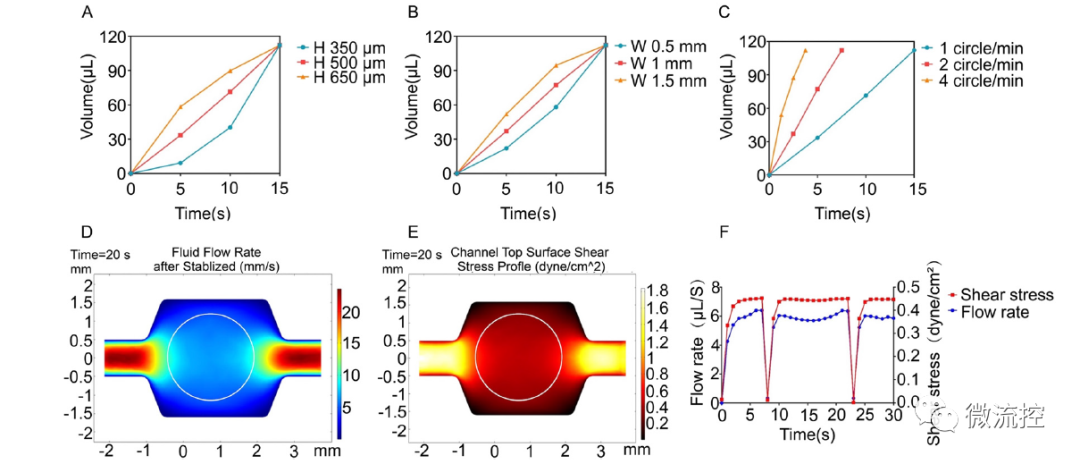
恒速率灌注阵列芯片(cPAC)上流体流速和剪切应力的表征
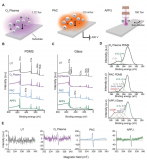
与静态Transwell培养的血脑屏障模型相比,高仿生血脑屏障器官芯片模型具有更强的屏障、转运外排和可逆渗透功能。
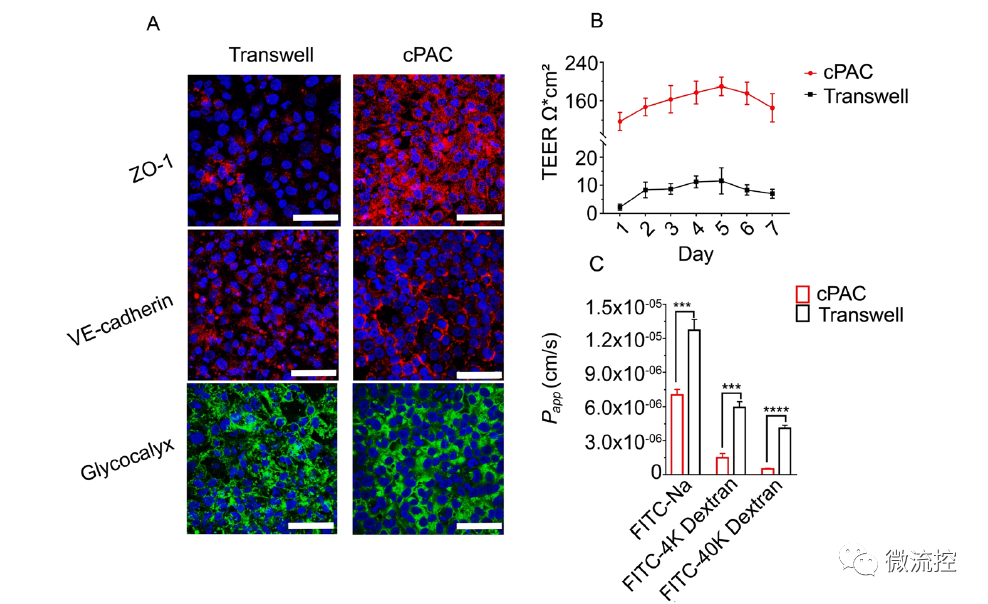
恒速率灌注阵列芯片(cPAC)和Transwell培养的脑内皮细胞模型屏障功能的比较
此外,研究结果表明,不同药物在血脑屏障器官芯片模型上的透脑能力(Papp)与体内具有极高的一致性,相关系数R²大于0.99。
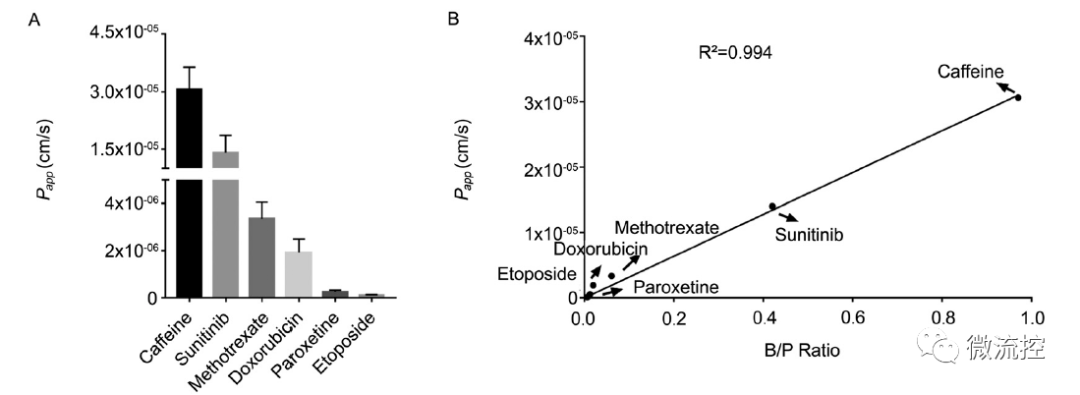
体外模型与体内模型药物透脑能力的相关性
在此基础上,研究人员构建了血脑屏障-肿瘤串联器官芯片模型,可以同时评价药物的透脑能力和抗脑肿瘤药效,对TKI抑制剂治疗肺癌脑转移的预测结果与体内模型高度一致。
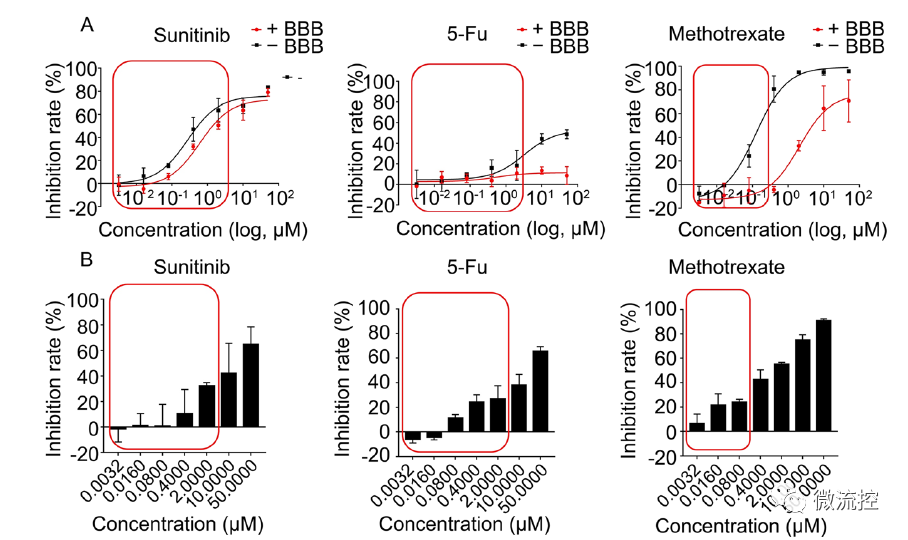
同时评价模型药物对人脑微血管内皮细胞(hBMECs)的透过性、抗胶质瘤疗效和细胞毒性
综上所述,该研究开发的恒速率灌注阵列芯片和血脑屏障模型为创新药物的透脑能力评价和机制研究提供创新技术平台,有望加速中枢神经系统药物研发,目前已在北京大橡科技有限公司应用转化。
审核编辑:刘清
-
神经系统
+关注
关注
0文章
82浏览量
12979
原文标题:仿生高通量血脑屏障器官芯片,实现高效药物透脑能力评价
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
接口芯片的编程模型方法是什么
石墨烯基导电油墨具有良好的渗透性和低阻抗,针对 RFID天线性能进行了优

利用微流控技术制备的“心脏颗粒”,用于评估药物的心脏毒性
谷歌DeepMind推出新一代药物研发AI模型AlphaFold 3
基于液体积木的可重构液体器件,可用于器官芯片的构建
基于液体积木的可重构液体器件可用于器官芯片的构建
mapgis属性筛选表达式
英飞凌在浦东打造“数字+低碳”现代智能化仓库,汉威科技为电池安全保驾护航
新能源车将突破2000万辆,三星希望通过华星光电间接控制 LG 显示广州工厂
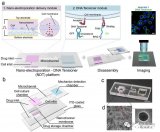




 用于药物渗透性筛选的血脑屏障器官芯片模型
用于药物渗透性筛选的血脑屏障器官芯片模型










评论