近日,清华大学机械系在基于自组装微纳制造的细胞转染研究中取得重要进展。
细胞免疫疗法在肿瘤治疗中已取得重要突破,成为最有希望消除肿瘤的治疗方法之一,而胞内递送及目标基因编辑是细胞免疫治疗技术流程中的关键前提步骤。但对于具有高度抗性的自然杀伤细胞(Natural Killer Cell,NK细胞),现有方法仍存在着递送效率不足、转染通量低、细胞损伤大、不适用于悬浮细胞等问题,这在一定程度上阻碍了细胞免疫疗法的快速发展。
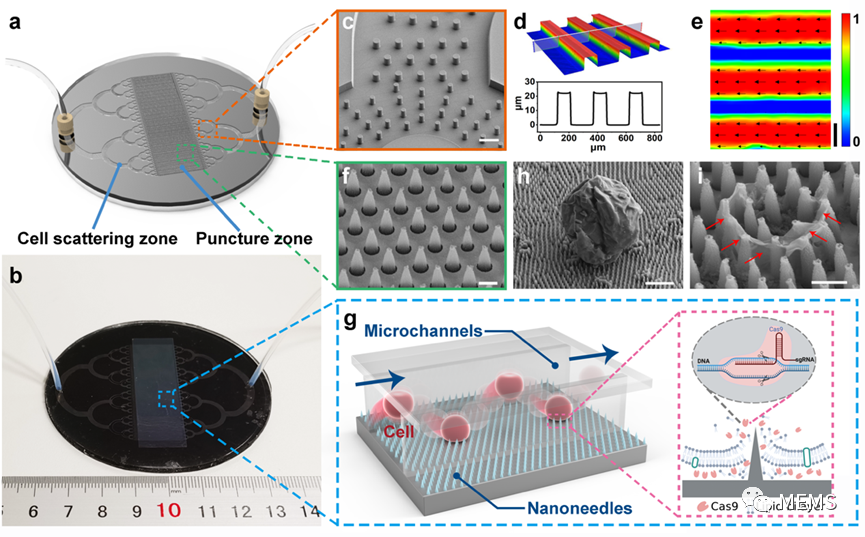
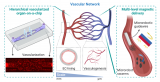
振动辅助纳米针/微流体复合胞内递送系统
针对上述问题,清华大学机械系课题组基于组内提出的张力梯度诱导胶体颗粒液气界面快速大面积自组装制造技术,以密排有序胶体颗粒自组装结构作为模版替代了传统精密复杂的纳米光刻方法,结合刻蚀技术,形成了覆盖面积可达3英寸的表面纳米针结构。进一步研究将纳米针与微流控进行复合,提出了振动辅助纳米针/微流控复合胞内递送新模式,在振动辅助下利用纳米针快速穿刺和脱离微流道中快速前进的细胞,实现了连续的高通量胞内递送。
由于纳米针穿刺破膜的百纳米膜穿孔尺寸,基因编辑Cas9/RNPs复合体可以直接被递送到细胞中,针对难转染的悬浮NK细胞系,胞内递送效率可达98%,细胞活率维持在80%,递送通量可达mL/min量级;且转染总量达50mL时,胞内递送效率仍维持在约90%,具有良好的临床应用前景。
研究基于该系统制备CD96位点敲除的NK-92细胞,敲除效率可达40%,并通过杀伤实验验证了基因编辑后NK细胞免疫效果的有效提升。同时,研究利用该系统成功对小鼠原代NK细胞实现了基因敲入,展现了该方法在以NK细胞等为基础的免疫治疗中的极大潜力。
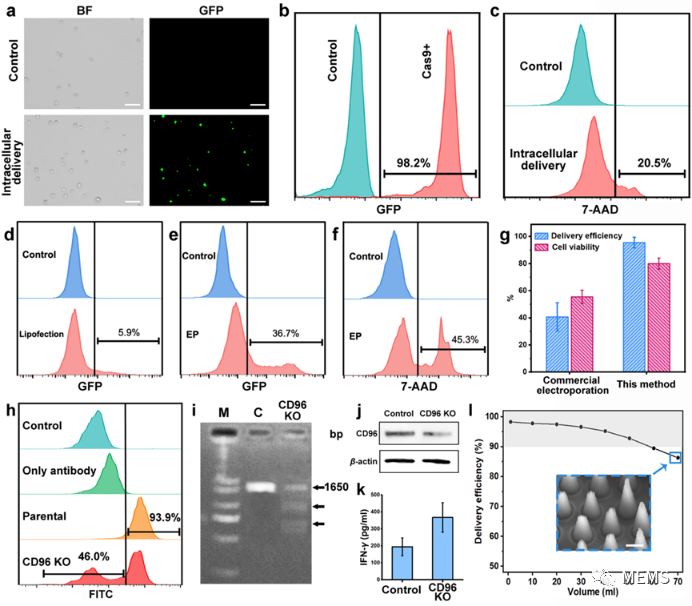
基于振动辅助纳米针/微流体复合胞内递送系统的Cas9/RNPs递送和NK-92细胞系基因编辑

本研究被选为《美国化学会·纳米》期刊封面文章
相关成果近日以“基于振动辅助纳米针/微流控复合系统的高效高通量胞内递送”(High-throughput and efficient intracellular delivery method via a vibration-assisted nanoneedle/microfluidic composite system)为题发表在《美国化学会·纳米》(ACS Nano)期刊,被ACS公众号(ACS材料X)作为亮点文章进行报道,并选为刊内封面文章。
审核编辑:刘清
-
微流控
+关注
关注
16文章
536浏览量
18916
原文标题:基于振动辅助纳米针/微流控复合系统的高效高通量胞内递送
文章出处:【微信号:MEMSensor,微信公众号:MEMS】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐

精密空调—精密空调噪音大及内风机振动如何处理?

高通量生物分析技术之微流控芯片
生物医用微针技术发展历程及其经皮诊疗应用

半侵入式"可穿戴诊所"——微针技术的创新应用
TPIR 785 高通量高灵敏度拉曼光谱仪

拥抱信创,中科通量完成RISC-V等多个指令集架构国产芯片的产品兼容性认证
中国移动浙江公司携手华为完成5G-A高通量UPF全球现网首呼
赋能产业互联网,高通量计算让世界更高效!





 基于振动辅助纳米针的高效高通量胞内递送
基于振动辅助纳米针的高效高通量胞内递送












评论