第一作者:Gustavo M. Hobold
通讯作者:Betar M. Gallant
通讯单位:美国麻省理工学院
【研究背景】
锂金属负极作为当今最引人注目的替代石墨负极的候选者,在满足锂离子电池能量密度(>500 Wh/kg)方面发挥着重要作用,但其还未达到实现长循环寿命和库伦效率(CE)要求。其中,低CE主要源于SEI的不稳定,一个好的SEI不仅能够稳定和保护沉积的Li,还调节电解液和电极之间的Li+传输。因此,SEI对界面的输运和动力学产生深远的影响。然而,迄今为止Li+交换和CE之间的关系还没有明确阐明。
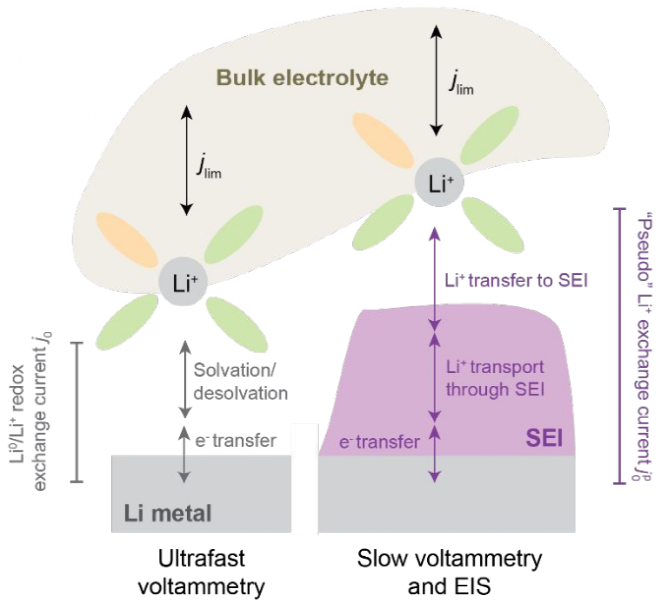
图1. 从电解液体相到锂金属电极的Li0/Li+氧化还原过程的示意图,突出SEI的重要性。
【成果简介】
鉴于此,美国麻省理工学院Betar M. Gallant通过电化学阻抗图谱和循环伏安法,研究了在一系列相关电解液(CE在78%~>99%范围)下原生的SEIs上的Li+交换电流密度(j0)值。在高CE电解液的循环过程中,SEI Li+的交换增加,而对于低CE电解液,保持在低水平,结果表明CE及其在高倍率下的保持率与SEI Li+交换电流呈正相关。此外,高CE电解液特有的Li+交换电流也为第一步电沉积时对Cu电流集流体的作用和有效性提供了见解。总之,这些发现表明Li+交换电流控制着与Li沉积和循环库伦效率相关的几个关键过程,因此,它的量化可以帮助指导未来的高CE电解液设计,尤其是高倍率性能。相关研究成果以“Beneficial vs. Inhibiting Passivation by the Native Lithium Solid Electrolyte Interphase Revealed by Electrochemical Li+ Exchange”为题发表在Energy & Environmental Science上。
【核心内容】
阻抗图谱测定Li+交换
如图2a所示,总结了1.5 M LiAsF6(2-Me-THF)、1 M LiClO4(PC)、1M LiPF6(EC/DEC)、1M LiFSI(FEC)、1M LiPF6(EC/DMC)、2M LiFSI(FEC)和7M LiFSI(FEC)电解液的库伦效率,分别为78%、81.9%、93.8%、95.3%、96.9%、97.5%和98.2%。然后,两种含有添加剂的电解质:1 M LiTFSI(DOL/DME)和2 M LiFSI/1 M LiTFSI(DOL/DME)含有3 wt%的LiNO3,库伦效率分别为为99.0%和99.3%,包括8种不同的溶剂和6种不同的盐。如图2b所示,在电池组装后,在原始状态下进行初始阻抗谱,在OCV下5小时后进行预循环,用蓝色圆圈表示,建立完整的SEI,然后进行完整的沉积/剥离循环。如图2c显示了三种代表性电解液前五个循环中的EIS数据,对应图2a中有颜色的柱状图,图谱都是由高频的半圆和一个低频的尾部组成,与等效电路拟合数据吻合。随着沉积/剥离过程会产生更小的半圆,归因于原始表面膜的破坏和原生SEI的形成。但是经过5次循环后,不同电解质的RSEI值显著不同(如图2d),1.5 M LiAsF6(2-Me-THF)的RSEI值最高为512.6 Ω cm2,其次是1 M LiPF6(EC/DMC)的47.6 Ω cm2和1 M LiTFSI(DOL/DME+3 wt% LiNO3)的18.3 Ω cm2,而基于“伪”交换电流的框架内解释测得的交换率 ,EIS从0.03、0.30到0.79 mA/cm2呈现上升的趋势。
,EIS从0.03、0.30到0.79 mA/cm2呈现上升的趋势。
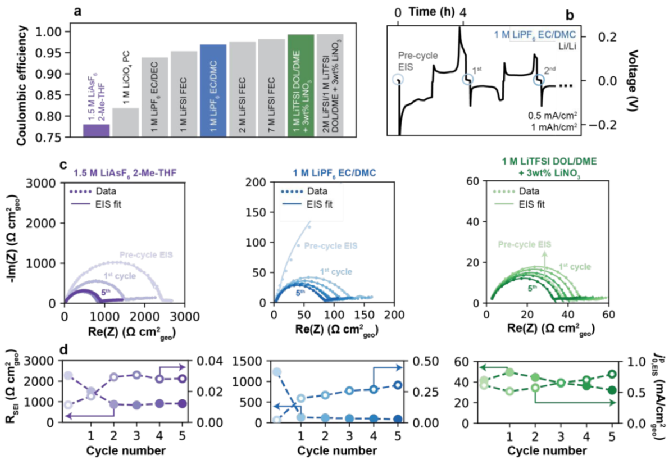
图2. 电化学阻抗谱(EIS)法测定Li+交换。
图3a为每种电解液在高频区超过50圈的 ,EIS,在较长的循环中发现
,EIS,在较长的循环中发现 ,EIS的两种类型。第一种(Ⅰ型)是比较稳定的:1.5 M LiAsF6(2-Me-THF)、1 M LiClO4(PC)、1M LiPF6(EC/DEC)、1M LiFSI(FEC)和1M LiPF6(EC/DMC);第二种(Ⅱ型)是随着循环逐渐增加的:2M LiFSI(FEC)、7M LiFSI(FEC)、1 M LiTFSI(DOL/DME+3 wt% LiNO3)和2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)。
,EIS的两种类型。第一种(Ⅰ型)是比较稳定的:1.5 M LiAsF6(2-Me-THF)、1 M LiClO4(PC)、1M LiPF6(EC/DEC)、1M LiFSI(FEC)和1M LiPF6(EC/DMC);第二种(Ⅱ型)是随着循环逐渐增加的:2M LiFSI(FEC)、7M LiFSI(FEC)、1 M LiTFSI(DOL/DME+3 wt% LiNO3)和2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)。 ,EIS的变化汇总如图3b所示,每圈的平均变化突出了2型电解质下
,EIS的变化汇总如图3b所示,每圈的平均变化突出了2型电解质下 ,EIS的增加。
,EIS的增加。 ,EIS的变化可能有两个来源:(1)SEI内部Li+交换速率的增加,例如化学成分的差异及其在循环中的演变,其中非活性材料的积累不会抑制总Li+的交换速率;(2)由于表面粗糙,Li+/Li0氧化还原的电化学活性区域增加。Ⅰ型电解质对应那些低CE范围,具有多孔和高长径比锂沉积形态(如图3c),即1.5 M LiAsF6(2-Me-THF, CE = 78.9%)和1 M LiPF6(EC/DEC, CE = 96.9%),而Ⅱ型电解液呈现出致密的Li沉积形态(如图3c)。此外,对Ⅰ型和Ⅱ型电解质5次循环后的电镀锂电极的SEM图像进行比较,证实了Ⅰ型电解质具有更高的表面积和更多不规则的沉积物(如图3c)。
,EIS的变化可能有两个来源:(1)SEI内部Li+交换速率的增加,例如化学成分的差异及其在循环中的演变,其中非活性材料的积累不会抑制总Li+的交换速率;(2)由于表面粗糙,Li+/Li0氧化还原的电化学活性区域增加。Ⅰ型电解质对应那些低CE范围,具有多孔和高长径比锂沉积形态(如图3c),即1.5 M LiAsF6(2-Me-THF, CE = 78.9%)和1 M LiPF6(EC/DEC, CE = 96.9%),而Ⅱ型电解液呈现出致密的Li沉积形态(如图3c)。此外,对Ⅰ型和Ⅱ型电解质5次循环后的电镀锂电极的SEM图像进行比较,证实了Ⅰ型电解质具有更高的表面积和更多不规则的沉积物(如图3c)。
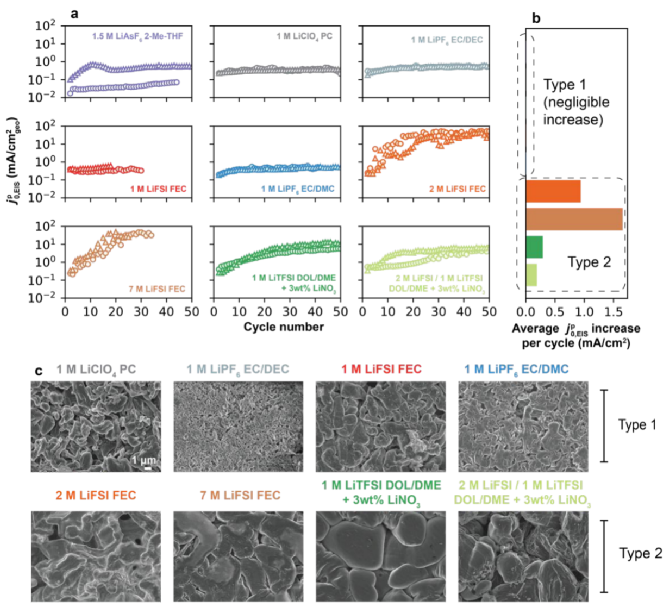
图3. Li+在Li负极上的交换。
进一步探讨高CE电解液中高频Li+交换是否持续增加,如图4a所示,基于DOL/DME的电解质进一步增加了大约10个额外的循环,但 ,EIS的值最终稳定在60个循环左右,如8.3 mA/cm2的2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)和5.7 mA/cm2的1 M LiTFSI(DOL/DME+3 wt% LiNO3)。与低CE电解液(0.39 mA/cm2的1 M LiClO4 PC)相比,这个稳定值要高得多(如图4a)。虽然这种行为的潜在原因还不完全清楚,但一种可能的解释如图4b所示,在低CE电解液中,残留的SEI有低的Li+交换值,在后续循环中,新沉积的Li的优先成核优势不大。而在高CE的电解液中,前一循环的SEI残留物可能在镀锂中保持活性,并可被积聚。如图4c所示,即使在延长循环后,Ⅱ型电解质的Li形态仍然紧密,而Ⅰ型电解质继续发展高多孔的Li微结构。
,EIS的值最终稳定在60个循环左右,如8.3 mA/cm2的2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)和5.7 mA/cm2的1 M LiTFSI(DOL/DME+3 wt% LiNO3)。与低CE电解液(0.39 mA/cm2的1 M LiClO4 PC)相比,这个稳定值要高得多(如图4a)。虽然这种行为的潜在原因还不完全清楚,但一种可能的解释如图4b所示,在低CE电解液中,残留的SEI有低的Li+交换值,在后续循环中,新沉积的Li的优先成核优势不大。而在高CE的电解液中,前一循环的SEI残留物可能在镀锂中保持活性,并可被积聚。如图4c所示,即使在延长循环后,Ⅱ型电解质的Li形态仍然紧密,而Ⅰ型电解质继续发展高多孔的Li微结构。
如图4d所示,在Ⅰ型电解质中,EIS图谱在循环过程中基本保持不变,与它们稳定的Li+交换速率一致,并保持为单个半圆。另一方面,Ⅱ型电解质表现出动态的阻抗响应,如图4e所示,在初始循环阶段,图谱显示为高频的半圆和一个小的低频末尾。在后面的循环中,内部半圆的大小显著减小,这是Ⅱ型电解质中Li+交换增加的基础。而低频末尾变成一个更大、独特的第二个半圆。如图4f所示,低频特征表明在循环过程中可能通过一种额外的机制阻碍Li+交换,抵消了高频下致密SEI阻抗的下降,与电解液中通过多孔电极Li+扩散相关。
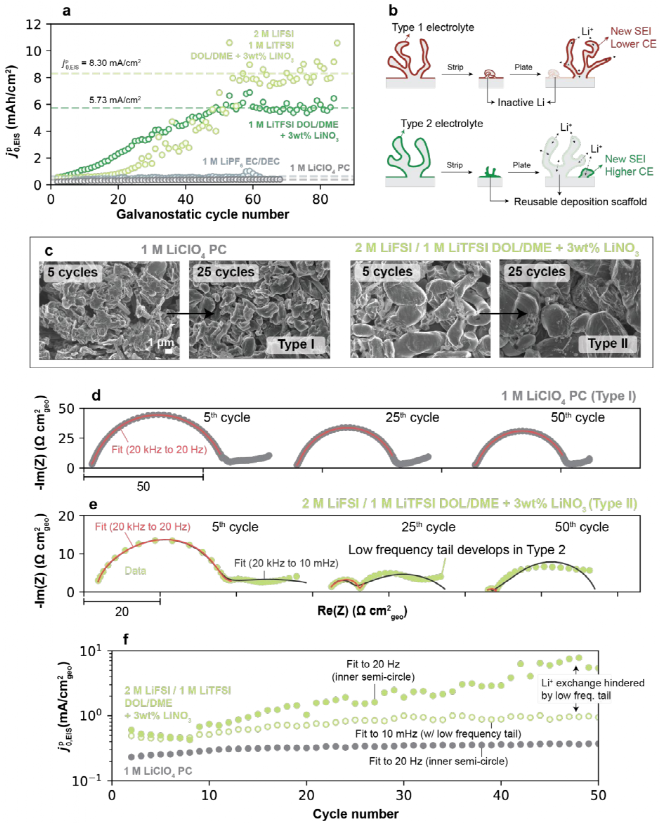
图4. Li+交换延长了恒流循环。
循环伏安测定Li+交换
循环伏安法测量Cu/Li电池,以测量SEI在更接近初始SEI形成的条件下进行Li+交换。如图5a为在-0.2 V到1V之间,以1 mV/s的速度对Cu/Li电池中进行了11个连续的CV循环,每次扫描结束时铜都完全溶出。在1 M LiPF6(EC/DEC)电解液样品中,如图5b为在原始Cu上获得的电流-电压曲线,显示了典型的金属沉积到惰性基底上的行为。在正向扫描中,锂首先被沉积在铜上,在所有循环中都需要一个~100 mV的过电位来开始沉积锂。在反向扫描时,Li继续被沉积在Cu上,直到电压超过平衡电位,之后Li从Cu中被剥离。该方法测定的初始、沉积和完全剥离Cu集电极的Li+交换如图5c所示,1 M LiPF6(EC/DEC)中初始Cu电极的 ,CV是低的(0.02 mA/cm2),但在电极上沉积上Li后大幅增加并稳定在0.26 mA/cm2。在Li被剥离后,与原始Cu电极相比,沉积Li电极的状态更接近于
,CV是低的(0.02 mA/cm2),但在电极上沉积上Li后大幅增加并稳定在0.26 mA/cm2。在Li被剥离后,与原始Cu电极相比,沉积Li电极的状态更接近于 ,CV,即在第1个CV循环中最初为0.40 mA/cm2,在第11个CV循环中稳定在0.19 mA/cm2左右。综上所述,证实了锂沉积行为与表面条件及其来源密切相关。
,CV,即在第1个CV循环中最初为0.40 mA/cm2,在第11个CV循环中稳定在0.19 mA/cm2左右。综上所述,证实了锂沉积行为与表面条件及其来源密切相关。
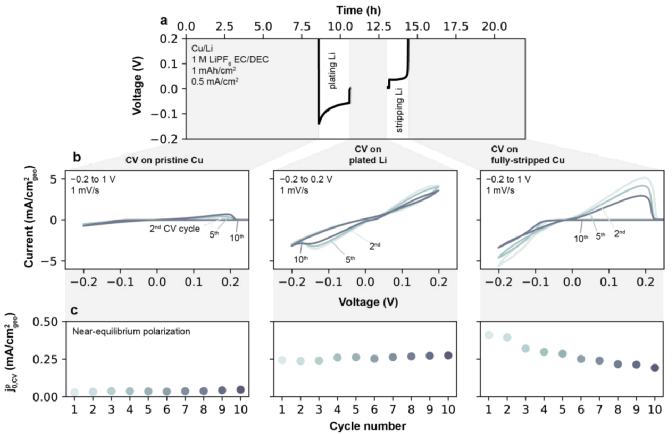
图5. 循环伏安法及Li电镀和剥离的 ,CV。
,CV。
在其他电解液中对锂沉积进行了伏安分析,图6a为三种电解液的Tafel曲线,其中j-Ew越陡,表明接近平衡的关系越高。在高过电位时表现出典型的Tafel行为,即图6a所示的Ew-logj线性行为。如图6b为在所有电解质中CV扫描圈数与 ,CV的函数,第一次扫描
,CV的函数,第一次扫描 ,CV值从非常低0.01 mA/cm2(1.5 M LiAsF6,2-Me-THF)到(2 M LiFSI FEC)的1.21 mA/cm2。在低CE电解质中,
,CV值从非常低0.01 mA/cm2(1.5 M LiAsF6,2-Me-THF)到(2 M LiFSI FEC)的1.21 mA/cm2。在低CE电解质中, ,CV基本不变,而在高CE中,随着CV圈数的增加每次显示出小幅但持续的增加。为了更系统地评价,设计用于测量的Li/Li电池中进行了额外的实验,并在等效循环容量的相同电池中进行了测量
,CV基本不变,而在高CE中,随着CV圈数的增加每次显示出小幅但持续的增加。为了更系统地评价,设计用于测量的Li/Li电池中进行了额外的实验,并在等效循环容量的相同电池中进行了测量 ,CV和
,CV和 ,EIS,在这些条件下,表现出出良好的定量对应关系(如图6c-d)。值得注意的是,图6a-b中的锂沉积测试,在所有扫描结束时,在
,EIS,在这些条件下,表现出出良好的定量对应关系(如图6c-d)。值得注意的是,图6a-b中的锂沉积测试,在所有扫描结束时,在 ,CV和CE之间观察到成正相关(如图6e-f),表明快速Li+交换是区分高与低CE电解液的一个关键特性。
,CV和CE之间观察到成正相关(如图6e-f),表明快速Li+交换是区分高与低CE电解液的一个关键特性。
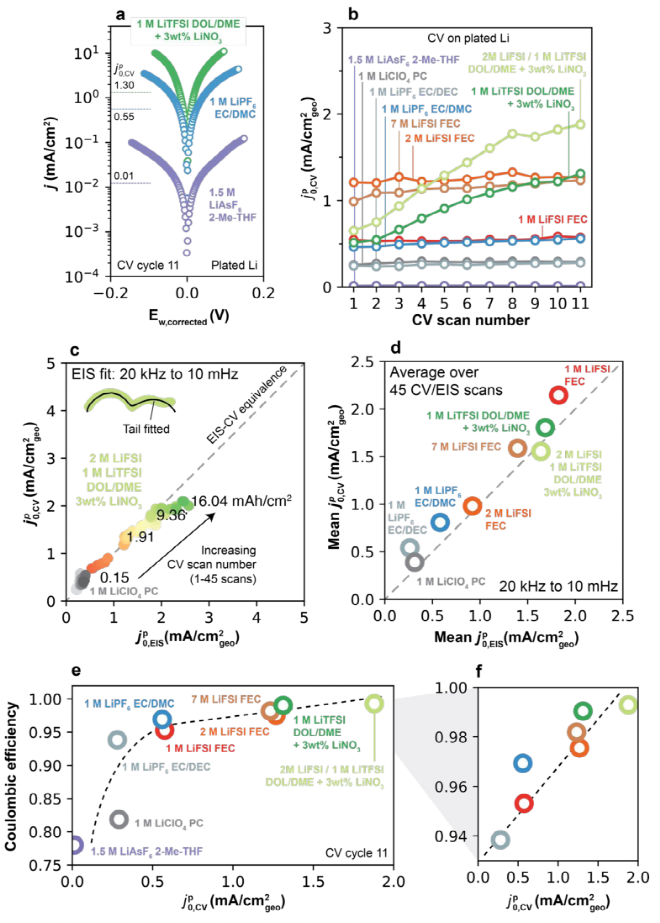
图6. 通过伏安法在沉积锂上捕捉Li+的交换。
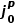 -CE关系的讨论
-CE关系的讨论
图7a显示了所有电解液下初始Cu的前11次CV扫描的 ,CV值,其表现出一定的分散且取决于电解液,但通常较低。如图7b经过1mAh/cm2的恒电流循环,在某些电解液中观察到Li+交换速率的明显上升。图7c-d进一步描述,在11次CV后总结了恒电流循环前和后的
,CV值,其表现出一定的分散且取决于电解液,但通常较低。如图7b经过1mAh/cm2的恒电流循环,在某些电解液中观察到Li+交换速率的明显上升。图7c-d进一步描述,在11次CV后总结了恒电流循环前和后的 ,CV值,首先在1 mAh/cm2沉积步骤之前,Cu没有发现相关性(如图7c),对比沉积后,观察到
,CV值,首先在1 mAh/cm2沉积步骤之前,Cu没有发现相关性(如图7c),对比沉积后,观察到 ,CV与CE之间存在很强的单调趋势。这一发现表明,与Li的趋势相似,高CE电解液也能更有效地改变Cu-电解液界面,图7e充分总结了Cu剥后CE-
,CV与CE之间存在很强的单调趋势。这一发现表明,与Li的趋势相似,高CE电解液也能更有效地改变Cu-电解液界面,图7e充分总结了Cu剥后CE- ,CV的单调关系。
,CV的单调关系。
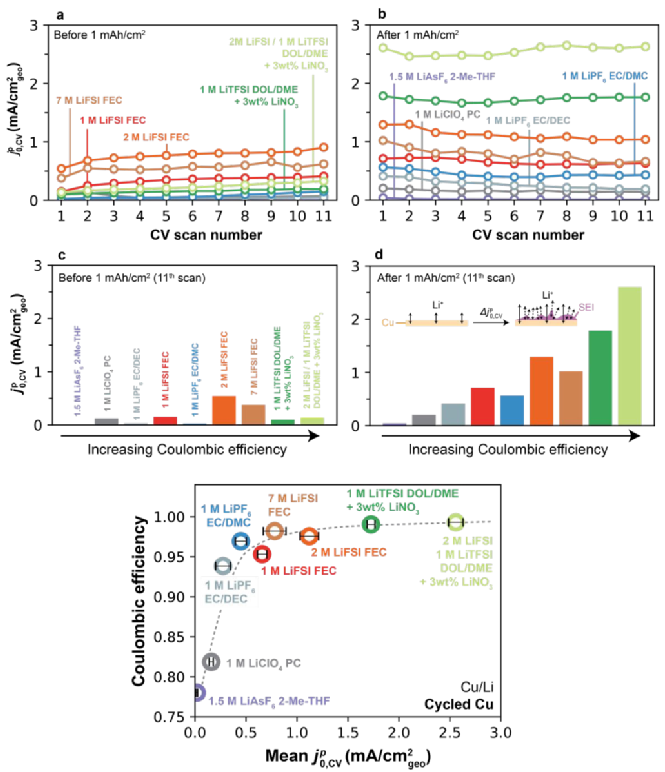
图7. Cu形成循环对Li+交换和CE的影响。
图8a为1 M LiPF6 EC/DEC(Ⅰ型电解液),图8b为2 M LiFSI/1 M LiTFSI DOL/DME+3 wt% LiNO3(Ⅱ型电解液),其来自图7a-b中CV扫描。首先观察Ⅰ型电解液(如图8a),随着 ,CV循环从1到10,每圈的CE单调增加。在1 mAh/cm2恒流循环后,
,CV循环从1到10,每圈的CE单调增加。在1 mAh/cm2恒流循环后, ,CV增加到更高的值,伴随CE的改善,在Ⅱ型电解液中观察到类似的行为(如图8b)。这些结果与之前关于这两个参数的关系一致,表明在每个周期的中CE与Li+交换密切相关。
,CV增加到更高的值,伴随CE的改善,在Ⅱ型电解液中观察到类似的行为(如图8b)。这些结果与之前关于这两个参数的关系一致,表明在每个周期的中CE与Li+交换密切相关。
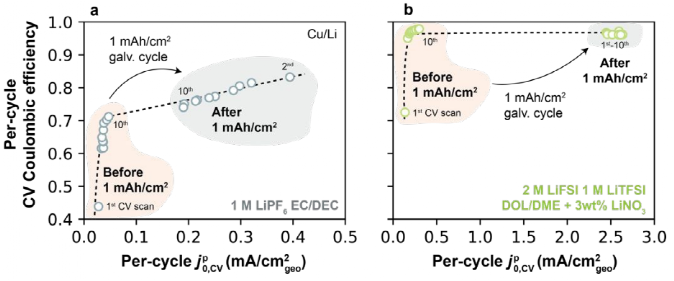
图8. 在不同电解液下恒流充放电前后每圈的CE和 ,CV。
,CV。
对Li倍率性能的影响
研究了不同电解质中Li+交换对可获得的速率能力的影响,如图9所示,在Ⅰ型和Ⅱ型电解质中CE和电流密度的函数关系。Ⅰ型碳酸盐电解质(1 M LiPF6 EC/DEC和1M LiClO4 PC)的CE随电流密度的增加而不稳定,在高电流密度时CE值普遍下降。在1 M LiClO4 PC中最为明显,在0.2 mA/cm2和2 mA/cm2之间CE从87.1%下降到76.9%。而Ⅱ型电解质(2 M LiFSI FEC、M LiTFSI DOL/DME+3 wt% LiNO3和2 M LiFSI/1 M LiTFSI DOL/DME+3 wt% LiNO3)的CE值随循环电流密度的增加不发生变化。与Ⅰ型电解液相比,Ⅱ型电解液在持续循环中表现出可变的Li+交换,这一因素可能会增强其高速率良好循环的能力。
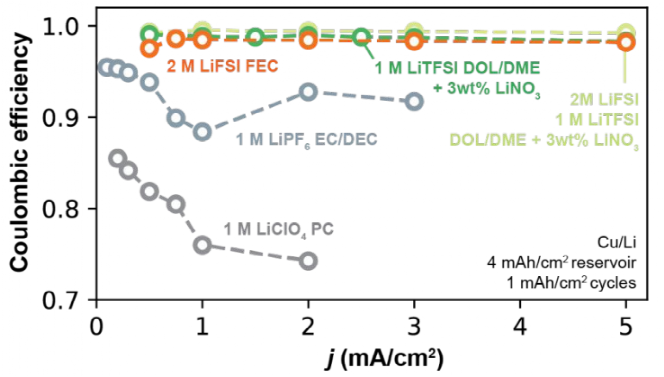
图9. 不同电解液在不同电流密度下的CE。
【结论展望】
本文利用EIS和CV两种电化学技术,研究在低CE和高CE电解液下形成的Li SEIs中进行的Li+交换,为Li+交换率的定量提供了独特但互补的方法。低CE电解液中表现出稳定和适度的Li+交换速率,高CE电解质表现出更高的总Li+交换率,并在循环过程中进一步增加。结果发现CE和Li+交换电流之间存在紧密的正相关关系,从而表明快速Li+交换的电解液与高CE相关。此外,结果还表明与循环后的Cu相比,未循环Cu上的Li+交换更缓慢,原始Cu上的CE相应更低,为在第一个沉积锂步骤中发生的潜在过程提供了见解。最后,这些发现有助于电解液设计的新框架,以最大化SEI相,促进便利的Li+交换,对Li+交换和可逆性产生深远的影响。
审核编辑:刘清
-
锂离子电池
+关注
关注
85文章
3264浏览量
78132 -
SEM
+关注
关注
0文章
247浏览量
14582 -
电解液
+关注
关注
10文章
859浏览量
23281 -
OCV
+关注
关注
0文章
25浏览量
12599 -
EIS
+关注
关注
0文章
27浏览量
8917
原文标题:美国麻省理工学院EES:Li+交换电流密度和CE关系如何?最佳SEI该如何设计?
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
高临界电流密度固态电池单晶锂的合成

北大潘锋/杨卢奕团队Matter:原位光交联构建弹性e-/Li+传输网络以稳定SiOx电极界面
超声波焊接有利于解决固态电池的枝晶问题
清华大学深研院吕伟EES:聚二甲基硅氧烷涂层稳定铝金属负极
bq2431x DSJ EVM (HPA251)用于Li+充电器前端保护IC指南

磁化电流密度和传导电流密度的关系
逆变器输入电流和输出电流的关系
SEI异步通讯—多摩川协议支持

过电压和过电流保护IC和Li+充电器前端保护IC bq2431x数据表

过电压和过电流保护IC和Li+充电器前端保护IC bq24300和bq24304数据表





 Li+交换电流密度和CE关系如何?最佳SEI该如何设计?
Li+交换电流密度和CE关系如何?最佳SEI该如何设计?










评论