引 言
锂离子电池(LIBs)作为电化学储能设备已经取得了实质性的进展。新电池系统的实施总是受到不利的电极/电解质界面反应的阻碍。因此,迫切需要优化电解质以适应不断发展的电池系统。电解液作为锂离子电池中不可或缺的部分,在新型电极材料的应用和储能系统的设计中起着至关重要的作用。重要的是,阴离子衍生的界面化学策略刷新了电解液体系,并推动传统LIBs和新电池化学的重大进展。通过在Li+溶剂化结构中引入阴离子,如高浓度电解液(HCEs)、局域高浓度电解液(LHCEs)、弱溶剂化电解液(WSEs),可以合理调控界面成膜过程。
然而,合适的阴离子数量有限,溶剂在确定阴离子衍生的界面化学中起着至关重要的作用。迄今为止,电解液的设计和选择主要是基于实验。这种传统的电解液设计试错过程,会导致一个漫长而复杂的研究周期。通用溶剂描述符的开发将有助于加速功能化电解液的发展,目前仍然是一个挑战。本工作,我们统计分析了大量有机溶剂分子的表面电荷性质,并总结了其中的规律。目的是为电解液的溶剂选择提供一种简便的方法,为电解液工程设计提供一个清晰的图像。
成 果 简 介
课题组在期刊Advanced Energy Materials上发表题为“Electrostatic Potential as Solvent Descriptor to Enable Rational Electrolyte Design for Lithium Batteries”的研究性文章。该文章以目前电解液研究体系中涉及的有机溶剂为对象,分析了其表面电荷性质。总结了溶剂电荷特征与电解液溶剂化结构设计的关系。本研究提出静电势(ESP)可以作为溶剂选择的直接和简单的描述符,辅助设计电解液。该结果有助于对先进电解液新的理解和设计,促进利用人工智能/机器学习开发高性能电解液。
正 文 导 读
锂电池电解液的基本成分包括有机溶剂,阴离子和锂盐。理想的溶剂应克服阳离子和阴离子之间的电子相互作用来溶解盐。基于对溶剂化学的理解,在电解液体系设计中,通常使用介电常数(ℇ)或给体数(DN)代替极性来评价溶剂溶解锂盐的能力。如图1,这两个参数在使用过程中存在一定的局限性。例如氢氟醚类反溶剂和极性溶剂(乙二醇二甲醚,DME)的差不多;1,4二氧六环(1,4-DX)和乙腈(AN)的DN值差不多,但它们对锂盐的溶解,参与溶剂化的能力却大不相同。
因此,非常需要一个能全面反映溶剂溶解能力的理化参数来指导电解液设计。但阴离子和溶剂都作为配体构成溶剂化结构,因此不同的阴离子会显著影响溶剂与Li+的配位。由于不同的阴离子相互作用模型的复杂性,本文希望简化模型并进行全面的讨论。因此,只选用LiFSI作为电解液的主盐。在该模型中(Li+-solvent-FSI-),无论FSI-是否参与溶剂化结构,不影响不同溶剂之间的竞争配位能力的比较。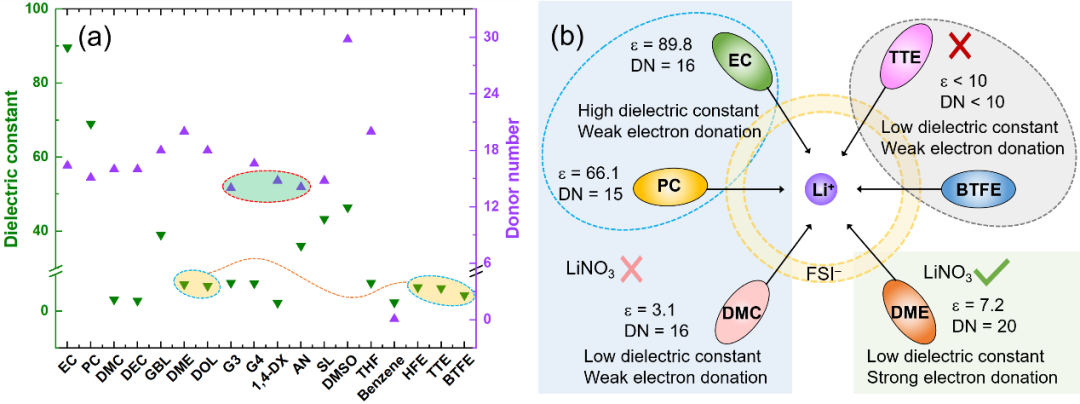
图1. (a)锂离子电池电解液溶剂的介电常数和给体数。(b)几种典型溶剂的介电性质、给电子能力和溶盐能力之间的关系示意图,以上讨论是在以LiFSI为主要盐的情况下进行的。在电解液体系中,溶剂分子可以作为电子供体与Li+配位,供体单元具有强的负表面静电势。图2列举了几种电解液体系常用的几种溶剂化溶剂(醚类,酯类,环丁砜,乙腈等)和反溶剂(氢氟醚,二氯甲烷)的ESP图。可以看出溶剂化溶剂和反溶剂的ESP特征存在明显差异,溶剂化溶剂的负电荷主要集中在氧原子和氮原子上,产生了比反溶剂更强的负电势。
对于溶剂化溶剂,最低静电势绝对值(|ESPmin|)远高于其最高静电势(ESPmax),也就是|ESPmin| » ESPmax。而反溶剂的ESP表现出相反的趋势,|ESPmin| « ESPmax,主要是因为氟原子的存在导致氧原子表面负电荷的分散,几乎均等地分布在氧原子和氟原子上。这意味着反溶剂不是一个令人满意的电子供体,这也暗示了反溶剂不参与溶剂化壳层。因此,我们认为根据分子的静电势特性来指导功能电解液的设计是可行的。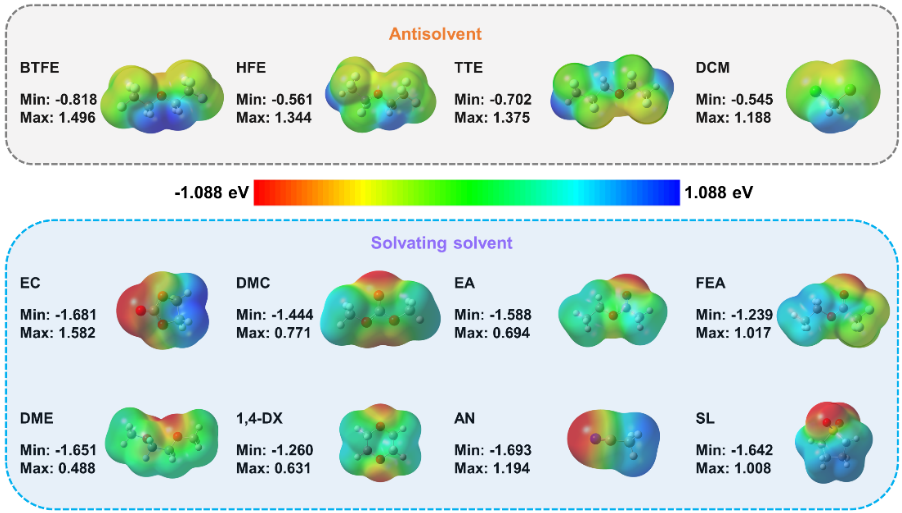
图2. 真空条件下有机溶剂表面静电势图为了验证ESP规则的普适性,我们使用ESPmin和ESPmax对众多溶剂分子进行统计分析。如图3a所示,溶剂的分布很有规律性。氢氟醚(HFE)是一类典型的反溶剂,已被证实能抑制锂枝晶,使锂金属电池具有较高的循环稳定性。
此外,二氯甲烷(DCM)作为反溶剂,成功提高了金属锂电池的低温性能。这些抗溶剂均位于图3a的左上角(绿色阴影),它们的ESPmin值较低,即|ESPmin| « ESPmax。此外,苯和1,2-二氟苯(dFBn)也是一种对Li+亲和力较低,可以作为稀释剂的新型反溶剂。苯甲醚是一种添加剂来防止锂离子锂中的过充,其对锂盐的溶解度也很低。可以看出,这类芳香族溶剂(紫色阴影)的特点是低的|ESPmin|和ESPmax。因此,溶剂表现出弱的ESPmin表明它不是优秀的电子供体,不利于锂盐的溶解,是其成为合适的反溶剂的主要特征。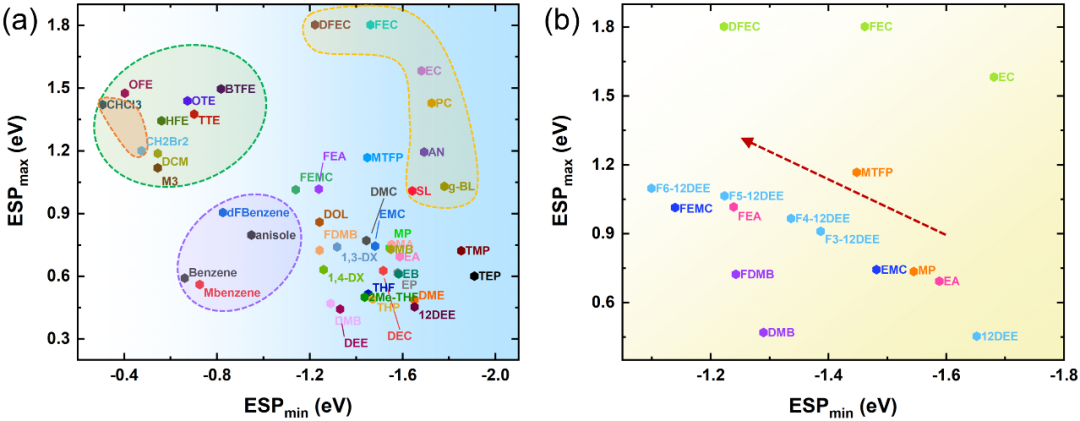
图3. 真空条件下用于锂电池电解液的有机溶剂静电势(a), (b)氟化溶剂的静电势变化规律。在非水电解液中,溶剂与阴离子溶剂化的竞争行为决定了Li+的溶剂化结构。在传统的1 M LiPF6碳酸酯电解液中,主要的溶剂化结构是只有溶剂参与Li+溶剂化鞘,并形成溶剂分离离子对(SSIPs)。然而,对于WSEs即使在低浓度下也可以形成接触离子对(CIPs)和聚集离子对(AIPs)。常规溶剂主要分布在图3a的右侧,表面静电势存在很强的负值。碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、乙腈(AN)等强极性溶剂(黄色阴影)的正、负表面静电势都比较强且|ESPmin|≈ESPmax。
而对于乙醚(DEE)、1,2-二氧基乙烷(12DEE)、1,3-二氧戊环(DOL)和1,4-dx等弱溶剂,ESPmax显著降低(|ESPmin| » ESPmax)。虽然使用ESPmin和ESPmax测量极性是不准确的,但它仍然是一个有用的参考。对于弱极性溶剂,ESPmax的变化可以代表极性的变化。更具体地说,如果ESPmin相似,ESPmax越高,电荷分离程度越高,从而导致极性越强。这样的观察结果可以合理地解释Li+的溶剂化结构。更负的ESPmin使溶剂更易与Li+配合,而ESPmax的变化表明分子极性的波动。
对于弱溶剂化溶剂,低ESPmax意味着极性低,在低浓度时阴离子更倾向于与Li+结合形成CIPs或AIPs。图3b显示了EC、乙酸乙酯(EA)、丙酸甲酯(MP)、1,2-二氧基乙烷(12DEE)及其氟化衍生物的ESP。值得注意的是,含氟溶剂的ESPmin的比本征溶剂的负电荷大,这说明氟原子削弱了配位溶剂对Li+的亲和力,可以促进Li+的脱溶化过程。因此,我们可以通过ESPmin ESPmax图大致区分反溶剂、强溶剂化溶剂和弱溶剂化溶剂。此外,我们计算了几种从未被用作LIBs电解液溶剂的溶剂分子的ESP,如三氯甲烷(CHCl3)、二溴甲烷(CH2Br2)和甲苯(MBenzene),它们表现出与DCM或二氟苯等反溶剂类似的电荷分布特征,可以被认为是未来的反溶剂候选分子。
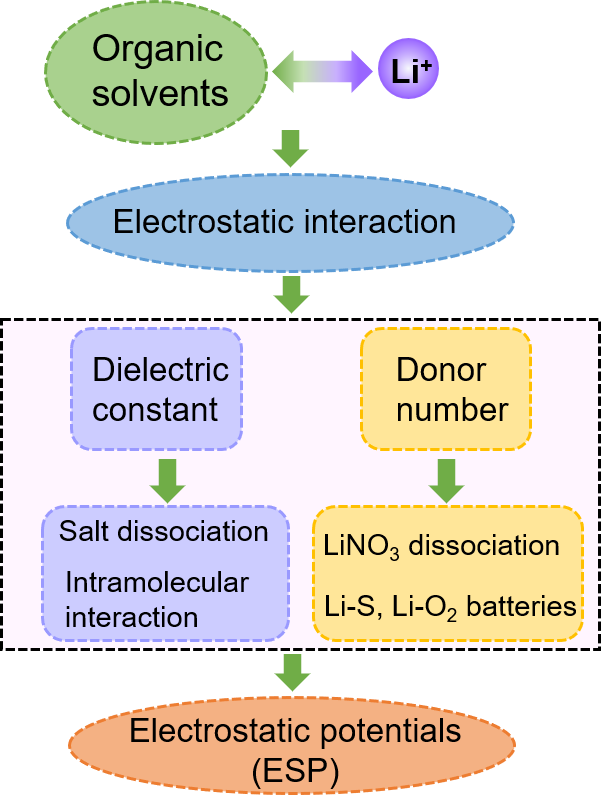
图5. 选择静电势作为描述符的基本思路。图5阐述了选择ESP作为描述符的基本思路。对于锂电池电解液,溶剂分子与离子的相互作用主要是通过静电相互作用产生的。介电常数和供体数都提供了关于供体和受体之间静电相互作用的信息,但每一个都有自己的重点。侧重于描述分子在电场中的电荷极化,而DN则反映了溶剂化物中富电子吸引Li+的能力。EPS描述了分子表面具体位置的电荷和密度,可以用来表征溶剂化物与Li+之间的微观相互作用。
结 论
综上所述,本工作系统研究了电解液工程中溶剂的表面静电势,阐明了溶剂的表面电荷特性。生成的ESPminESPmax溶剂图有明显的分布规律。计算结果表明,反溶剂的表面电荷分布特征为|ESPmin| « ESPmax。应用这一规律,我们预测了几种可能成为下一代反溶剂的候选分子。此外,表面ESP的变化可以用来比较溶剂参与溶剂化的强度。溶剂化溶剂起到电子供体的作用与Li+配合,ESPmin的降低表明溶剂化能降低。这一结果使我们能够筛选反溶剂、强溶剂化溶剂和弱溶剂化溶剂。因此,分析溶剂的ESP是筛选溶剂和调节溶剂化结构的一种简单方法。
审核编辑:刘清
-
锂离子电池
+关注
关注
85文章
3241浏览量
77723 -
ESP
+关注
关注
0文章
184浏览量
33960 -
电解液
+关注
关注
10文章
848浏览量
23124 -
机器学习
+关注
关注
66文章
8419浏览量
132675
原文标题:何向明课题组王莉AEM:简易溶剂描述符助力电解液AI&机器学习
文章出处:【微信号:Recycle-Li-Battery,微信公众号:锂电联盟会长】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
水系电解液宽电压窗口设计助力超长寿命水系钠离子电池
直面行业痛点,引领行业发展 -比创达 “AI&;amp;EMC,电磁兼容” 高峰论坛圆满落幕

onsemi LV/MV MOSFET 产品介绍 &amp;amp; 行业应用

镍氢电池的电解液是什么
二维PDMA可以使用描述符链吗?
新宙邦拟在美国投建10万吨/年电解液项目
新宙邦美国路易斯安那州碳酸酯溶剂和锂离子电池电解液项目启动
FX3无法设置最小/最大比特率描述符值,为什么?
弱溶剂化少层碳界面实现硬碳负极的高首效和稳定循环





 简易溶剂描述符助力电解液AI&机器学习
简易溶剂描述符助力电解液AI&机器学习












评论