双光子显微镜是对深层散射组织进行活体观测不可或缺的仪器,以其远超单光子显微成像的穿透深度而受到生命科学和医学研究的广泛关注。然而,传统双光子显微成像的点扫描成像模式从根本上限制了其成像通量与三维感知速度,极易受复杂活体成像环境干扰,同时激发点巨大的瞬时光强会对活体生物样本造成持续性的非线性光损伤,导致高速三维成像时长严重受限,极大地制约了病理学、免疫学和脑科学的发展。
针对这些难题,2023年5月12日,清华大学戴琼海、吴嘉敏、祁海共同通讯在Cell期刊上发表题为Two-photon synthetic aperture microscopy for minimally invasive fast 3D imaging of native subcellular behaviors in deep tissue 的研究论文。首次提出了基于空间约束的多角度衍射编码,实现非相干光孔径合成;建立了双光子合成孔径显微术(Two-photon synthetic aperture microscopy, 2pSAM),“化点为针”,通过多角度针状光束的扫描在实现高速三维感知的同时,将双光子成像光毒性降低了1000倍以上;融合了戴琼海院士团队2021年同样在Cell期刊上所提出的数字自适应光学架构,具备高速多区域像差矫正能力,即使在恶劣复杂活体环境下依然保持近衍射极限的空间分辨率,并进一步提升了传统双光子成像的穿透深度。基于此,2pSAM能够在哺乳动物深层散射组织中非侵入式地观测大范围亚细胞级动态变化,将毫秒级三维连续观测时长从数分钟提高到数十小时,为系统性地研究大规模细胞在不同生理与病理状态下的交互作用打开了大门。交叉研究团队利用2pSAM在小鼠活体观测到了一系列新现象,包括急性脑损伤后脑组织内周的多细胞互作,神经元在超长时程连续观测下展现出对视觉刺激的表征稳定性与功能多样性,以及首次完整高速记录下了小鼠免疫反应过程中淋巴结生发中心的形成过程,为病理学、脑科学和免疫学的研究打开了新窗口。

传统双光子显微镜使用“点扫描”的方案对三维样本进行扫描,类似于共聚焦荧光显微镜,由于双光子成像的非线性效应使其能够获得数倍于单光子成像的穿透深度。例如,双光子显微镜在小鼠大脑皮层的最大穿透深度可以达到1 mm。然而,这种点扫描方式严重限制了双光子显微镜的三维成像速度与数据通量,并且由于在聚焦点位置极大的瞬时光强带来了非常严重的非线性光损伤隐患。2pSAM采用了轴向景深拓展的“针扫描”方案,通过改变针状光束的不同倾角实现样本三维信息的多角度投影,类似CT一样实现快速三维成像;同时,受到雷达成像中合成孔径方法的启发,通过在像面处引入针孔所带来的空间衍射编码约束,实现了非相干光的孔径合成,将多角度信息融合为大数值孔径对应的高空间分辨率;进一步利用样本的时空连续性先验,有效避免了视角扫描带来的时间分辨率损失。这样一种全新的计算双光子成像架构,在保留双光子本身深层组织穿透能力的同时,将有效成像通量提升了三个数量级以上。
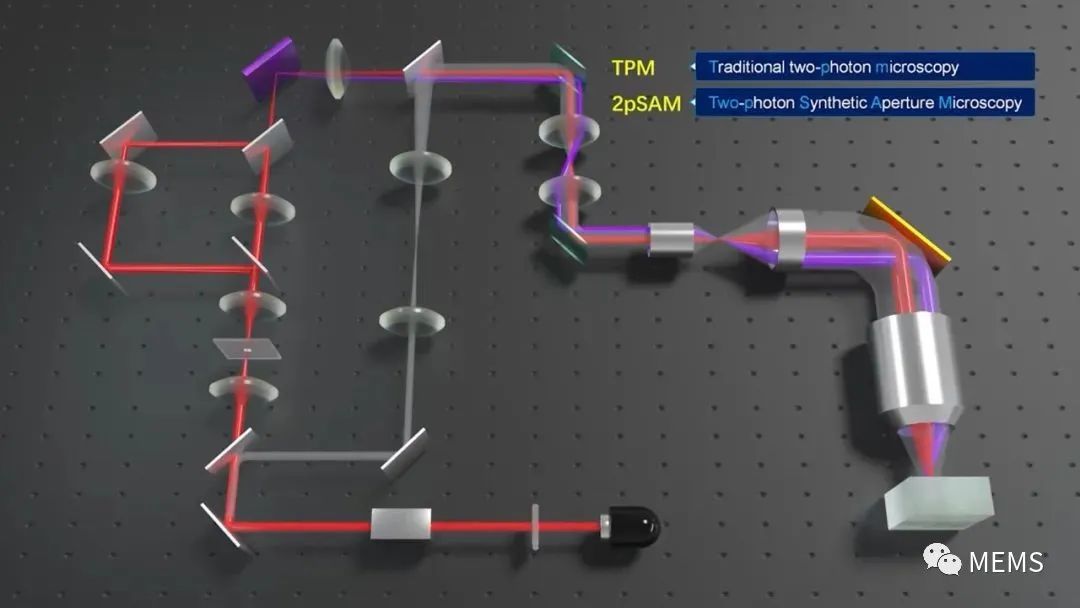
图1双光子合成孔径显微术(2pSAM)系统图
除此之外,样本引起的光学像差给显微成像带来的分辨率与信噪比损失十分严重,随着成像深度的增加这种降质尤为明显。目前双光子成像中的硬件自适应光学技术主要面临着以下一些问题:1、成像系统复杂、成本高昂;2、有效校正视场有限,大视场多区域校正速度缓慢。2pSAM通过激发光编码获得了超精细的四维空间角度光场数据,能够使用数字自适应光学架构(DAO),无需在光学系统中增加额外的波前传感器或者空间调制器,就能实现信号采集与自适应像差校正的解耦,在后处理端完成大范围多区域自适应光学,显著提升在复杂成像环境中的空间分辨率与信噪比。
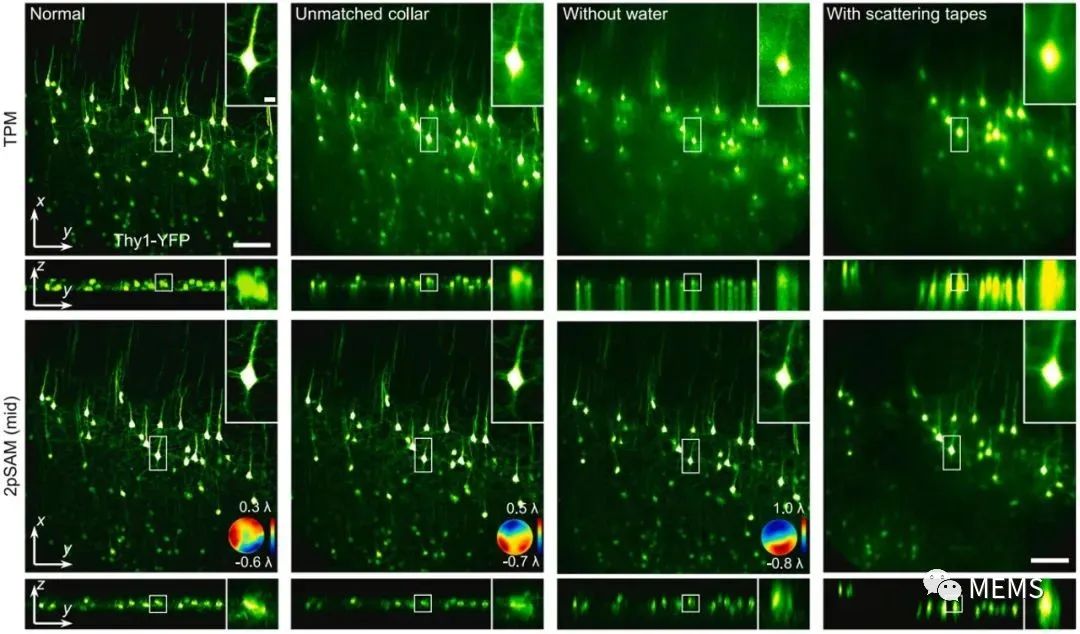
图2 双光子合成孔径显微术(2pSAM)结合数字自适应光学(DAO)与传统双光子显微镜(TPM)面对复杂成像条件下的结果对比。从左至右依次为:正常条件下拍摄,物镜校正环不匹配情况下拍摄,物镜为水镜且缺乏浸润水的情况下拍摄,物镜与样本之间增加散射胶带后进行拍摄。
长时间的激光照射会对活体样本产生严重的光毒性。研究团队发现,传统双光子显微成像由于使用飞秒激光激发与高NA会聚,在样本局部会产生巨大的瞬时光强,由此所产生的非线性光毒性在以往被极大地低估了,而一旦在长时程成像过程中,就会不断积累损伤从而影响细胞正常状态。与之对比,2pSAM化点为针,通过轴向景深拓展,在保持同样荧光激发效率的前提下,将瞬时峰值功率降低了1000倍,从而有效解决了非线性光损伤的问题。一方面能显著减少荧光探针的光漂白,对于同一类易淬灭染料,在同样激发光强下,传统双光子仅能拍摄几十个三维体,而2pSAM能够连续拍摄几十万个三维体而没有明显的信号衰减。除此之外,团队还对小鼠脑皮层中的小胶质细胞与脑损伤过程中的中性粒细胞进行了连续成像测试,发现即使使用较弱的光强,传统双光子显微成像在连续拍摄半小时以上时仍会导致大量细胞凋亡,而在2pSAM成像过程中细胞保持了正常的表型,并且相比于对照组结果无明显差异。团队通过一系列在体与离体实验充分证明了2pSAM能够将传统双光子成像的光毒性下降三个数量级以上,为长时程高速活体组织成像打开了新窗口。
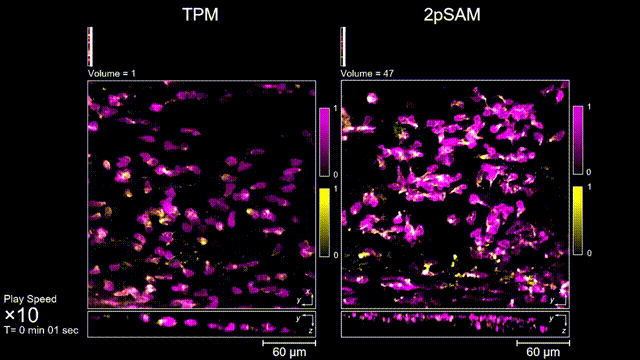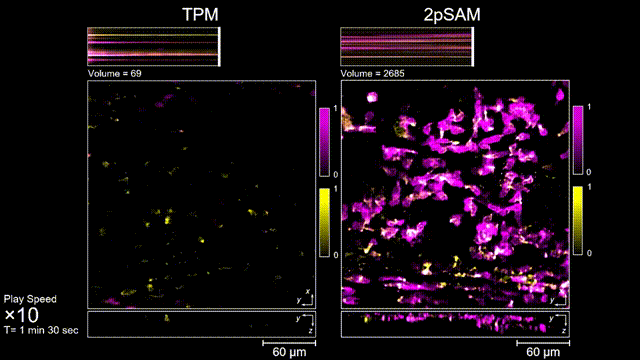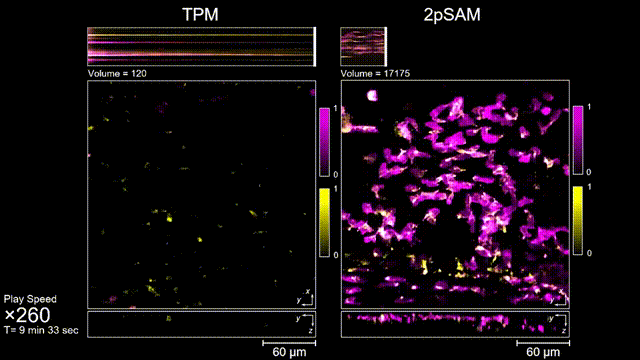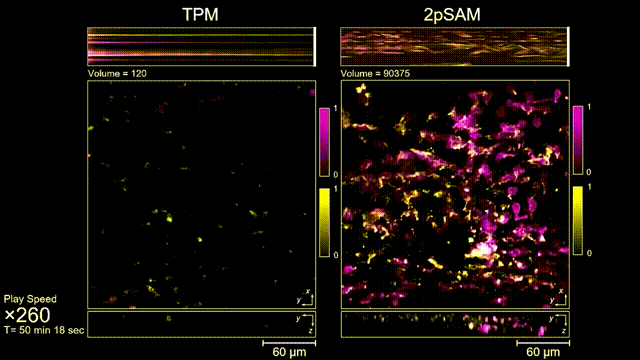
图3 小鼠大脑急性开窗损伤后的皮层免疫细胞成像,TPM(左)与2pSAM(右)光漂白对比。
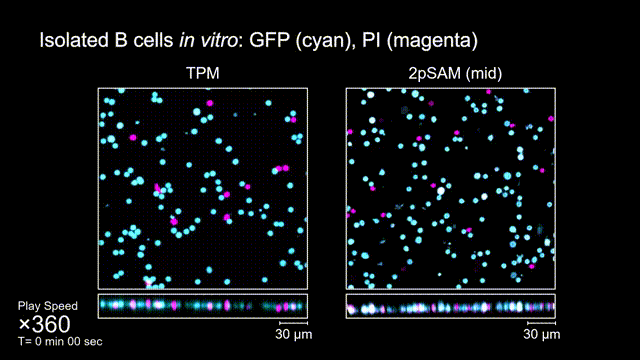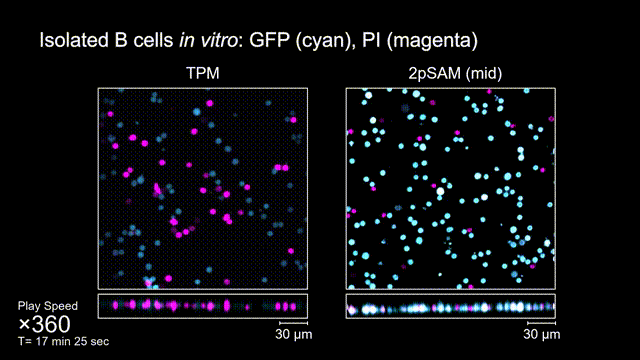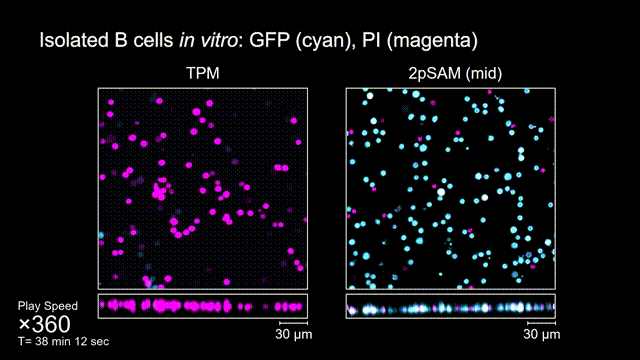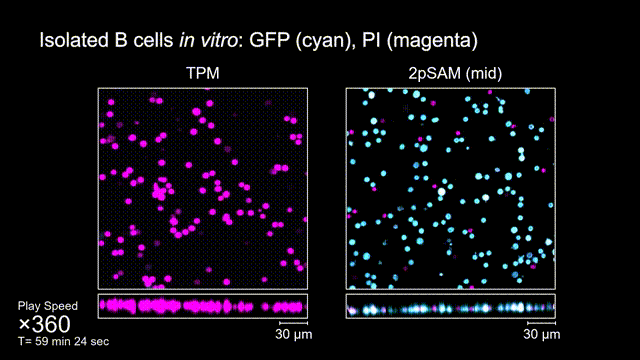
图4 离体B细胞(GFP,蓝色通道)连续拍摄实验:使用PI标记细胞凋亡(红色通道),对比TPM(左)与2pSAM(右)的光毒性。
生发中心(Germinal center, GC)是次级淋巴器官中的动态组织区域,是被抗原激活后的B细胞在趋化作用引导下聚集形成的结构,也是产生高亲和力抗体及形成长期免疫记忆关键场所。但是由于GC形成的随机性和免疫细胞本身对光损伤的敏感性,完整的GC形成过程从未被高速长时间的清晰记录过。借助2pSAM,得以首次完整清晰地观测到了免疫反应下GC形成的全部过程。研究人员将带有荧光标记的抗原特异性B细胞回输到小鼠体内,随后将抗原接种到腹股沟附近以诱导引流淋巴结中生发中心的形成,并于免疫后90到110个小时内(生发中心未形成期),在大视场下持续地对淋巴结中抗原特异性B细胞的动态行为进行追踪,成功揭示了GC形成过程中B细胞的分裂增殖是GC形成的主因,辅助以周围活化B细胞的聚集。由于拍摄时长达十余小时,淋巴结本身会产生剧烈的形变,2pSAM通过多视角信息能够进行实时轴向聚焦位置反馈,实现自动对焦,有效避免了长时程拍摄过程中的样本漂移。
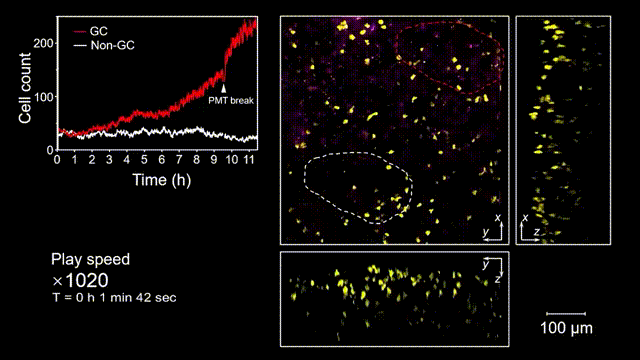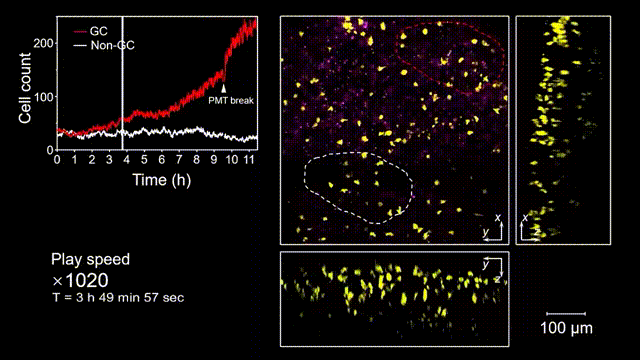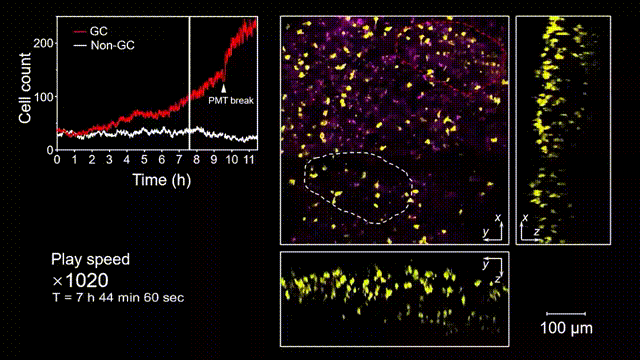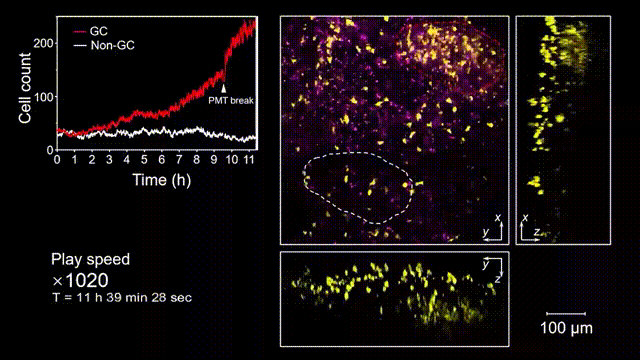
图5 小鼠腹股沟淋巴结免疫反应后生发中心形成过程的完整观测和记录
研究人员进一步借助2pSAM在患有创伤性大脑损伤(Traumatic brain injury, TBI)的小鼠和正在接受视觉条纹刺激的GCaMP转基因小鼠进行脑皮层组织的细胞动态观测。在TBI小鼠受伤区域磨薄颅骨后观测到了外周免疫细胞中性粒细胞在浸润后与内周星形胶质细胞的相互作用,如通过直接接触定向产生迁移体(migrasome)来传递物质和信息。对GCaMP转基因小鼠开颅恢复2周后进行视觉上的条纹刺激,进一步证实了长达数小时内小鼠视觉皮层神经元钙信号对不同方向条纹选择性表达的持续性和稳定性,同时也通过长时程功能数据挖掘出了多种单细胞水平的神经响应类型,体现了神经元的功能多样性。这些现象对于传统双光子显微镜而言都极具挑战,特别是会由于光毒性本身导致会导致细胞异常表现,比如会导致神经元在长时程拍摄过程中响应强度不断下降。
清华大学自动化系博士生赵志锋、周逸亮、医学院基础医学系博士后刘波、自动化系博士后贺敬为该论文的共同第一作者,清华大学自动化系、脑与认知科学研究院、清华-IDG/麦戈文脑科学研究院戴琼海教授,吴嘉敏助理教授,医学院基础医学系祁海教授为论文共同通讯作者,赵家胤、蔡烨怡、范静涛、李欣阳、王紫霖、卢志参与并做出重要贡献。
原文链接:
https://doi.org/10.1016/j.cell.2023.04.016
审核编辑 :李倩
-
自动化
+关注
关注
29文章
5722浏览量
81130 -
显微镜
+关注
关注
0文章
606浏览量
23813 -
神经元
+关注
关注
1文章
368浏览量
18693
原文标题:衍射编码双光子合成孔径显微术,实现深层活体组织时空跨尺度观测
文章出处:【微信号:MEMSensor,微信公众号:MEMS】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
高分辨率合成孔径雷达图像的直线特征多尺度提取方法
合成孔径雷达的工作原理是什么?
怎么实现合成孔径雷达卫星电磁兼容设计?
合成孔径雷达卫星
合成孔径雷达图像处理电子书

合成孔径雷达的研究热点解析
载合成孔径雷达系统的接口实现与设计
合成孔径雷达的工作原理_合成孔径雷达的特点作用
合成孔径成像的原理及发展





 衍射编码双光子合成孔径显微术,实现深层活体组织时空跨尺度观测
衍射编码双光子合成孔径显微术,实现深层活体组织时空跨尺度观测











评论