据统计,2021年全球约有5.37亿成年糖尿病患者,并有超过670万人死于糖尿病,且预计到2045年,全球糖尿病患者数量将达到7亿。目前治疗糖尿病的手段主要有两种:人工注射胰岛素和口服降糖药。口服降糖药容易让患者产生依赖性,从而使得药物的有效性和安全性较低;但是,直接注射胰岛素则容易出现低血糖和体重增加等问题,并且一天多次的注射过程会让患者饱受痛苦,从而导致患者的依从性不高。为了减少频繁注射以及达到更好的血糖控制效果,无创给药以及智能释放的方式受到了广泛关注。
近年来,微针(MN)贴片这种无痛的给药方式已经在美容领域得到应用。微针贴片由数十到数百根长度为数百微米的细针阵列组成,透皮时几乎没有痛觉,也不会留下明显创口,是一种理想的透皮给药方式。微针可以分为实心微针、涂层微针、空心微针、水凝胶微针和可溶性微针等。可溶性微针因为制备过程相对简单、载药量高、材料来源广、生物相容性好等优势在透皮给药方面具有良好的研究潜力,其中的药物被集成到微针的针体内,并随着微针的溶解而释放,药物利用率高,且不产生医疗废物。然而,如果仅仅是将胰岛素集成到可溶性微针上,虽也能提高糖尿病患者的用药舒适性,却无法避免低血糖风险和频繁给药的麻烦。
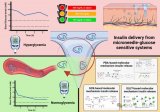
据麦姆斯咨询报道,近期,来自暨南大学的研究人员设计制备了一种基于透明质酸的可溶性微针,并通过负载矿化胰岛素(m-INS)和矿化葡萄糖氧化酶(m-GOx)进一步构建了一个智能给药系统,可以实现血糖浓度信号的自主识别,并控制胰岛素的释放行为,以维持血糖正常,并最终实现糖尿病的有效治疗,具有广阔的临床应用前景。相关研究成果以“透明质酸微针经皮递送胰岛素智能给药系统用于糖尿病治疗”为题发表在《生物工程学报》期刊上。
载药微针的制备
该研究制备的透明质酸(HA)微针阵列的体视显微镜照片和电子显微镜照片分别如图1A和1B所示,微针针体饱满、形状均一,针体高约730 μm、底宽约356 μm,针尖直径约30 μm。随后,研究人员用万能试验机对透明微针的机械强度进行了检测,结果显示,每根微针能承受约0.33 N的力,与合成的聚合物微针机械强度相当,足够刺穿皮肤。随后,研究人员利用矿化胰岛素和矿化葡萄糖氧化酶,制备获得了载药透明质酸微针贴片。万能试验机的检测结果显示,载药微针的机械强度提高到了0.43 N/针。接着,研究人员分别用FITC和Cy5对胰岛素和葡萄糖氧化酶进行了标记,并随后按照同样步骤制备获得了载药透明质酸微针。将获得的载药微针在倒置荧光显微镜下进行观察,结果如图1C-1E所示,微针针体饱满、形态规则,在488 nm激发波长下能看到强烈的绿色荧光,而在546 nm激发波长下能看到强烈的红色荧光,表明FITC-矿化胰岛素和Cy5-矿化葡萄糖氧化酶在微针中分布均匀。

图1 微针显微照片:(A)体式显微镜下的透明质酸(HA)微针;(B)扫描电子显微镜下的透明质酸(HA)微针;(C-E)同时负载FITC-矿化胰岛素(m-INS)和Cy5-矿化葡萄糖氧化酶(m-GOx)的透明质酸(HA)微针
载药透明质酸微针的血糖调控能力
随后,为了评价载药透明质酸微针对血糖的调控能力,研究人员选用4 ~ 6周龄雄性SD大鼠,并按照55 mg/kg的量经腹腔注射链脲佐菌素(STZ)以建立1型糖尿病大鼠模型。研究结果显示,注射后大鼠的血糖持续升高,10 d后平均血糖稳定在21.7 mmol/L左右,明显高于3.9 mmol/L ~ 6.1 mmol/L的正常范围,证明成功构建了1型糖尿病SD大鼠模型。
接着,研究人员将糖尿病大鼠随机分为4组,每组3只,并分别将空白透明质酸微针、负载胰岛素的微针、负载矿化胰岛素的微针以及同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针贴在大鼠皮肤表面。如图2C所示,空白透明质酸微针组和负载矿化胰岛素的微针组的大鼠血糖浓度几乎不变,而负载胰岛素的微针组以及同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针组的大鼠血糖均在1 h内下降到了6 mmol/L ~7 mmol/L。此外,负载胰岛素的微针组在给药6 h后大鼠的血糖水平恢复到了19.3 mmol/L;而同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针组在给药10 h后大鼠血糖仍维持在较低的11.3 mmol/L,且在36 h内大鼠的血糖浓度均低于对照组(空白透明质酸微针组),说明相对于单纯的胰岛素给药来说,同时负载矿化胰岛素和矿化葡萄糖氧化酶的胰岛素智能给药系统降糖药效更持久,药物利用率更高。
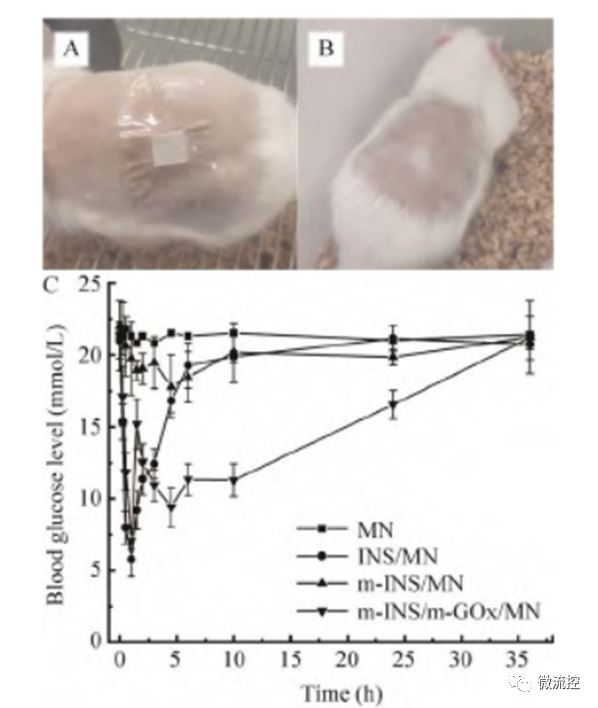
图2 微针给药动物实验:(A)微针给药时的糖尿病大鼠照片;(B)微针给药36 h后的糖尿病大鼠照片;(C)负载不同药物成分的微针降糖效果
同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针给药后糖尿病大鼠的葡萄糖耐受性
将负载胰岛素的微针以及同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针分别作用于3只糖尿病大鼠,1 h后待大鼠血糖接近正常范围后,再腹腔注射1.5 g/kg的葡萄糖溶液,健康组的3只大鼠则直接注射葡萄糖溶液。由图3A可以看出,注射葡萄糖后大鼠血糖均出现升高,其中健康组大鼠血糖在20 min达到14.0 mmol/L的峰值后快速下降,在150 min时恢复到了正常水平,而同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针组的大鼠血糖在40 min时达到16.3 mmol/L的峰值,然后缓慢下降并在150 min后维持在较低水平的11.1 mmol/L左右,而负载胰岛素的微针组的大鼠血糖升高后则一直维持在较高的水平。此外,葡萄糖耐受实验在0 ~ 150 min的血糖浓度曲线下面积积分结果表明,相对于负载胰岛素的微针组,健康组和同时负载矿化胰岛素和矿化葡萄糖氧化酶的微针组的葡萄糖耐受性明显更强。
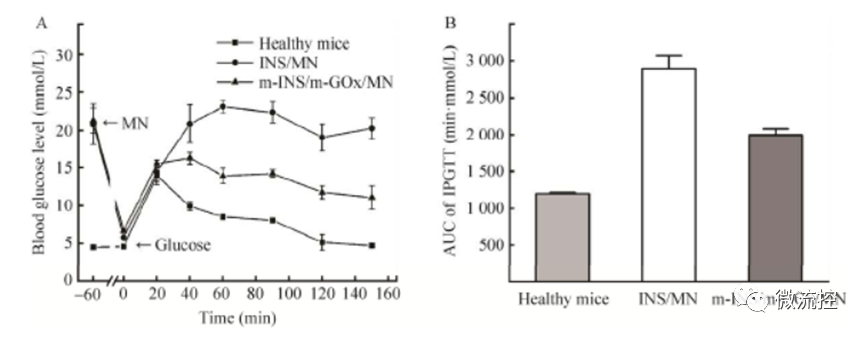
图3 大鼠腹腔内葡萄糖耐受实验:(A)血糖浓度变化曲线;(B)葡萄糖耐受实验的曲线下面积
综上所述,基于载药可溶性透明质酸微针构建的具有血糖响应性的胰岛素智能给药系统具有良好的血糖浓度识别能力和胰岛素响应释放能力,能有效将胰岛素递送到大鼠皮下,从而安全、有效地降低糖尿病大鼠的血糖浓度,提高其葡萄糖耐受能力,不至于引发低血糖风险,具有替代胰岛素注射给药方式应用于糖尿病治疗的潜力。
审核编辑:刘清
原文标题:基于透明质酸微针的胰岛素智能给药系统,用于糖尿病治疗
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
英国将试用AI工具提前预测糖尿病风险
AI护航健康:英国拟试用新工具,预见糖尿病风险
NVIDIA AI技术助力监测糖尿病风险
安森美Treo平台助力打造连续血糖监测仪
一种可以提升动态血糖监测均匀性和精确度的导电油墨
血糖监测仪解决方案
WT2605C蓝牙语音芯片:引领糖尿病管理智能化,优化血糖仪音频与蓝牙传输方案

WT2605C蓝牙语音芯片:引领糖尿病管理智能化,优化血糖仪音频与蓝牙传输方案
X1E000251005900晶振应用于医疗器械血糖仪
三星平泽工厂 P4 二期产线已暂缓建设,歌尔股份预计上半年净利翻倍增长
瑞萨用于连续血糖监测的闭环操作胰岛素泵解决方案




 基于透明质酸微针的胰岛素智能给药系统,用于糖尿病治疗
基于透明质酸微针的胰岛素智能给药系统,用于糖尿病治疗










评论