什么是吸附?
有时候,化学物质会吸附在表面上,这种现象可能发生在气相中的固体表面以及浸没在液体溶液中的固体表面。化学物质在表面上聚集的能力在传感和分离过程中都非常有用,这也是催化反应的一种方式。
粘附在表面的过程称为吸附。请不要将吸附与吸收一词混淆,吸收是指一种化学物质被吸收到固体或溶液中。
BET 多层吸附示意图,这是吸附的其中一种类型。图片由 Life of Riley 提供。在CC BY-SA 3.0许可下使用,通过Wikimedia Commons分享。
吸附可能涉及表面与被吸附物之间的化学键形成(化学吸附)或者涉及表面与被吸附物之间通过氢键或范德华力等分子间作用力产生的吸引(物理吸附)。一般来说,物理吸附分子在表面上更容易发生移动,吸附力也比较弱。
等温吸附
吸附过程可以描述为平衡反应:
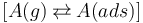
其中,气相中的化学物质 A(g) 称为吸附物:它以一定的吸附速率被吸附,然后以一定的解吸速率进行解吸。
我们如何从数学上描述这个平衡反应呢?最简单的方法之一是美国物理化学家 Irving Langmuir 发现的。在他的模型中,他提出了以下假设:
- 吸附物有一个最大表面浓度csat (mol^-2),在该浓度下表面是饱和的
- 吸附速率常数不依赖于吸附物的表面覆盖率:也就是说,所有吸附点都是相同且相互独立的
- 吸附是一个二阶过程,其速率与邻近表面的本体相中的吸附物浓度以及空位的比例成线性关系
- 解吸是一个一阶过程,其速率与吸附物的表面覆盖率内呈线性
通过这些假设,我们可以将表面上由吸附作用导致的物质通量使用如下公式描述:
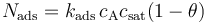
其中 Nads 是表面上的通量 (mol m^2s^-1) ;kads 是吸附速率常数 (m^3 mol-1 s-1);cA 是邻近本体相中表面的浓度 (mol m^-3);θ 是吸附物的表面覆盖率,= cA,ads/csat(无单位),因此(1-θ)是空位的比例。
同样,由于解吸而离开表面的物质通量为:
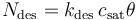
其中,kdes是解吸速率常数 (s-1)。
在平衡状态下,吸附物的表面覆盖率是恒定的,因此吸附在表面和离开表面的通量必须相等。使上面的表达式相等并消去同类项,可以得到:
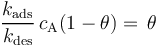
吸附速率常数与解吸速率常数的比率 (kads / kdes)是吸附的平衡常数,通常用大写字母表示为Kads。平衡常数越大,吸附的热力学驱动力越大。然后,通过重新排列上面的表达式,我们将表面覆盖范围表示为:
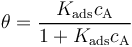
这是 Langmuir 等温吸附。在给定温度条件下, Kads 取某一特定的值,我们可以预测平衡状态下吸附物的表面覆盖范围随其本体浓度变化的情况。
当然,Langmuir 的模型是简单的近似。在真实系统中,通常情况下相邻吸附分子之间存在相互作用,因此随着表面覆盖范围的增加,吸收额外的物质变得更容易或更困难。所以,研究人员开发了更复杂的数学模型来更精确分析真实的吸附系统。需要指出的是 Freundlich 等温吸附模型,其中包含一个额外的经验常数,可以分析吸附分子之间的相互作用。BET 等温吸附模型可用于发生多层吸附的系统,在这样的系统中,吸附分子的第二层和随后的外层与吸附物质的分子结合,而不是与化学基质的下表面结合。
在 COMSOL Multiphysics® 软件中定义吸附
在使用 COMSOL Multiphysics® 软件建立化学物质传递和反应模型时,您可以使用一系列工具在模型中引入吸附效应。
对于均质多孔介质中的吸附,有一个特殊的吸附子节点可用于多孔介质传递属性和部分饱和多孔介质域特征。在这个子节点中,您可以为任何本体物质定义“Langmuir”、“Freundlich”或“用户定义”吸附。这里,我们假设被吸附物质与本体处于热力学平衡状态,因此等温吸附关系完全成立。有关如何使用该吸附子节点的示例,请参见下面的屏幕截图:
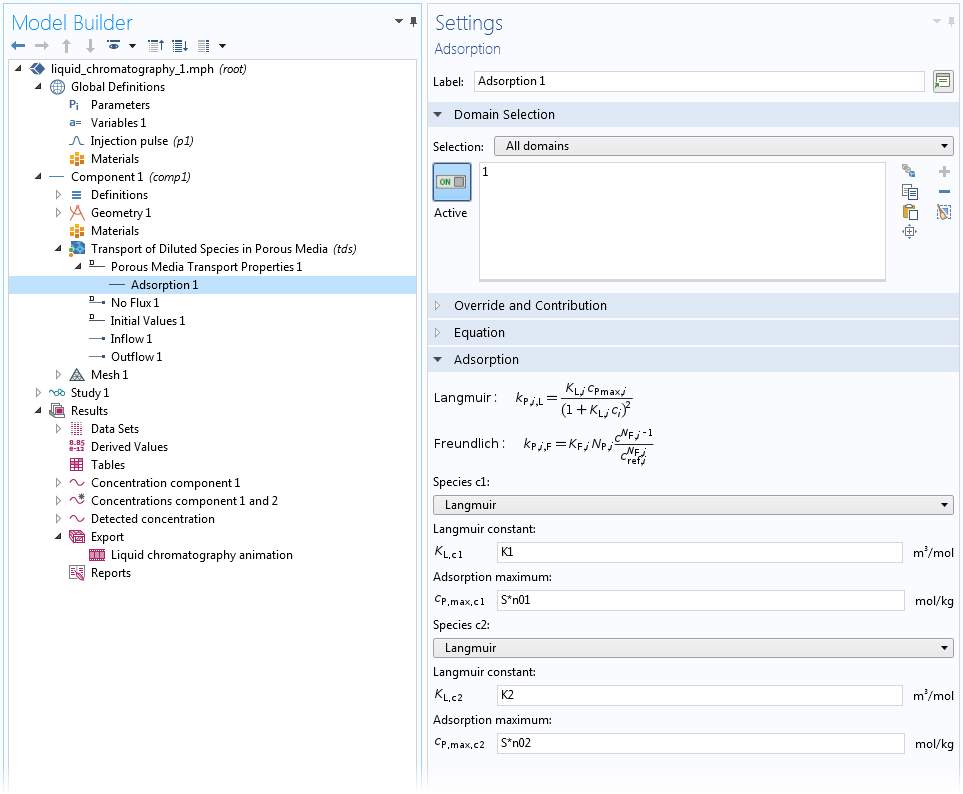
使用 Langmuir 等温吸附的高效液相色谱(HPLC)系统模型中均匀介质上两种物质的吸附设置。
如果吸附或解吸过程是吸附和解吸动力学控制的,使得速率常数变得很重要,并且表面不保持平衡,那么设置中会涉及更多的细节。有必要使用附加的接口来描述吸附物质的表面浓度。正如本系列第一篇文章中所讨论的,您可以使用表面反 接口来描述吸附物质。或者,如果描述多孔介质中的表面分布,可以使用稀物质传递接口,并将该物理中的扩散系数和对流速率场设置为零。
吸附过程表示将物质从本体(气体或液体溶液)相转移到表面的通量。通过在边界添加这样的通量或在均质域中添加反应,可以表达上面所示的吸附反应。此反应的动力学和热力学可以设置为遵循 Langmuir 等温吸附或更复杂的反应机制,包括用户定义的任意形式的动力学表达式。请注意,直接在物质名称后面键入(ads)也可以将吸附物质构建到反应工程或化学接口中定义的反应机制中。
使用自定义的化学反应方程来描述吸附的另一个原因是竞争性吸附的情况,在这种情况下,两种或多种被吸附物质会共享相同的吸附点。这种现象是催化剂中毒的常见原因:由于另一种分子具有较强吸附力,催化剂无法吸附预期的物质,这可能导致反应所需的催化剂永久失活。
涉及吸附的模型示例
在 COMSOL Multiphysics “案例库”中,您可以找到一系列演示不同类型吸附建模的教学模型。
液相色谱法
高效液相色谱(HPLC)系统使用一维模型建模,其中模拟的尺寸代表色谱柱中流动相的流动长度。这里,由两种不同组分的 Langmuir 平衡常数表示的不同吸附平衡导致不同程度的停留时间。由于溶剂的稳定流动与不同的吸附速率的共同作用,导致不同的吸附组分在空间和时间上分离。
这里,结合使用多孔介质稀物质传递接口与吸附子节点来表示平衡吸附过程。
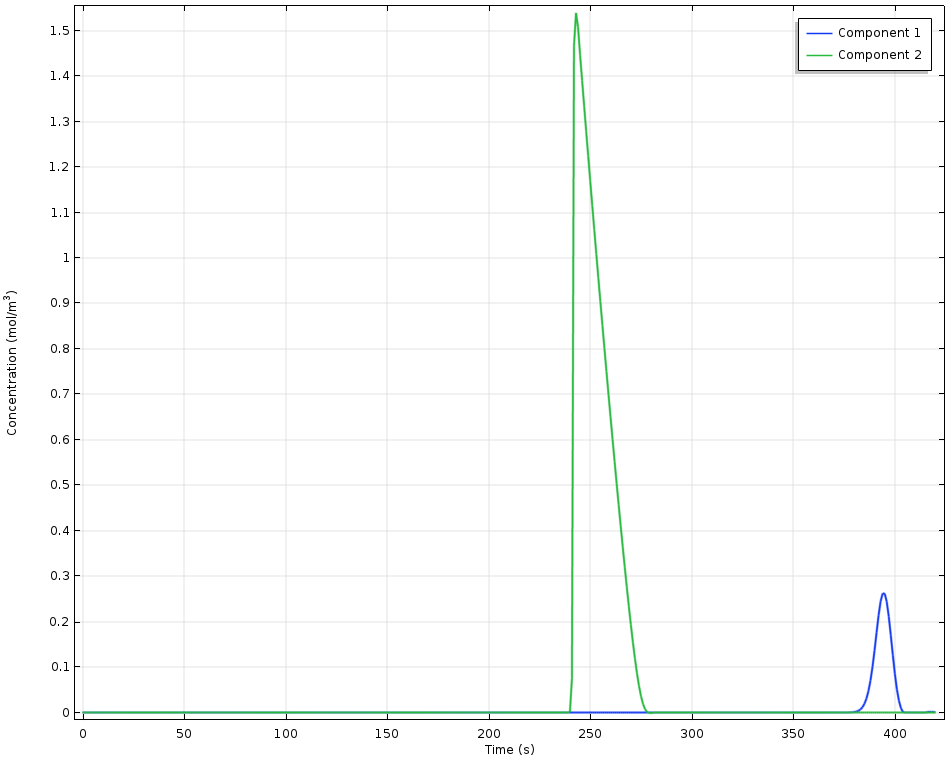
高效液相色谱实验中检测到的浓度随时间的变化。组分 1 具有较高的吸附能力,因此存留时间更长。
蛋白质吸附
在离子交换柱中,蛋白质吸附在柱表面,并置换离子,如前一篇关于蛋白质吸附过程的博客文章所述。化学接口可用于描述多种相互作用蛋白质的更复杂的反应机制,该接口可与稀物质传递接口(用于在溶液中迁移的物质)和表面反应接口 (用于被吸附物质)相耦合。
离子交换柱中的蛋白质吸附。
传递和吸附
在本例中,我们使用稀物质传递接口描述溶液中物质的扩散和对流。同时,化学物质也会吸附在特定边界上的活性中心上。在该边界上,我们使用一般形式边界偏微分方程来表达用户定义的表面覆盖方程。如上所述,该动力学方程基于吸附和解吸速率的 Langmuir 近似,但不假设反应达到平衡。因此,Langmuir 等温吸附本身不一定成立。而吸附和解吸通量则需要动态考虑。
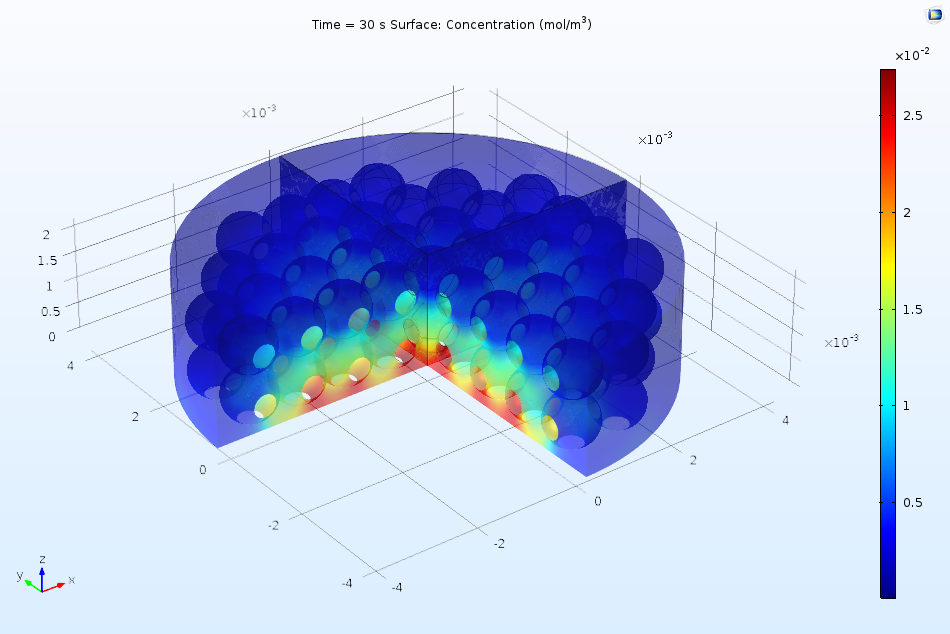
下图显示了溶解的吸附物在活性表面的流动如何使吸附的表面浓度随着时间的推移而逐渐增加。由于浓度在 2 秒后仍在继续上升,很明显还没有达到平衡,因此动力学模型(而不是热力学模型)更适合描述这一表面过程。一般来说,上游(左边)的覆盖率较高,这是因为上游端的流动浓度较高,其中已经发生少量吸附。在下游边缘,由于扩散的边缘效应,表面浓度升高。
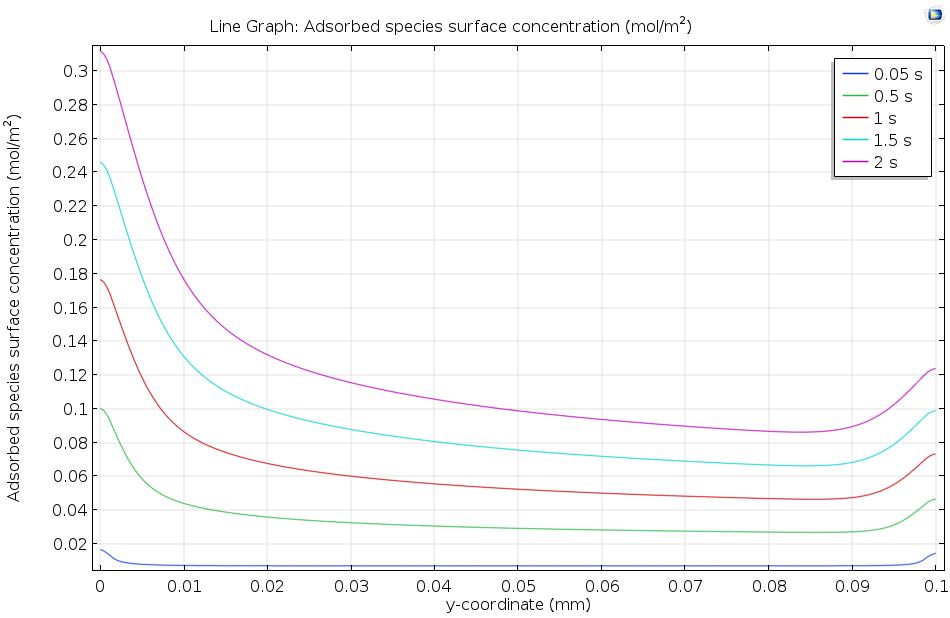
沿活性表面的长度方向绘制吸附物质表面浓度,含有吸附物的溶液在活性表面上流动。随着时间的推移,吸附物质的浓度增加。
关于表面建模的总结思考
希望通过这一系列文章,您能够了解为什么表面对于化学过程如此重要,并了解在 COMSOL Multiphysics 的化学模型中包含表面现象的不同方法。
-
HPLC
+关注
关注
0文章
43浏览量
12729 -
COMSOL
+关注
关注
34文章
93浏览量
55919
发布评论请先 登录
相关推荐
COMSOL Multiphysics在超材料与超表面仿真中的应用
研究级高性能全自动程序升温化学吸附仪
三站全功能型多用吸附仪_物理吸附
电镀废水中镍(活性炭纤维)的电吸附性能实验
电极电位对L - 蛋氨酸分子吸附构型影响的表面增强拉曼光谱
微孔吸附剂在化学存储领域获得潜在应用
硅片表面有机污染物的吸附行为
晶圆的环吸方案相比其他吸附方案,对于测量晶圆 BOW/WARP 的影响
对于具有强吸附性的粉尘样品,在测量电阻率时应采取什么特殊措施





 什么是吸附?在COMSOL中模拟表面吸附
什么是吸附?在COMSOL中模拟表面吸附










评论