关键词:高分子材料,导电高分子材料,胶粘剂(胶水,接着剤、黏结剂、粘接剂),TIM材料
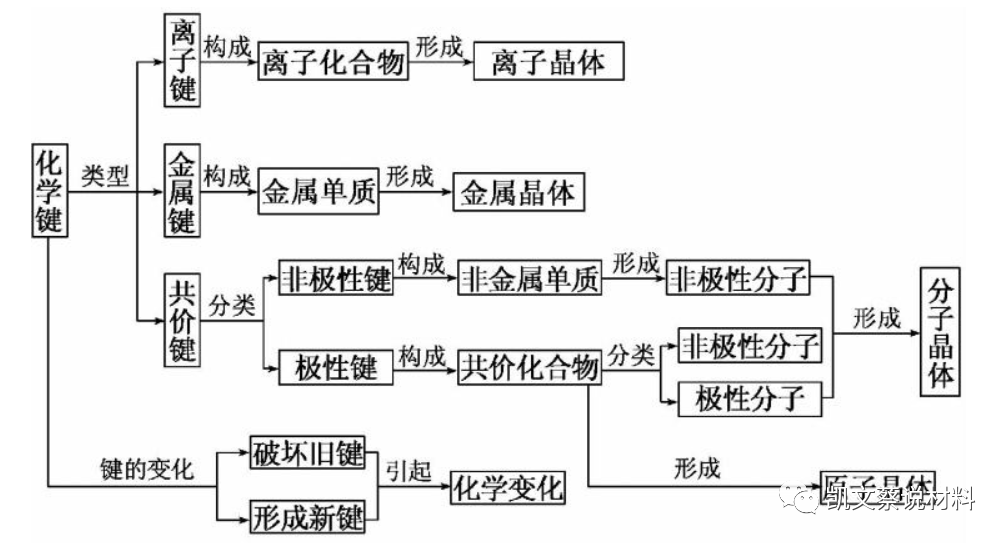
材料按状态主要有三态:气态、液态和固态。液态和固态称为凝聚态。在凝聚态下,原子之间距离很短,产生相互作用力,原子之间便结合在一起,形成了一种结合键。原子结合键是材料的二级结构。材料的性能很大程度上取决于原子间的结合力。结合键共有离子键、共价键、金属键、范德华力和氢键等。可简单分成二大类,结合力强的结合键叫化学键,或称为一次键:如离子键、共价键和金属键;结合力弱的结合键叫物理键(也有将它们看做弱化学力的),或称为二次键。如范德华键和氢键,或称为分子键。

实际材料中原子之间的结合,靠单一键力结合在一起的情况极少,原子间的结合常常是混合键,即化学键中的多种键合形式,有时还有物理键。W、Ta、Pb等一些金属原子凝聚成固体时,其键合方式是金属键和共价键的混合方式。氧化物陶瓷材料除离子键外,也含有相当数量的共价键。
↓↓四大类材料及其化学键
|
金属材料 |
主要以金属键结合,其强韧性好,塑性变形能力强,导电、导热性好,是主要的工程材料。 |
|
高分子材料 |
以分子键和共价键结合,耐蚀性、绝缘性好,密度小,加工成型性好,强度不高、硬度较低,耐热性较差。 |
|
陶瓷材料 |
以离子键、共价键结合,熔点高,硬度高,耐热,耐磨,脆性大,难以加工。 |
|
复合材料 |
由多种结合键组成,强韧性好,比强度、比刚度高,抗疲劳性好。 |

什么是化学键?
一
概念
化学键(chemical bond)是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。使离子相结合或原子相结合的作用力通称为化学键。
离子键、共价键、金属键各自有不同的成因,离子键是通过原子间电子转移,形成正负离子,由静电作用形成的。共价键的成因较为复杂,路易斯理论认为,共价键是通过原子间共用一对或多对电子形成的,其他的解释还有价键理论,价层电子互斥理论,分子轨道理论和杂化轨道理论等。金属键是一种改性的共价键,它是由多个原子共用一些自由流动的电子形成的。
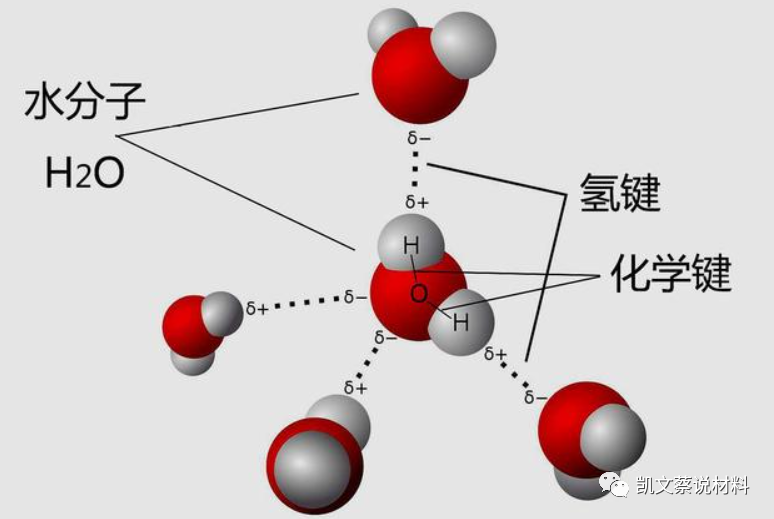
在一个水分子中2个氢原子和1个氧原子就是通过化学键结合成水分子。由于原子核带正电,电子带负电,所以我们可以说,所有的化学键都是由两个或多个原子核对电子同时吸引的结果所形成。化学键有3种类型 ,即离子键、共价键、金属键(氢键不是化学键,它是分子间力的一种)。
离子键
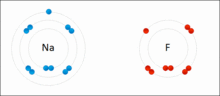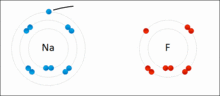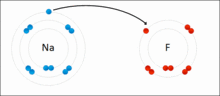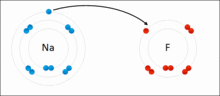 原子相互得失电子,形成离子键的过程
原子相互得失电子,形成离子键的过程
二
化学键的介绍和分类
带相反电荷离子之间的互相作用叫做离子键(Ionic Bond),成键的本质是阴阳离子间的静电作用。两个原子间的电负性相差极大时,一般是金属与非金属。例如氯和钠以离子键结合成氯化钠。电负性大的氯会从电负性小的钠抢走一个电子,以符合八隅体。之后氯会以-1价的方式存在,而钠则以+1价的方式存在,两者再以库仑静电力因正负相吸而结合在一起,因此也有人说离子键是金属与非金属结合用的键结方式。而离子键可以延伸,所以并无分子结构。
离子键亦有强弱之分。其强弱影响该离子化合物的熔点、沸点和溶解性等性质。离子键越强,其熔点越高。离子半径越小或所带电荷越多,阴、阳离子间的作用就越强。例如钠离子的微粒半径比钾离子的微粒半径小,则氯化钠NaCl中的离子键较氯化钾KCl中的离子键强,所以氯化钠的熔点比氯化钾的高。
定义:离子键是由正负离子之间通过静电作用而形成的,正负离子为球形或者近似球形,电荷球形对称分布,那么离子键就可以在各个方向上发生静电作用,因此是没有方向性的。
离子键概念:带相反电荷离子之间的相互作用称为离子键。
成键微粒:阴离子、阳离子。
成键本质:静电作用。静电作用包括阴、阳离子间的静电吸引作用和电子与电子之间、原子核与原子核之间的静电排斥作用。(一吸,两斥)
成键原因:①原子相互得失电子形成稳定的阴、阳离子。②离子间吸引与排斥处于平衡状态。③体系的总能量降低。
存在范围:离子键存在于大多数强碱、盐及金属氧化物中。
一个离子可以同时与多个带相反电荷的离子互相吸引成键,虽然在离子晶体中,一个离子只能与几个带相反电荷的离子直接作用(如NaCl中Na+可以与6个Cl-直接作用),但是这是由于空间因素造成的。在距离较远的地方,同样有比较弱的作用存在,因此是没有饱和性的。化学键的概念是在总结长期实践经验的基础上建立和发展起来的,用来概括观察到的大量化学事实,特别是用来说明原子为何以一定的比例结合成具有确定几何形状的、相对稳定和相对独立的、性质与其组成原子完全不同的分子。开始时,人们在相互结合的两个原子之间画一根短线作为化学键的符号 ;电子发现以后 ,1916年G.N.路易斯提出通过填满电子稳定壳层形成离子和离子键或者通过两个原子共有一对电子形成共价键的概念,建立化学键的电子理论。
量子理论建立以后,1927年 W.H.海特勒和F.W.伦敦通过氢分子的量子力学处理,说明了氢分子稳定存在的原因 ,原则上阐明了化学键的本质。通过以后许多人 ,特别是L.C.鲍林和R.S.马利肯的工作,化学键的理论解释已日趋完善。
化学键在本质上是电性的,原子在形成分子时,外层电子发生了重新分布(转移、共用、偏移等),从而产生了正、负电性间的强烈作用力。但这种电性作用的方式和程度有所不同,所以又可将化学键分为离子键、共价键和金属键等。离子键是原子得失电子后生成的阴阳离子之间靠静电作用而形成的化学键。离子键的本质是静电作用。由于静电引力没有方向性,阴阳离子之间的作用可在任何方向上,离子键没有方向性。只要条件允许,阳离子周围可以尽可能多的吸引阴离子,反之亦然,离子键没有饱和性。不同的阴离子和阳离子的半径、电性不同,所形成的晶体空间点阵并不相同。
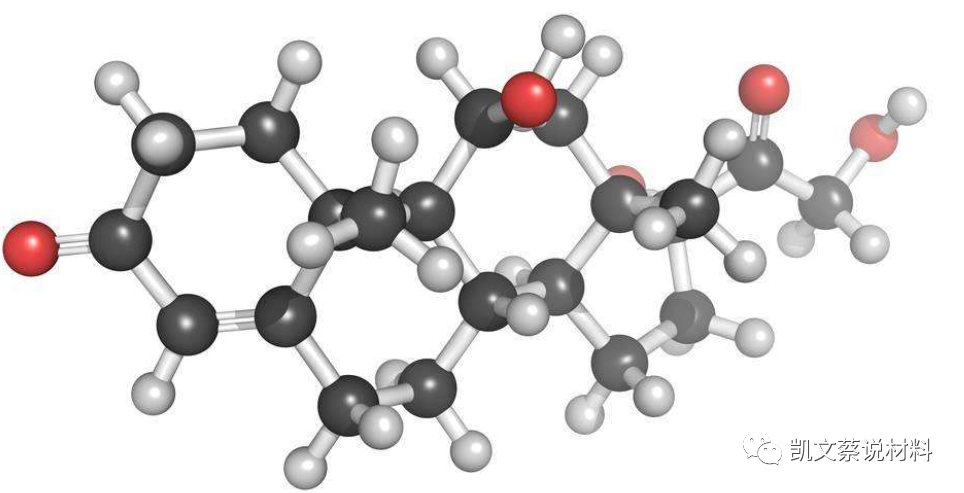
共价键
1.共价键(Covalent Bond)是原子间通过共用电子对(电子云重叠)而形成的相互作用。形成重叠电子云的电子在所有成键的原子周围运动。一个原子有几个未成对电子,便可以和几个自旋方向相反的电子配对成键,共价键饱和性的产生是由于电子云重叠(电子配对)时仍然遵循泡利不相容原理。电子云重叠只能在一定的方向上发生重叠,而不能随意发生重叠。共价键方向性的产生是由于形成共价键时,电子云重叠的区域越大,形成的共价键越稳定,所以,形成共价键时总是沿着电子云重叠程度最大的方向形成(这就是最大重叠原理)。共价键有饱和性和方向性。
2.原子通过共用电子对形成共价键后,体系总能量降低。
共价键的形成是成键电子的原子轨道发生重叠,并且要使共价键稳定,必须重叠部分最大。由于除了s轨道之外,其他轨道都有一定伸展方向,因此成键时除了s-s的σ键(如H2)在任何方向都能最大重叠外,其他轨道所成的键都只有沿着一定方向才能达到最大重叠。共价键的分类
共价键有不同的分类方法。
(1) 按共用电子对的数目分,有单键(Cl—Cl)、双键(C=C)、三键(N≡N,C≡C)等。
(2) 按共用电子对是否偏移分类,有极性键(H—Cl)和非极性键(Cl—Cl)。
(3) 按提供电子对的方式分类,有正常的共价键和配位键(共用电子对由一方提供,另一方提供空轨道。
如铵根离子中的N—H键中有一个属于配位键)。
(4) 按电子云重叠方式分,有σ键(电子云沿键轴方向,以“头碰头”方式成键。如C—C。)和π键(电子云沿键轴两侧方向,以“肩并肩”方向成键。如C=C中键能较小的键.C=C中有一个σ键与一个π键。)等
3.旧理论:共价键形成的条件是原子中必须有成单电子,自旋方向必须相反,由于一个原子的一个成单电子只能与另一个成单电子配对,因此共价键有饱和性。如H原子与Cl原子形成HCl分子后,不能再与另外一个Cl形成HCl2了。
4.新理论:共价键形成时,成键电子所在的原子轨道发生重叠并分裂,成键电子填入能量较低的轨道即成键轨道。如果还有其他的原子参与成键的话,其所提供的电子将会填入能量较高的反键轨道,形成的分子也将不稳定。像HCl这样的共用电子对形成分子的化合物叫做共价化合物。

化合物分类
1.离子化合物:由阳离子和阴离子构成的化合物。
大部分盐(包括所有铵盐),强碱,大部分金属氧化物,金属氢化物。活泼的金属元素与活泼非金属元素形成的化合物中不一定都是以离子键结合的,如AICI3、FeCl3、BeCl2等不是通过离子键结合的。非金属元素之间也可形成离子化合物,如铵盐都是离子化合物。
2.共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。
非金属氧化物,酸,弱碱,少部分盐,非金属氢化物。
3.在离子化合物中一定含有离子键,可能含有共价键。在共价化合物中一定不存在离子键。

金属键
1.概述:化学键的一种,主要在金属中存在。由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。由于电子的自由运动,金属键没有固定的方向,因而是非极性键。金属键有金属的很多特性。例如一般金属的熔点、沸点随金属键的强度而升高。其强弱通常与金属离子半径成逆相关,与金属内部自由电子密度成正相关(便可粗略看成与原子外围电子数成正相关)。
2.改性共价键理论:在金属晶体中,自由电子作穿梭运动,它不专属于某个金属离子而为整个金属晶体所共有。这些自由电子与全部金属离子相互作用,从而形成某种结合,这种作用称为金属键。由于金属只有少数价电子能用于成键,金属在形成晶体时,倾向于构成极为紧密的结构,使每个原子都有尽可能多的相邻原子(金属晶体一般都具有高配位数和紧密堆积结构),这样,电子能级可以得到尽可能多的重叠,从而形成金属键。上述假设模型叫做金属的自由电子模型,称为改性共价键理论。这一理论是1900年德鲁德(drude)等人为解释金属的导电、导热性能所提出的一种假设。这种理论先后经过洛伦茨(Lorentz,1904)和佐默费尔德(Sommerfeld,1928)等人的改进和发展,对金属的许多重要性质都给予了一定的解释。但是,由于金属的自由电子模型过于简单化,不能解释金属晶体为什么有结合力,也不能解释金属晶体为什么有导体、绝缘体和半导体之分。随着科学和生产的发展,主要是量子理论的发展,建立了能带理论。

定域键
只存在于两个原子之间的共价键。只包含定域键的多原子分子可以看成是由相对独立的两个原子之间的化学键把原子连接起来形成的,这是忽略了相邻化学键的影响,而把描述双原子分子中化学键的方法用到多原子分子的定域键上。如乙烯中有一个C-C和四个C-H σ键、一个C-Cπ键。定域键具有比较恒定的键性质。例如一定类型定域键的键长、键偶极矩、键极化度、键力常数、键能等在不同分子中近似保持不变。因此,分子的有关广延性质可近似表示为相应的键性质之和。定域键的这种特点在化学中得到广泛的应用,例如从键能计算分子的原子化能近似值。这种模型较好地反映了由键上电子云所确定的分子性质如键能、键长、键角、键偶极、键极化度等。这种围绕两个原子的分子轨道成为定域轨道。
极性键
在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键
有一个简单的判断极性键与非极性键的方法,比较形成该化合物中各原子的原子量,一般来说,相对原子质量越大的原子吸引电子能力更强。但是要注意,有极性键构成的化合物,不一定是极性化合物,例如甲烷,它就是有极性键的非极性分子(原因是正负电荷中心重合)。
非极性键
由同种元素的原子间形成的共价键,叫做非极性共价键。同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。非极性键的键偶极矩为0。以非极性键结合形成的分子都是非极性分子。存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。
举例:Cl2分子中的Cl-Cl键属于非极性键
配位键
又称配位共价键,是一种特殊的共价键。当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。配位键形成后,就与一般共价键无异。成键的两原子间共享的两个电子不是由两原子各提供一个,而是来自一个原子。例如氨和三氟化硼可以形成配位化合物:图片式中→表示配位键。在F和B之间的一对电子来自N原子上的孤对电子。
五大类原子结合键
一
金属键:价电子离域共享
所谓金属键主要在金属和合金中存在,处于凝聚状态的金属原子,将它们的价电子贡献出来,作为整个原子基体的共有电子。金属键的基本特征是电子云的共有化,即组成金属晶体的各原子的电子可以在整个晶体中运动。共有化的电子称为自由电子,自由电子组成所谓的电子云或电子气,在点阵的周期场中按量子力学规律运动。自由电子的可用性有助于金属成为优良的导体,失去了价电子的金属原子成为正离子,嵌镶在这种电子云中,并依靠与这些共有化的电子的静电作用而相互结合,这种结合方式就称为金属键。
电子海模型:正原子核被离域电子海(蓝点)包围
电子属于整个“金属大分子”所共有,不再属于哪个原子(电子是离域的)
金属与其他固体的区别是金属中的电子会对外加电场、热梯度以及入射光产生响应。这使得金属具有高的电导率、热导率和光学反射率。金属具有正电阻率温度系数,因此,金属在温度上升时,它的电导性变差。低浓度杂质合金化以后,纯金属的电导率总是下降。如上两种情况对电导率影响的原因是增加了电子的散射,这一作用降低了外加电场方向上电子运动的净分量。还有一个很有趣的现象,金属薄膜与块体之间的电学特性差别很小~~以薄膜形式出现的金属薄膜应用的例子包括集成电路中的触点和互连线,数据存储中的铁磁合金。金属膜也可用于反射镜、光学系统,以及封装材料的装饰与防护涂层和各种元件中。
二
共价键:价电子局域共享
美国化学家路易斯(GNLewis)提出了共价键(covalentbond)的电子理论:原子之间可以通过共用电子使每一个原子都达到稳定的稀有气体电子结构,从而形成稳定的分子。这种原子通过共用电子对而形成的化学键称为共价键。共价键固体是一种强化学键硬质材料,具有较高熔点。周期表中价电子为4个或5个的4A、5A族元素如Si、P等,其离子化相当困难,只能通过电子共享,在s态、p态角量子壳层达到稳定的8个电子结构。元素周期表末端的元素多以离子键形式存在,而共价键经常在相邻族的元素间形成。在自然界中,大量的元素和化合物固体是以共价键形式存在的,先进陶瓷和单质分子大多是共价键结合,还有元素半导体Si、Ge、金刚石以及III-V族化合物半导体,如GaAs和InP。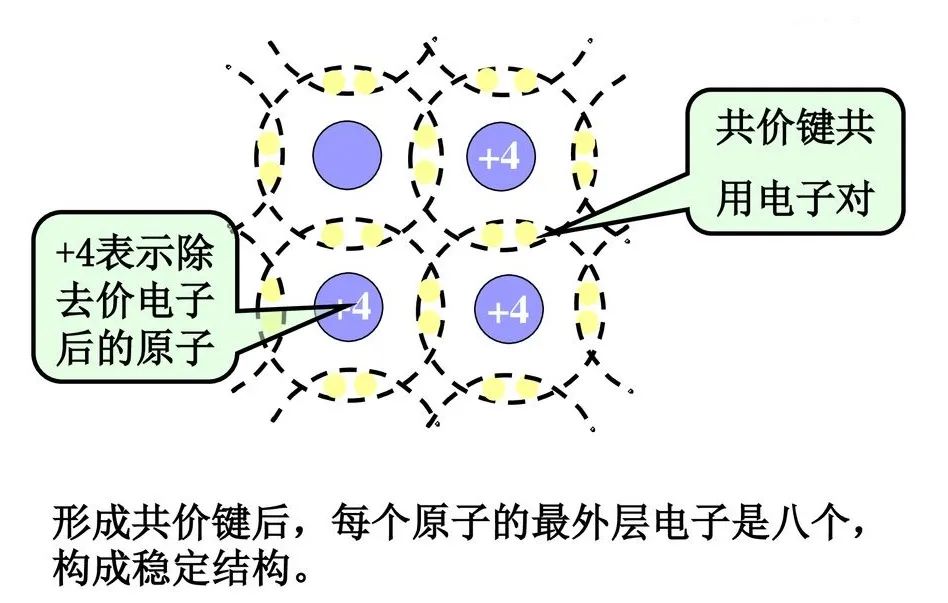
现代电子学中,重要的半导体材料:硅和锗,它们的最外层电子(价电子)都是四个,它们组合成晶体靠共价键结合
三
离子键:价电子转移
由原子间发生电子的转移,形成正负离子,并通过静电引力作用形成的化学键。期表中1A、2A族金属元素外壳层仅有1-2个价电子,很容易逸出成为正离子如Na、Mg;6A、7A族的非金属原子外壳层为多电子如S、Cl,很容易接受电子成为负离子,成为稳定的电子结构,降低体系能量。这种正负离子的结合属于离子键。离子键的键能较大,故离子化合物的熔点都较高,但当离子键被破坏时,会形成阴阳离子,即在水溶液中或熔融状态下。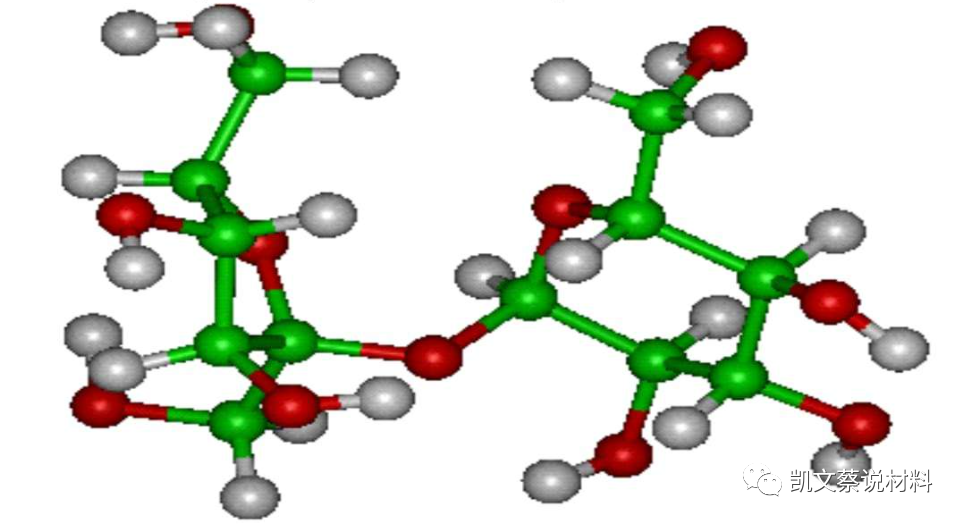
TIPS:离子键和共价键没有明显的界限
不过非常值得我们注意的一件事是“离子键和共价键没有明显的界限”,如上的讨论是一种简化了的模型,实际上任何所谓的极性共价键都含有离子键成分,不存在纯粹绝对的离子键,任何离子键都含有原子轨道重叠的成分(即共价键成分)。
不论是离子键还是共价键,均利用的是电子进行成键不同的是,离子键中,以静电力作为支撑通常没有方向性。而共价键来源于共用电子对,具有方向性。电子是一团波是一个概率波,他不是一个单纯的粒子。在空间中以的位置不是固定的,而是存在概率分布。对于共价键来说,电子集中分布在两原子中间。这是有利于能量降低的。然而不可忽视的是,对于共价键,电子依然有概率完全集中在其中的一个原子上而形成离子。这只是一个概率问题。纯粹的共价键一般来说认为是同原子分子,且没有极性的那种。其电子云密度集中分布在两原子之间。基本上没有离子性。(实际上还是有,但是概率极低完全可以忽略)回到离子键上,虽然阴阳离子之间具有能垒,但是依然存在这么一个概率使得电子形成共用电子对成为共价键。电负性相差越大的阴阳离子其能垒越高,越不容易形成共价键,所以共价成分越低。例如:离子化合物氯化钠晶体中的化学键含有71%的离子键成分和29%的共价键成分;而我们大名鼎鼎的强共价键化合物碳化硅,其共价键成分可达88%。
四
范德瓦尔兹键(范德华力):分子间的引力
物理键(范德华力及氢键)是由分子之间的静电引力而产生的力,称为分子键。在物理键形成过程中,并没有发生电子得失、电子共有和电子公有化,它是由于分子中电子分布不均匀而引起的分子间引力的结合。范德华键的特点是由分子间偶极吸引力所形成的物理键,其键力远小于化学键,故键合力弱,熔点低,硬度低,材料稳定性差,易变形。范德华键是分子间偶极距所产生的静电吸力将两个分子结合在一起的力。范德华力是分子间力,由三种力组成:取向力(dipoleforce)、诱导力(inductionforce)和色散力(dispersionforce)。

熔沸点:对于组成和结构相似的分子,相对分子质量越大,物质的熔沸点越高(除H2O、HF、NH3)。例如:烷烃(CnH2n+2)的熔沸点随着其相对分子质量的增加而增加,也是由于烷烃分子之间的范德华力增加所造成的。
溶解度:溶剂与溶质分子间力越大,溶质的溶解度越大。例如:273K,101kPa时,氧气在水中的溶解量(0.049cm3·L-1)比氮气的溶解量(0.024cm3·L-1)大,就是因为O2与水分子之间的作用力比N2与水分子之间的作用力大所导致的。在二维层状材料领域,层内以强的共价键或离子键结合而成,而层与层之间依靠弱的范德华力堆叠在一起的一类新型材料。由于层间弱的相互作用力,在外力的作用下,层与层很容易相互剥离,从而可以形成二维层状材料。最典型的例子就是石墨烯。
五
氢键
氢键力是一种由氢原子引起的特殊的分子间相互作用力。它是由氢原子同时与两个电负性很大、原子半径较小的原子(O、F、N)之间的结合所形成的物理键。氢键中的氢原子起关键作用。氢键本质上与范德华键一样,是依靠分子间的偶极吸引力结合在一起,性质相似,但结合力比范德华力大,且具有饱和性和方向性。范德华力的大小会影响物质尤其是分子晶体的熔点和沸点,通常分子的分子量越大,范德华力越大。水(氧化氢)比硫化氢的相对分子质量小,因此范德华力比后者弱,但由于水分子间存在更强的氢键,熔沸点反而更高。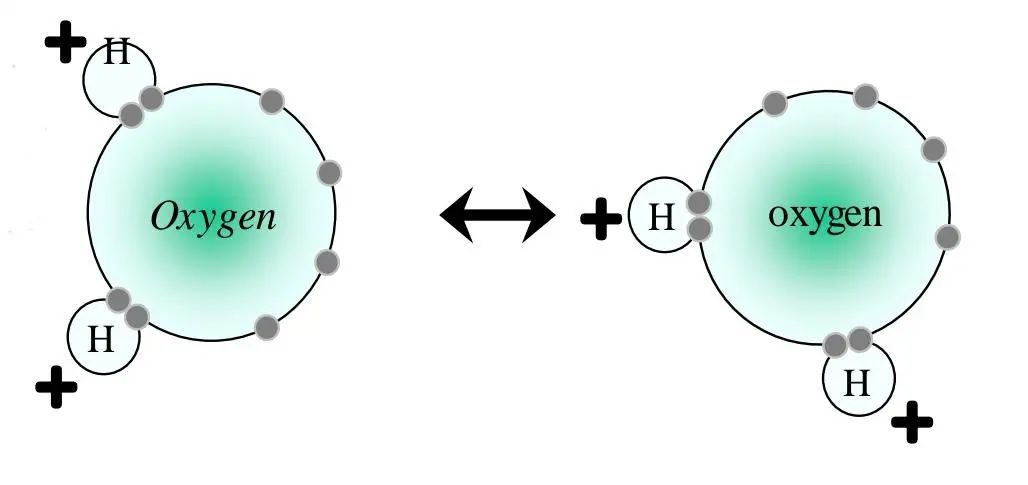
例如:二个水分子间的氢键力
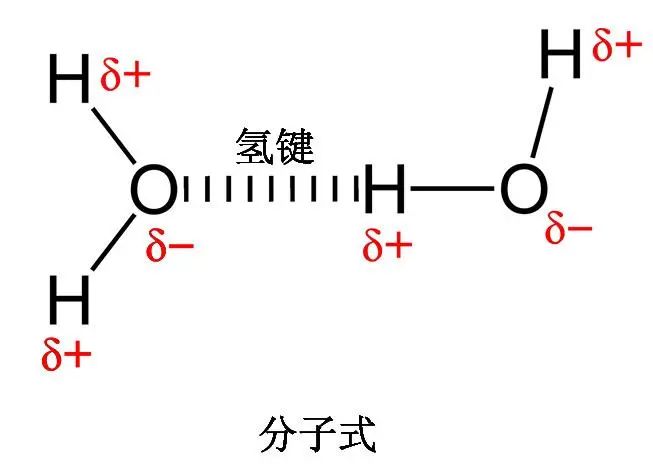
氢键虽然是一种弱键,但由于它的存在,物质的性质出现了反常现象,在形状结构等方面受到了很大的影响。氢键由于广泛存在与化合物中,因此在研究化合物的性能时,氢键起着重要的作用。氢键的键能介于共价键和范德华力之间,其键能小,形成或破坏所需的活化能也小,加上形成氢键的结构条件比较灵活,特别容易在常温下引起反应和变化,故氢键是影响化合物性质的一个重要因素。
氢键在材料领域中应用:液晶材料领域是氢键应用研究较早较多的领域。分子间氢键具有良好的热稳定性,既能使不具有液晶行为的质子给体和受体形成的氢键复合物呈现液晶性,也可改变原质子给体和受体的液晶行为。虽然氢键键能较弱,给其复合物稳定性带来不利影响,但它的适当弱化,反而使得氢键液晶高分子具有独特的动力学性质,尤其是对温度的变化具有可逆响应性能,为其在感应材料制备方面的应用提供了广阔的空间。氢键的动态可逆特性,基于氢键相互作用的超分子液晶体系具有信息储存功能、质量或电荷传输性以及分子传感等诸多动态特性。
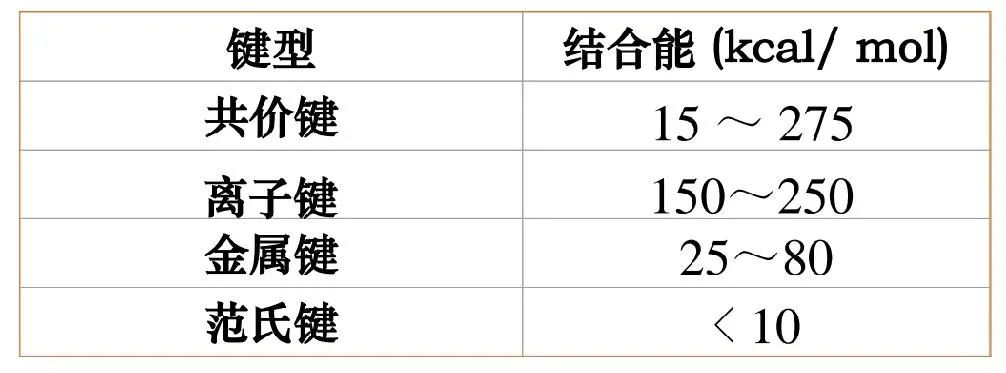
结合能与材料性能
共价键、离子键的键能大,金属键的键能次之;范德华键的键能最小,远小于三种化学键的结合能。

不同结合键能的大小

一
熔点
熔点与键能有较好的对应关系。离子键和共价键的化合物熔点高,其中纯共价键的金刚石具有最高的熔点;某些金属如W、Ta等也存在相当部分的共价键,故熔点高;普通金属材料的熔点相对较低。离子键结合能大,故陶瓷材料比金属材料具有更高的热稳定性,耐高温性好。物理键结合的材料熔点较小,如线性高分子材料,因有大量的物理键,其熔点很低,耐热性较差。
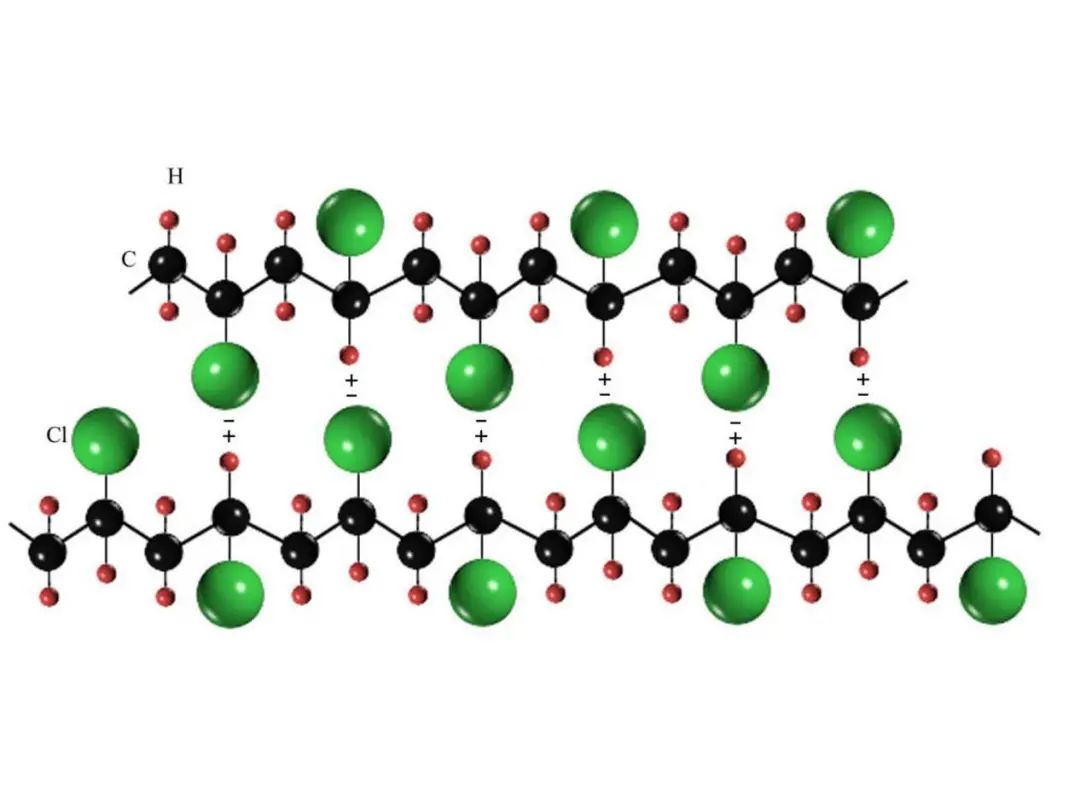
聚氯乙烯(PVC)大分子链之间的氢键力
二
密度
材料的密度与结合键类型关系密切。金属材料如Pb、Ag、Cu等元素的密度高,这是因为:一是金属原子质量大;二是金属键的结合方式没有方向性,原子趋于紧密排列,得到简单的原子排列形态。离子键和共价键结合的原子,相邻原子的个数受到共价键数目的限制,离子键结合还要满足正、负离子间电荷之间的平衡,原子不可能紧密堆积,而且存在空洞缺陷,故陶瓷材料密度小。高分子材料的组成元素主要是C、H,质量小,且分子链间是物理键结合,堆积不紧密,密度就更小。
三
导电、导热性
金属键有大量自由电子的运动和离子的振动,使金属材料具有良好的导热性和导电性。陶瓷材料和高分子材料由于无自由电子存在,固态下基本不导电,成为一种绝缘材料。
-
材料
+关注
关注
3文章
1272浏览量
27461
发布评论请先 登录
相关推荐
健翔升带你了解PCB压合的原理和流程

固体激光器的概念与特性
影响相对介电常数的因素有哪些
Li3MX6全固态锂离子电池固体电解质材料
原子的结构在化学反应中的作用
国家发改委和工信部联合印发 | 新材料中试平台建设指南(2024-2027年)

东超新材:球形氧化铝粉在新能源电池导热材料中的应用

庆祝在华四十周年 应用材料中国公司举办总部庆典仪式





 固体材料中的化学键及其特点
固体材料中的化学键及其特点













评论