验证的由来
20世纪50至60年代,美国输液药剂的污染导致了各种败血病病例的产生。FDA调查结果表明,与败血症案例相关的批次药物并不是由于企业没做无菌检查或违反药事法规的条款将无菌检查不合格的批号投放了市场。问题在于无菌检查本身的局限性、设备或系统设计建造的缺陷以及生产过程中的各种偏差及问题。FDA将这类问题归结为“过程失控”,FDA从败血症案例的调查分析中深切地体会到产品需要检验,然而检验并不能确保药品的质量。从质量管理是系统工程的观念出发,FDA当时认为有必要制订一个新的文件,以

“通过验证确立控制生产过程的运行标准,通过对已验证状态的监控,控制整个工艺过程,确保质量”
为指导思想,强化生产的全过程控制,进一步规范企业的生产及质量管理实践。
这个文件即是1976年6月1日发布的“大容量注射剂GMP 规程(草案)”,它首次将验证以文件的形式载入GMP史册。实践证明,验证使GMP的实施水平跃上了一个新的台阶, 因此专家认为该规程是GMP发展史上新的里程碑。
2.苛刻的要求与时代的需求
随着医疗技术的飞速发展,无菌医疗器械的应用也越来越广泛,灭菌过程作为无菌医疗器械生产的特殊过程,是医疗器械生产过程中的需要定期验证和重点控制的过程。
产品灭菌的目的是使产品无任何类型的存活微生物,在灭菌过程中,微生物的死亡规律是用指数函数表示的。因此任何单位产品上微生物的存在可用概率表示,概率可以减少到很低,但不可能为零。该概率可用无菌保障水平 (SAL) 表示,通常无菌概念是指无菌保障水平 (SAL) 达到 10-6。
医疗器械灭菌验证一般分为
安装确认 (IQ):获得证据并用文件证明灭菌设备及其附属设施,已按规定的要求被提供和安装 ;
操作确认 (OQ):当设备按程序运行时,获得证据并用文件来证明已安装的设备,有能力在指定的允差范围内提供特定的过程 ;
性能确认 (PQ):获得证据并用文件证明设备能够在预先设定的参数下持续运行,且这个过程加工后的产品是无菌的。性能确认一般包括物理性能确认和微生物性能确认,器械所使用的材料对灭菌方法的适用性,也是性能验证中的重点。
3.虹科温度验证系统
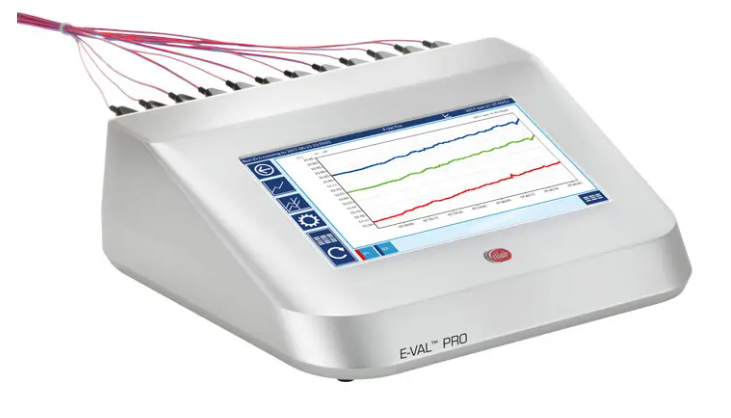
E-Val Pro - 有线验证系统

-
尺寸紧凑且重量轻,在受控环境中非常容易操作。
-
符合 FDA 法规和 GAMP 指南,旨在成为任何热验证过程的理想解决方案。
-
安全且受密码保护的模块最多可处理40个热电偶,大内存一次最多可保存10个研究。
-
内置8小时电池,可作为独立装置使用或通过 LAN/USB 连接到 PC。
-
提供4和12通道阵列,可以处理所有热电偶类型以及模拟和数字输入。

Tracksense Pro--无线验证系统


-
是一种耐用,智能,准确且高度灵活的系统,用于测量温度,压力,湿度,电导率,CO2,真空和蒸汽渗透率。
-
通过将适当的记录仪与选定的可互换传感器结合使用,最终为用户配置了TrackSense Pro无线数据记录仪解决方案。可以轻松地在测量参数和多种不同的传感器选件之间进行切换。
-
可在传感器和记录仪之间放置一个SKY模块形式的实时数据通信选件,从而可以将实时数据直接传输到PC。
这些功能使TrackSense Pro数据记录仪与大多数应用程序兼容,因此成为了最通用的选择。

关于虹科和Ellab(意莱伯)

自1949年以来,Ellab一直提供行业领先的精度和品质的热验证解决方案。虹科Ellab的硬件和软件由丹麦的总部设计、制造和分销,虹科与Ellab(意莱伯)合作提供验证系统,校准系统,验证和确认以及租赁服务和校准服务,服务于大型、中型、小型的制药、医疗和食品行业的客户。我们在灭菌,冷冻干燥,隧道式烘箱,巴氏杀菌等多种应用提供解决方案。
原文标题:【虹科分享】想保障制药无菌生产,您需要的是验证
文章出处:【微信公众号:医安与电子技术】欢迎添加关注!文章转载请注明出处。
-
医疗器械
+关注
关注
19文章
823浏览量
51430
发布评论请先 登录
相关推荐
虹科培训 | 重磅来袭!波形分析课程全面上线!

虹科方案 领航智能交通革新:虹科PEAK智行定位车控系统Demo版亮相

无菌制药物联网监控管理系统解决方案
虹科案例|为什么PCAN MicroMod FD是数模信号转换的首选方案?

E-Val Pro Plus有线验证解决方案,功能升级,优化制药流程,确保安全性和合规性!
虹科分享丨无线数据记录仪与传统有线热电偶系统的对比优势
虹科方案 | 符合医药行业规范的液氮罐运输和存储温度监测解决方案

革新监测技术:无线数据记录系统如何颠覆食品、医疗和制药行业的验证流程

提高生产效率!虹科MSR165快速检测机器故障,实现精准优化
PLC远程监控在制药行业的应用

AtomGit教程 | 使用AtomGit双因素验证保障您的账户安全





 【虹科分享】想保障制药无菌生产,您需要的是验证
【虹科分享】想保障制药无菌生产,您需要的是验证











评论