01 什么是CRISPR?

基因携带着生物体的遗传信息,是储存着生命的种族、血型、孕育、生长、凋亡等过程的一套精确的密码,决定了生物体的性状。
随着科学研究的深入,某些场景我们需要人为改变这些密码,调控生物体的各种性状,诸如性别、毛色、肤色等等(当然性状也受环境的影响),这种行为被称为基因编辑。然而基因编辑并非易事,原因之一便是基因众多,组成简单生命最少要 265 到 350 个基因。这些基因上没有标签,无从知道哪段基因对应了什么性状。而且基因存在于微小的 DNA 中,尺度在纳米级别。微小而繁复,使得基因编辑就像是在一团乱麻中找到想编辑的一段进行微型手术,难度不言而喻。
而在1987年被科学家在大肠杆菌中发现的一段“无法确定功能”的DNA成为了基因编辑技术的一大契机,这段DNA后期被称为CRISPR。CRISPR是生命进化历史上,细菌和病毒进行斗争产生的免疫武器,简单说就是病毒能把自己的基因整合到细菌,利用细菌的细胞工具为自己的基因复制服务,细菌为了将病毒的外来入侵基因清除,进化出 CRISPR-Cas9 系统,利用这个系统,细菌可以不动声色地把病毒基因从自己的基因组上敲除,这是细菌特有的免疫系统,是古菌和细菌抵抗病毒等外源遗传物质入侵的一种获得性免疫系统。微生物学家掌握了细菌拥有多种切除外来病毒基因的免疫功能,其中比较典型的模式是依靠一个复合物,该复合物能在一段RNA指导下,定向寻找目标DNA序列,然后将该序列进行敲除。许多细菌免疫复合物都相对复杂,其中科学家掌握了对一种蛋白Cas的操作技术,并先后对多种目标细胞DNA进行敲除。
通俗地说,CRISPR 技术是一种基因敲除(基因编辑)的技术。这种技术无视基因带来的挑战,它的强大之处在于能够实现精确的基因编辑,达到指哪打哪的程度,实现更高效率的基因敲除。在过去的十年里,围绕着 CRISPR 技术的研究数量发生了爆炸式增长。这些研究带来了诸多富有创新性的应用,比如使用 CRISPR 技术对 DNA 纳米结构进行工程化设计或是通过基因编辑来治疗遗传疾病(例如镰状细胞病),这些突破性研究极大地革新了传统基因编辑技术。
02 CELESTA光源用于 CRaft-ID 成像
 混合基因敲除筛选(Pooled genetic knockout screens)在功能基因组学界广泛用于鉴定与细胞表型相关的基因,而基因敲除方法中最典型的则为CRISPR 方法。但是这类筛选方法大多采用比较粗犷的筛选指标,如生长速率、合成致死和荧光报告等方法。
混合基因敲除筛选(Pooled genetic knockout screens)在功能基因组学界广泛用于鉴定与细胞表型相关的基因,而基因敲除方法中最典型的则为CRISPR 方法。但是这类筛选方法大多采用比较粗犷的筛选指标,如生长速率、合成致死和荧光报告等方法。
近年来,随着单细胞测序的普及,将其与混合基因敲除筛选法相结合,实现了全转录组范围内的定量分析,大大提升了筛选的通量。但是,这些方法仍然不能对亚细胞层面的表型进行分析,如在成像层面能够观察到的时空分辨率下的一些表型。因此,将汇集的 CRISPR 基因筛选与细胞和亚细胞成像读数相结合对于改善基于图像的基因敲除研究中的表型定义至关重要。
2020年5月11日,加州大学圣地亚哥分校的华裔学者Gene W Yeo及其同事在Nature methods杂志上发表题为Pooled CRISPR screens with imaging on microraft arrays reveals stress granule-regulatory factors的研究论文。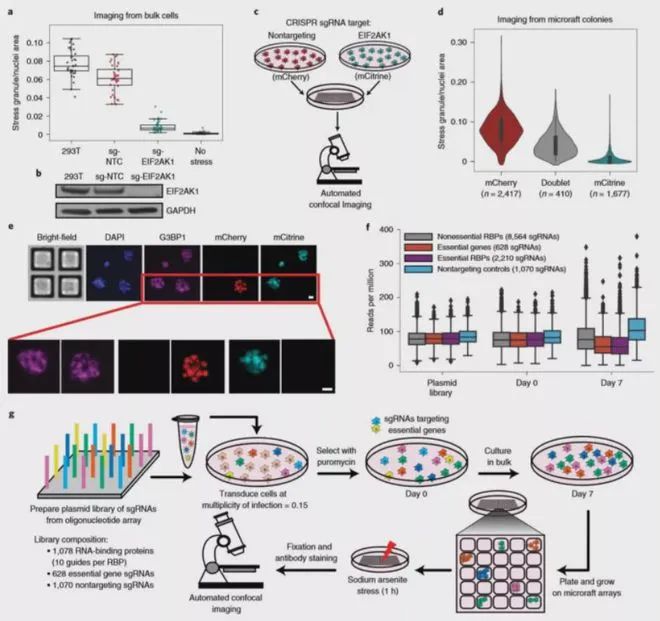
在这篇文章中,作者将 Pooled CRISPR-Cas9 筛选与微筏阵列(又称基因芯片)技术以及高内涵成像相结合,开发了新技术“CRaft-ID”。作者选用了包含 >1,000 个 RBPs 的 gRNA 文库(> 12,000 个 sgRNA)对细胞进行了感染,然后在 20 个微筏阵列上进行单细胞培养,筛选得到 119050 个应激刺激后的单细胞集落和 5262 个未进行应激刺激的对照集落。随后采用自动高分辨率共聚焦成像来识别应激颗粒的调节因子,并开发了机器学习工具来识别 CRISPR 基因敲除后应激颗粒丰度降低的基因克隆。
其中,微筏阵列的共聚焦成像是使用与 CrestOptics X-Light V2 L-FOV 旋转盘共聚焦耦合的虹科 CELESTA 光源完成的。在这种大通量成像应用中,显微镜光源需要具有极佳的光源强度和长时间工作的稳定性,虹科CELESTA 光源满足所有严苛要求。虹科 CELESTA 光源的405 nm,520 nm,546 nm和638 nm线分别用于激发DAPI,mCitrine,mCherry和Alexa Fluor 633的荧光。该筛选鉴定并验证了六种以前已知的应激颗粒调节剂,以及17种RNA结合蛋白(RBP)。当它们耗尽时,可减少亚砷酸钠诱导的人体细胞中应激颗粒,这为应激颗粒提供了新的生物学见解。基于虹科 CELESTA 光源构建的 CRaft-ID 筛选平台拓展了 CRISPR 筛选在高内涵成像中的应用,使得我们能够对亚细胞层面和细胞形态的表型进行遗传因子分析,而这些在以前是无法实现的。由于该方法采用的微筏阵列、通用的CRISPR文库、现成的共聚焦成像技术和基于 PCR 的 DNA 测序,因此具有广泛的应用前景。
03虹科CELESTA光源介绍



虹科CELESTA
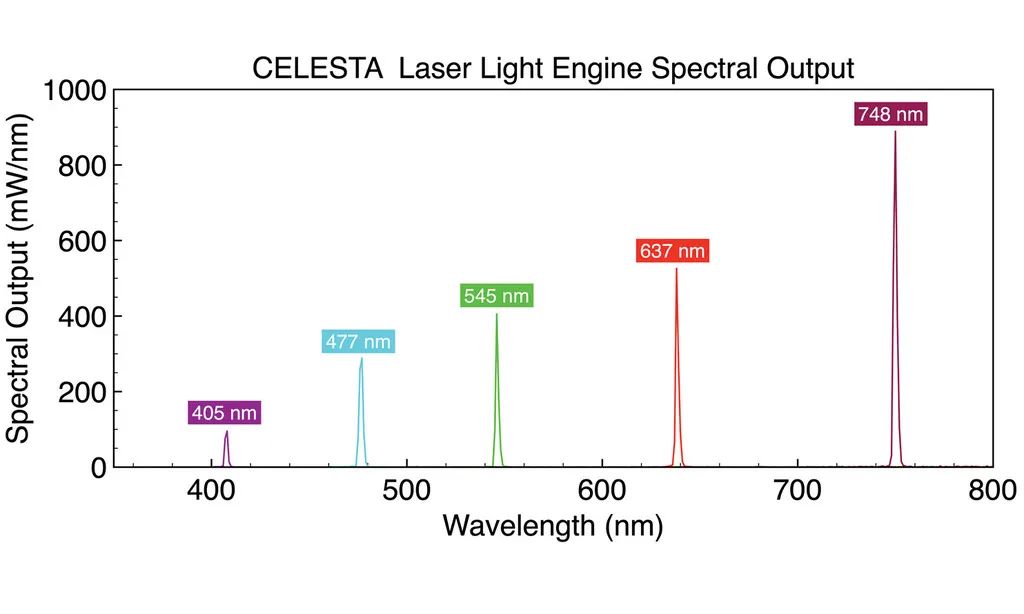
虹科 CELESTA 和 CELESTA quattro 光源包括4-7个可单独控制的固态激光光源阵列(在400-800nm范围提供7个可选波长),并且支持快速切换。CELESTA 光引擎在1.5mm直径光纤的远端出光,其7个激光器中的每一个都能提供约1W的输出功率。
同样,CELESTA quattro 光源以相同的输出功率规格提供了一个具有性价比的4或5通道选择。激光输出与复杂的控制和监测系统相结合,为旋转盘共聚焦显微镜、空间分辨率转录组学和其它高级成像应用提供所需的高清晰度性能。
-
光源
+关注
关注
3文章
727浏览量
68351
发布评论请先 登录
相关推荐
蔡司激光共聚焦显微镜新品发布LSM910/990

虹科直播回放 | IO-Link技术概述与虹科IO-Link OEM

分析共聚焦激光显微镜成像的常见问题
共聚焦激光显微镜在材料科学中的应用
共聚焦激光显微镜对比超分辨显微镜
共聚焦激光显微镜的光学系统解析
共聚焦激光显微镜的使用注意事项
共聚焦激光显微镜工作原理
共聚焦显微镜有什么用?

共聚焦、光学显微镜与测量显微镜的区分
显微成像与精密测量:共聚焦、光学显微镜与测量显微镜的区分





 虹科案例|CELESTA光源用于Craft-ID技术的共聚焦成像
虹科案例|CELESTA光源用于Craft-ID技术的共聚焦成像











评论