细胞通过限制性三维迁移可导致核包膜完整性丧失、DNA损伤和基因不稳定。尽管有这些有害的现象,暂时暴露在封闭环境中的细胞通常不会死亡。目前,这是否也适用于受到长期禁锢的细胞仍不清楚。近日,来自美国奥本大学的Panagiotis Mistriotis教授团队进行了通过下调YAP活性限制P53过度激活以促进细胞在封闭中存活的相关研究。研究成果以“Downregulation of YAP Activity Restricts P53 Hyperactivation to Promote Cell Survival in Confinement”为题发表在Advanced Science期刊上。
在该项研究中,研究人员采用了光刻和微流控技术制造一个高通量的器件,该器件规避以前细胞封闭模型的限制,并能在生理相关尺度的微通道中长期培养单细胞。这项研究的结果表明,连续暴露在严格的封闭环境中会引发频繁的核包膜破裂,反过来又会促进P53的激活和细胞凋亡。迁移的细胞最终会适应密闭,并通过下调YAP活性来逃避细胞死亡。YAP活性的降低是封闭诱导YAP1/2转位到细胞质的结果,抑制了核包膜破裂的发生率,并废除P53介导的细胞死亡。总之该研究建立了先进、高通量的生物模拟模型,以更好理解健康和疾病中的细胞行为,并强调环境线索和机械传导途径在调节细胞生命和死亡中的关键作用。
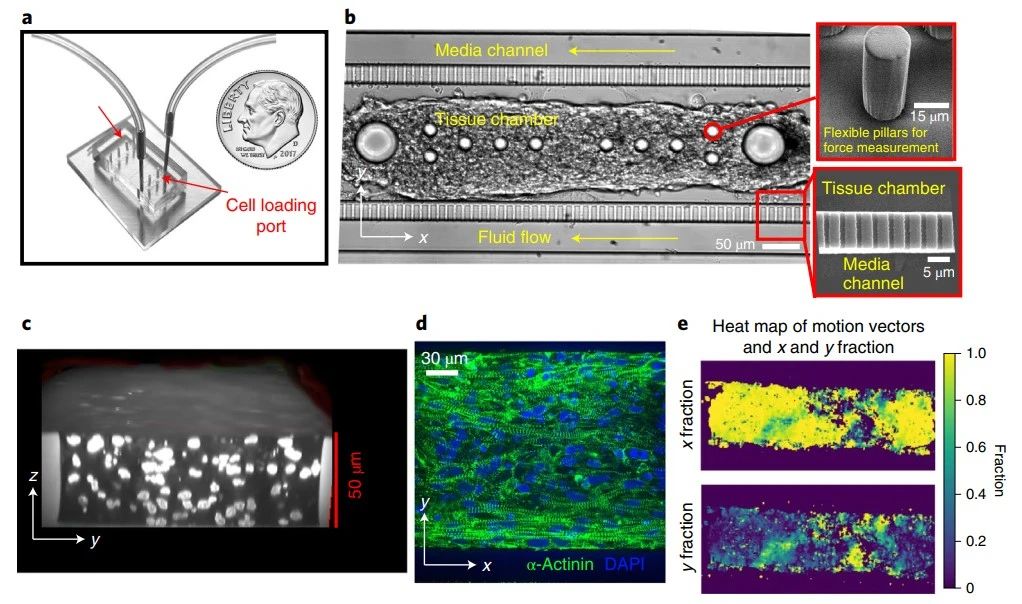
光刻和微流控技术在生理尺寸微通道中禁锢细胞
将微流控技术与光刻图案化结合起来,从而能够研究长期三维封闭如何影响细胞行为。研究人员首先建立了一个平行微通道阵列,其尺寸模仿体内迁移细胞遇到的通道状轨道或微血管的大小。与这些微通道垂直的是两个较大的、类似于二维的通道,作为细胞和培养基的储存器。通过应用PRIMO光刻技术和光活化试剂PLPP,降解了衬在微通道壁上的防粘层,并使用ECM蛋白涂覆。接着将细胞引入微流控器件,在入口和出口之间产生一个压力差,促使细胞流经最下层的二维类通道。尽管细胞未能粘附在用PLL-mPEG-SVA处理的通道上,但它们却附着在胶原蛋白I光刻图案微通道的入口附近。在趋化作用下,细胞进入用光刻的微通道。接下来,研究人员量化了细胞进入后留在微通道内的细胞比例。结果发现,细胞在光刻图案微通道中的夹带效率达到80% ~ 95%,并且与几何形状无关。相比之下,胶原蛋白I涂层的器件,有利于细胞通过微通道迁移。总之,将微流控技术与光刻技术相结合,可以开发出一种平台技术,实现在规定尺寸微通道中对单细胞进行长期培养。
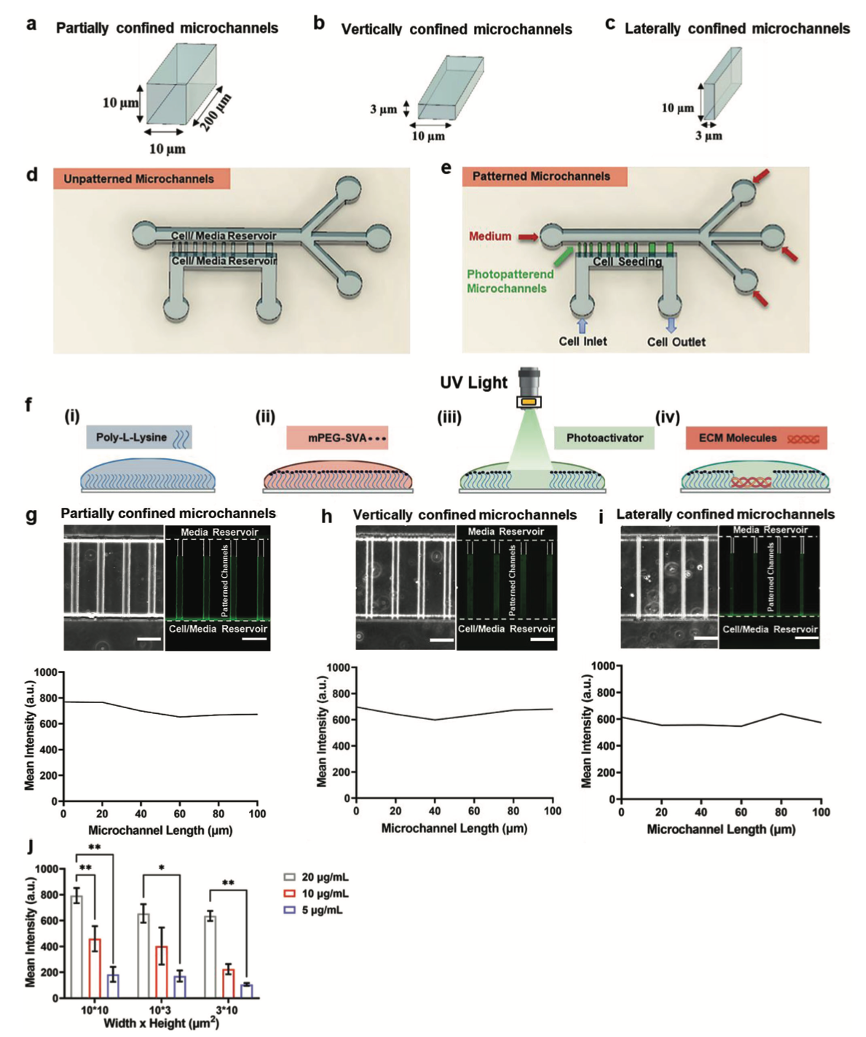
图1 利用光刻技术在微通道壁上沉积ECM
封闭环境中的细胞分裂和死亡
接下来,对部分、全部和横向封闭的微通道内的细胞分裂和存活率进行量化。作为二维对照,采用横截面积为400μm × 50 μm的胶原蛋白I涂层通道。在封闭的微环境中,相对于二维对照,18小时内分裂的细胞比例减少。在细胞禁锢的后期细胞增殖减少。同时,大多数未分裂的细胞在封闭60小时后显示其纵向面积增加。虽然细胞在非封闭和部分封闭微环境中保持较高的活力,但垂直而非横向的封闭会诱发细胞死亡。通过监测与FITC共轭的牛血清白蛋白(BSA)的扩散,验证了垂直封闭的细胞可以获得营养物质。表明细胞系之间对封闭诱导的细胞死亡的敏感性是不同的。为了将本文研究结果从基于PDMS的微机制扩展到更易受外界影响的生物环境,使用具有不同硬度和孔径的三维胶原蛋白水凝胶基质。将HT-1080纤维肉瘤细胞包裹在柔软的、平均孔径1.5 μm的水凝胶中,在3天的培养中支持细胞增殖、扩散和生存。相反,僵硬的水凝胶与减少的孔径损害了细胞伸长,阻碍了细胞生长,并促进细胞死亡。这些发现表明,细胞死亡可能发生在具有生理学相关力学的封闭微环境中。
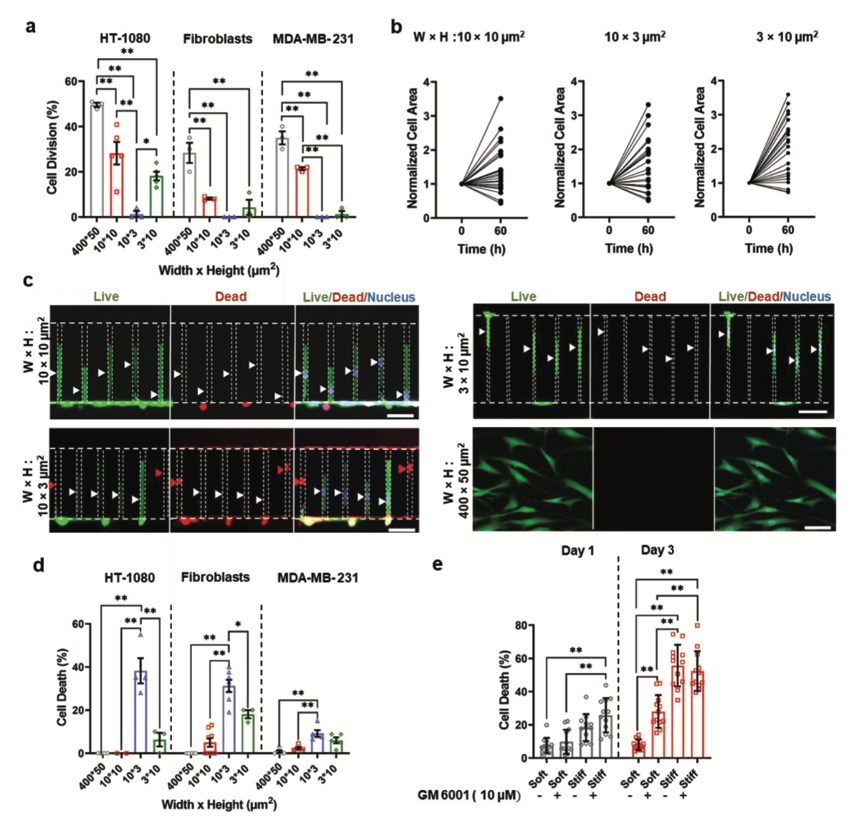
图2 三维封闭调控细胞分裂和细胞死亡
垂直封闭中P53激活引发细胞凋亡
为了确定封闭促进细胞死亡的机制,该研究分析了部分和垂直封闭微通道中皮肤成纤维细胞或HT-1080细胞表型。垂直封闭成纤维细胞在禁锢1或3天后有60%的膜出血。在垂直封闭的HT-1080细胞中,膜出血的程度更加明显。在禁锢一天后,80%的细胞显示出血的表型。在部分封闭的微通道中,无论细胞类型如何,都没有膜出血现象。用荧光延时监测HT-1080细胞表达肌动蛋白和组蛋白2B情况。结果发现碎裂细胞核的百分比随着时间的推移而增加,18小时后达到20%。大多数垂直封闭的细胞在细胞死亡期间增加了caspase-3/7的活性。相反,保持活力的垂直封闭细胞或部分封闭的细胞未能激活这些蛋白酶。这些数据显示,垂直封闭主要通过诱导细胞凋亡来保证细胞的活力。当核包膜完整性受到损害时,会渗漏到细胞质中。与存活的细胞相比,最终死亡的夹层细胞中NERs的严重程度更为明显。相反,在支持细胞存活的部分或横向封闭的微通道中,NER的频率和经历NER细胞的比例明显减少。总的来说,这些发现表明,垂直封闭促进了核包膜完整性的频繁丧失,反过来又诱导了P53依赖的DNA损伤反应,从而使细胞凋亡。
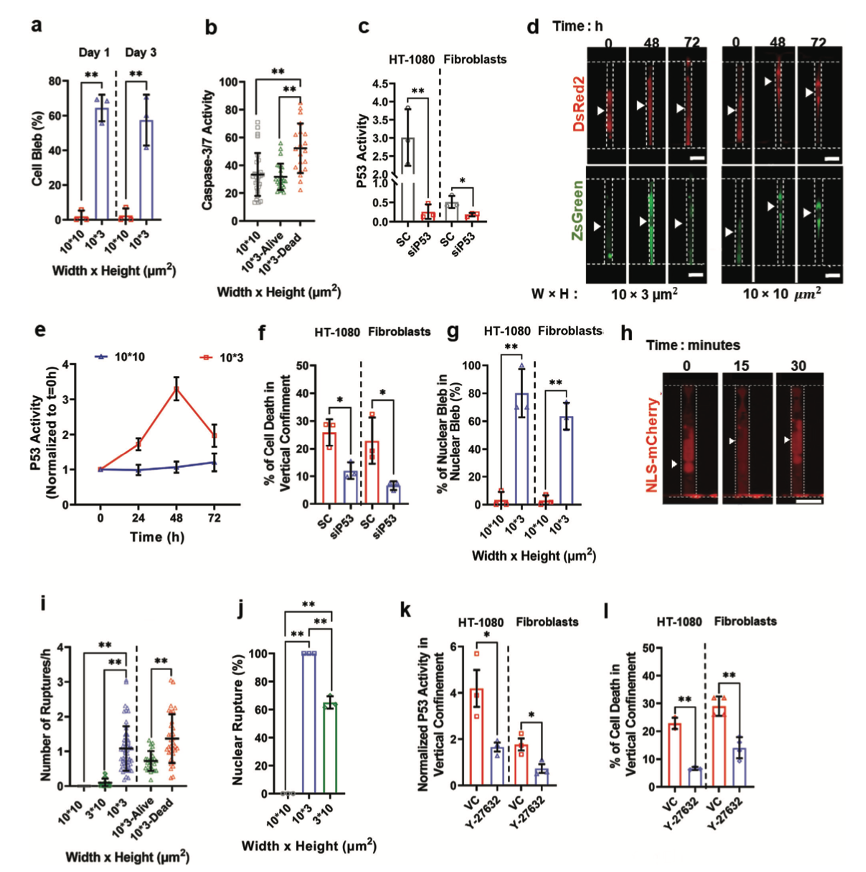
图3 垂直封闭中P53激活引发细胞凋亡
YAP进入细胞质通过降低NER和P53活性发生率促进细胞对封闭环境适应
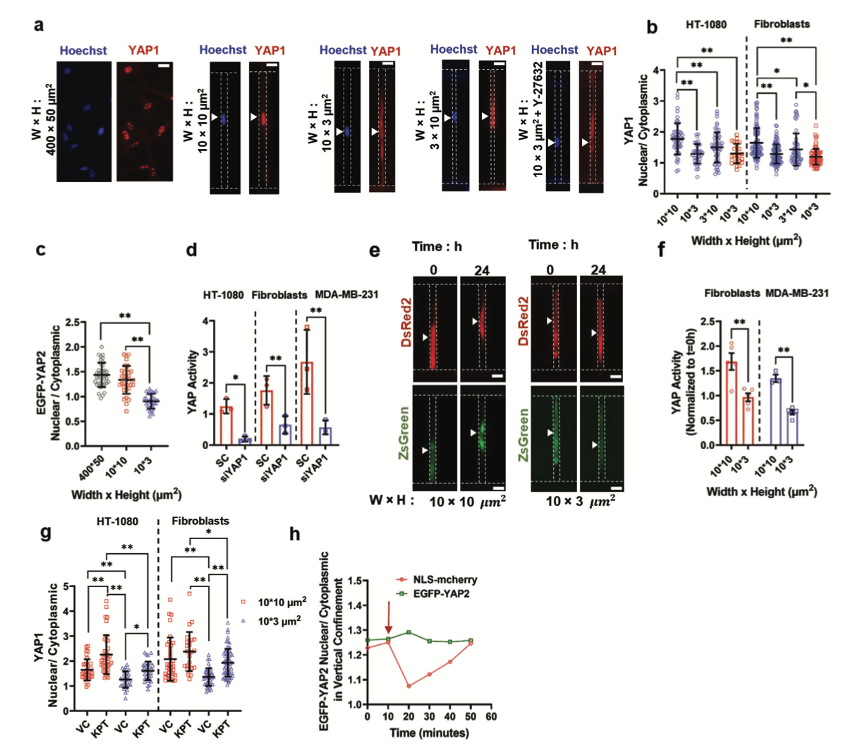
图4 封闭诱导的YAP进入细胞质中,降低YAP的活性
一部分成纤维细胞和HT-1080细胞能够适应垂直封闭并存活。此外P53活性在第3天有所下降,这表明存在一种机制来限制P53依赖的促凋亡途径激活。使用免疫荧光法,发现在细胞进入垂直而非部分封闭的微通道后,机械传导因子YAP1立即转入HT-1080细胞和成纤维细胞的细胞质中。禁锢24小时后,还观察到YAP1的细胞质定位增加。YAP1和YAP2可以通过与TEAD转录因子相关联来调节基因表达。因此,将YAP/TEAD-RE(ACATTCCA)亚克隆到LVDP载体,以量化YAP的转录活性。YAP转录活性的量化显示,在细胞进入微通道后24小时,相对于部分封闭的成纤维细胞,垂直封闭的成纤维细胞显示出YAP依赖的基因表达减少。在携带突变体P53基因的MDA-MB-231细胞中也有类似的减少,表明P53没有介导观察到的YAP活性下降。接下来研究了禁闭如何改变YAP的亚细胞分布。使用Exportin 1抑制剂处理部分和垂直封闭的细胞。核包膜破裂参与触发YAP转位到细胞质,抑制NER的侧向封闭将促进YAP的核累积。这些数据表明,RhoA/ROCK途径控制YAP核上质运输,与NER无关,可能是通过抑制Exportin 1介导的YAP1核出口。
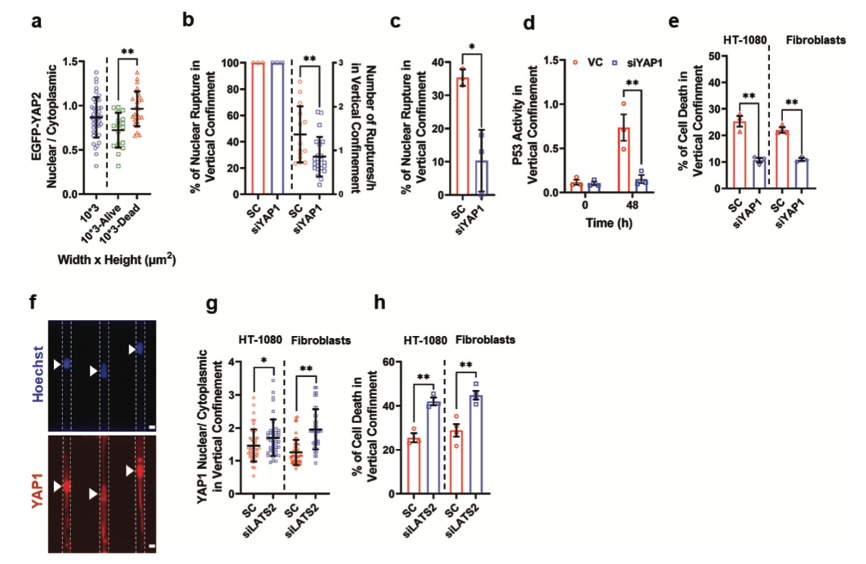
图5 细胞质中YAP积累支持细胞在封闭状态下的存活
以上研究表明YAP到细胞质出口可以由活跃的核出口机制调节,而不是由NER调节。YAP的构成性激活已证明会损害核膜的完整性。这些发现促使研究人员假设,禁闭诱导YAP进入细胞质中,抑制YAP依赖的转录活动,最终减少了NER、P53活性和细胞死亡的频率。与这一假设一致,该研究证明垂直封闭的HT-1080细胞仍然存活,相对于那些死亡的细胞,EGFP-YAP2的核水平降低。此外,该研究发现用siYAP1处理的垂直封闭的HT-1080细胞的细胞核相对于对照细胞的细胞核破裂频率较低。YAP1敲除也抑制发生NER成纤维细胞的比例,并减少了P53的激活。这种干预促进两种细胞类型在垂直封闭中的生存能力。相反,用针对LATS2的siRNA转染HT-1080细胞和皮肤成纤维细胞,使YAP磷酸化和失活,明显增加YAP1的核水平,并加剧封闭诱导的细胞死亡。总而言之,该研究数据表明,YAP活性的下调有助于细胞对封闭适应,从而使细胞存活。
综上所述,该研究利用微流控实验和成像工具,证明了封闭的几何形状和等级控制着迁移细胞的生长和生存。在封闭微环境中,肿瘤抑制因子P53是控制细胞存活和死亡的关键因素。YAP在调节NER和P53活性中具有关键作用,介导细胞对封闭环境的适应。该研究对癌症治疗有更广泛的意义,因为它产生了关于迁移肿瘤细胞如何感知和应对长期三维封闭的新理念。已有研究表明,循环肿瘤细胞被困在封闭微血管中与细胞活力的降低有关。因此,制定策略以提高细胞对封闭反应能力可能是抑制血管内肿瘤细胞生存的一种新方法。
审核编辑:刘清
-
微流控芯片
+关注
关注
13文章
274浏览量
18844 -
光刻机
+关注
关注
31文章
1150浏览量
47425 -
PLL电路
+关注
关注
0文章
92浏览量
6414 -
微流控系统
+关注
关注
1文章
76浏览量
1871
原文标题:光刻图案化+微流控技术,用于封闭环境下细胞行为和机制的研究
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
Aigtek高压放大器在介电泳的微流控细胞分离技术中的应用
ATA-7020高压放大器在微流控3D细胞微球培养中的应用




 光刻图案化+微流控技术用于封闭环境下细胞行为和机制的研究
光刻图案化+微流控技术用于封闭环境下细胞行为和机制的研究











评论