液滴微流控方法的出现极大地提高了单细胞测序的通量,然而新的问题也在不断地涌现,例如在处理复杂样品或多样品时,往往可能伴随着很多干扰因素,例如细胞碎片、杂质、空液滴等,针对这些问题需要额外的方法进行处理优化,不仅影响测序工作效率,同时进行过多的处理还会影响细胞活性,最终导致总体RNA捕获效率较低。因此,现阶段的研究方向之一就是优化分选获得单细胞的步骤,尽可能获得单细胞中全部的mRNA。
近期,Sarah A. Teichmann和Florian Hollfelder团队在Nature Communications期刊上发表了一篇题为“spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content”的研究论文,提出了一种基于液滴微流控平台且最大限度地提高单细胞测序信息内容的新方法。
SpinDrop是一种可扩展的液滴微流控方法,能以较低的成本对单个活细胞、完整细胞核、多聚甲醛固定样本或靶细胞类型进行高灵敏度的3’ mRNA测序。
该方案的新颖点有两个方面,其一是采用荧光激活液滴分选蛋白(FADS)标记细胞来专门分选提取目标细胞(图1B、1C),其二是采用多步骤加酶和微注射(Picoinjection)技术向液滴中加入了逆转录酶(图1D)。
实验证明,与inDrop单细胞测序方法相比,该研究提出的基因检测率提高了5倍,与10x Chromium平台相持平,同时显著降低了与空液滴和质量差的细胞相关所造成的噪音。
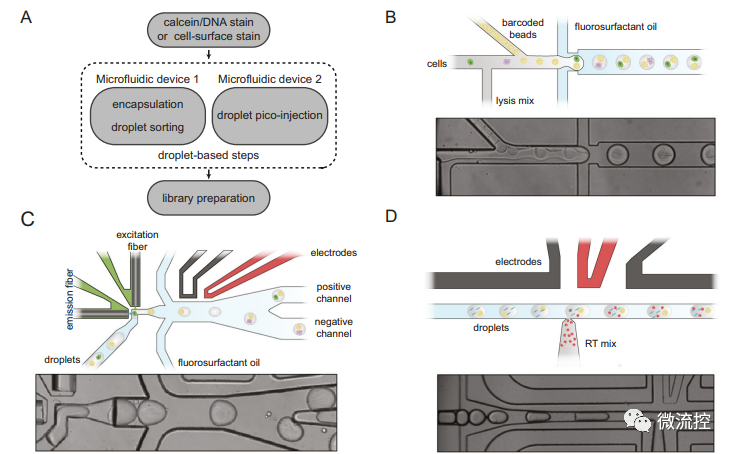
图1 spinDrop的模块化液滴微流控工作流程概述
FADS法分选单个活细胞
针对采用FADS方法分选单个活细胞的可行性,该文章进行了多个实验验证。
为证明FADS方法富集含有单个细胞液滴的能力,研究人员使用Calcein-AM染液对HEK293T细胞进行染色,设定细胞荧光信号的阈值,通过FADS方法分选富集(只分选不裂解细胞),发现含有单个活细胞的液滴富集程度高达96.1%(图2B)。
为进一步验证FADS方法的潜力,研究人员将测试细胞修改为1:1比例的死和活的HEK293T细胞,对混合的死细胞和活细胞进行分选,结果显示,在荧光显微镜下,含有细胞的液滴池中,活细胞的丰度显著提高了19倍。84.8%的液滴含有单个活细胞,超过了未经分选的预测值4.52%。
该研究还对丢弃空液滴是否会导致空液滴产生的背景噪声读数比例更低(图2D)以及测试使用FADS方法富集特定类型细胞的能力(图2C、2E、2F)进行了实验论证,并取得了较为理想的结果。验证了FADS法分选单个活细胞可行性。
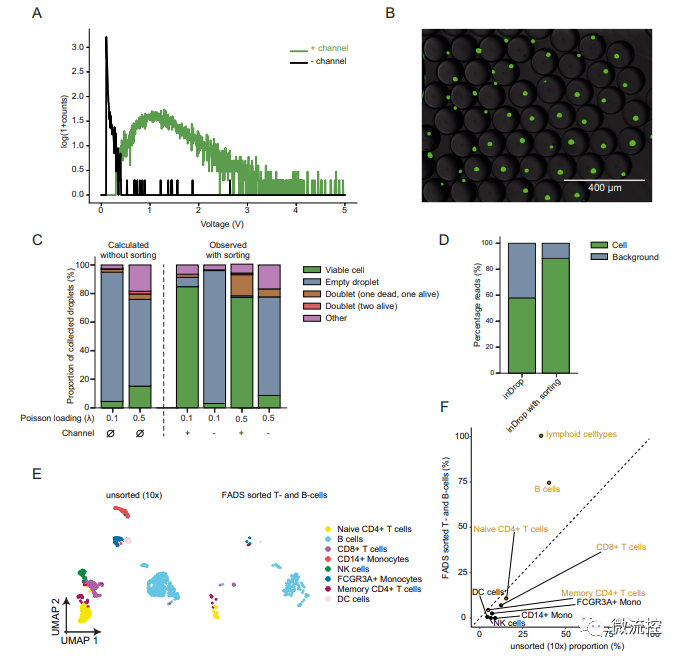
图2 利用FADS方法分选单个活细胞可降低空液滴和死细胞的背景噪声
多步骤加酶和微注射技术向液滴中加入逆转录酶
该论文指出采用热变性和蛋白酶K方法裂解细胞可以增加RNA产量,但与逆转录酶的工作温度不兼容,且液滴内容物含量在封装后不能再被调节,这就妨碍了在逆转录之前进行有效的细胞裂解,因此提出通过在液滴封装阶段就加入裂解液进行裂解,然后再通过微注射步骤将改进的逆转录混合酶注射到液滴后进行逆转录的方法,将裂解和逆转录两步骤分开进行。在不影响逆转录的前提下,该方法可以实现对细胞更为充分的裂解,从而捕获更多的RNA。
在用酶方面,该研究采用蛋白酶K对细胞进行裂解和热变性处理可以使基因检出率提高了三倍以上,同时使用Superscript III RT酶进行逆转录,使得最终检测到的基因高于其他用酶配方(图3A)。
该研究还将spinDrop与10x Chromium和inDrop的基因检测灵敏度进行了比较,结果表明,spinDrop检测到的基因中位数远大于inDrop,略高于10x Chromium(图3B)。
此外,该研究还对spinDrop方法的可重复性进行了测试(图3C、3D),并对spinDrop方法在微注射步骤中分隔单细胞并防止液滴合并的有效性(图4E),以及采用spinDrop方法检测多聚甲醛固定的细胞样品的可行性进行了验证(图3F),以上验证实验最终都取得了理想的结果。
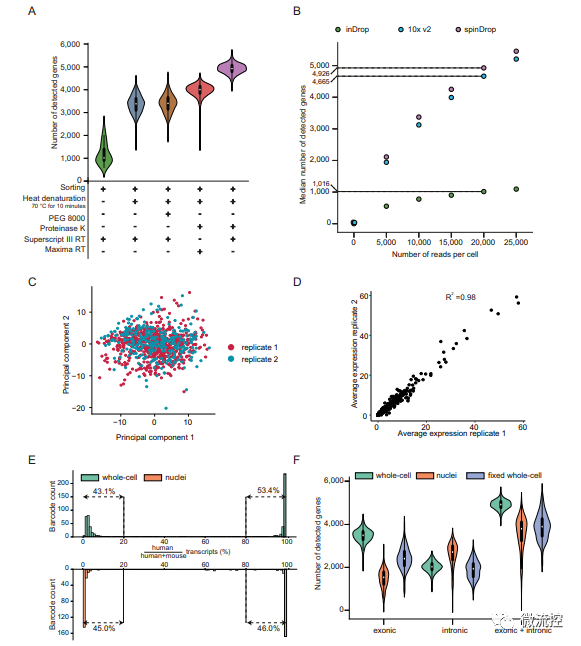
图3 改进的逆转录混合酶和微注射混合酶后提高RNA捕获效率
研究人员后续还对高度受损的胚胎小鼠大脑样本进行了分析,以验证spinDrop是否可以用于提高低活力生物样品的转录组学质量(图4),并通过采用scEU-seq中的代谢标记方法标记新生RNA,验证了spinDrop平台高通量揭示小鼠器官发生过程的可行性(图5),从而进一步验证了spinDrop在基因测序方面的优势。
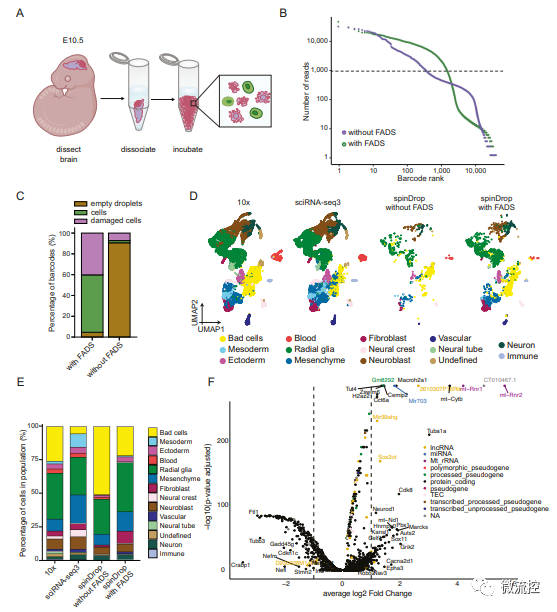
图4 使用spinDrop方法生成的发育阶段E10.5胚胎小鼠大脑的转录图谱 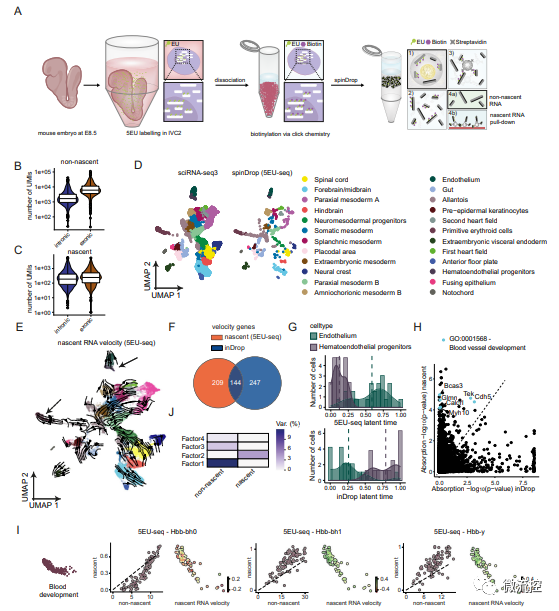
图5 使用5EU-seq标记新生RNA经spinDrop测序后生成的小鼠器官发生过程中的转录动力学
总而言之,spinDrop技术建立在inDrop基础上,且与之相比有很大的进步,与常见的10x Chromium平台相比也有一定优势,具备10x Chromium平台所不具备的能力,例如进行新生RNA测序和器官生发过程的揭示。基于液滴微流控的spinDrop单细胞测序法旨在从少量样品中高灵敏度的获取单细胞全部的RNA并建立文库,同时将受损细胞和空液滴所造成的背景噪声降至最低,做出更为准确的结果。
审核编辑:刘清
-
RNA
+关注
关注
0文章
46浏览量
9769 -
微流控系统
+关注
关注
1文章
80浏览量
1925 -
微流控器件
+关注
关注
0文章
43浏览量
3243
原文标题:基于液滴微流控的"spinDrop"单细胞测序法,可提升mRNA捕获效率
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐




 基于液滴微流控的单细胞测序法可提升mRNA捕获效率
基于液滴微流控的单细胞测序法可提升mRNA捕获效率











评论