数字PCR(dPCR)技术由于其绝对定量的能力和极高的灵敏度,被广泛的应用于分子诊断领域。然而,与目前的金标准定量PCR(qPCR)相比,dPCR在动态范围上落后了3 ~ 4个数量级,这极大地限制了其在临床领域的应用。例如,对一些载量范围波动较大的病毒感染样本进行定量时,高载量的样本往往会使dPCR显全阳性而无法通过泊松分布定量。因此,亟需开发一种比目前的dPCR动态范围更大且简便易用的新的dPCR策略。
近期,上海科技大学刘一凡课题组与中科院上海微系统所、南方医科大学南方医院团队合作开发了荧光编码对数稀释数字PCR技术(Flodd-PCR),该方法展示出的动态范围为10⁷,比传统dPCR高了逾两个量级。相关研究成果以“Fluorescence-coded logarithmic-dilution digital droplet PCR for ultrawide-dynamic-range nucleic acid quantification”为题,发表在Biosensors and Bioelectronics期刊上。上海科技大学物质科学与技术学院刘一凡课题组2023届硕士毕业生施清源、2021级博士研究生李婕、南方医科大学南方医院检验科刘春辰博士为本文共同第一作者,上海科技大学刘一凡研究员、中科院微系统研究所罗源副研究员、南方医科大学南方医院郑磊教授为本文通讯作者。
Flodd-PCR基本工作原理
如图1所示,Flodd-PCR的基本原理为在一次dPCR反应中引入四种对数稀释的样本浓度,每种稀释倍数分别对应一种浓度指示剂荧光强度;在PCR后,液滴将被根据荧光强度拆分成四组,每组分别进行拷贝数定量。如此以来,一次Flodd-PCR实验约等效于四组进行梯度稀释的、平行的dPCR实验,从而大幅提高了动态范围。
为了实现上述概念,研究团队首先设计并开发了一种微流控芯片,该芯片能够实现对检测样本的连续对数梯度稀释(20 ~ 1000倍)和并行液滴生成(图2),Flodd-PCR芯片一共有两个入口,一边通入待检测的模板DNA样本和荧光指示剂,一边通入PCR所需的其他试剂:酶、引物、探针等。上述两种溶液经过连续梯度稀释后将生成4组液滴,每组的液滴内DNA模板和荧光指示剂都稀释在一个特定的浓度,同时又使其他试剂(如引物、探针和聚合酶等)保持在正常工作浓度。在热循环后,利用商业化数字PCR液滴阅读仪同时读取PCR探针荧光和稀释指示剂荧光,最终根据荧光指示剂将混合的液滴分成四个聚类,并分别计算拷贝数。
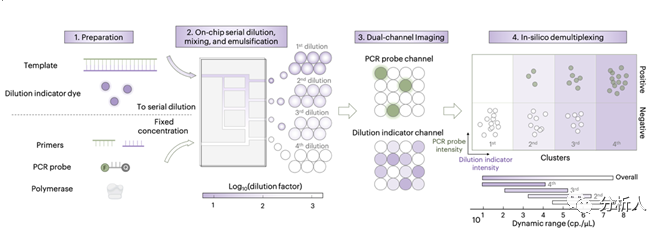
图1 Flodd-PCR原理流程图
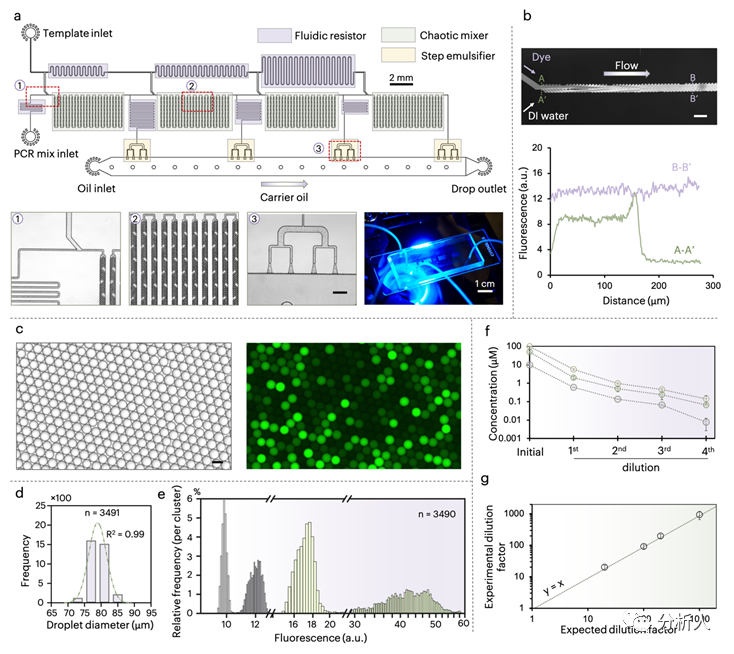
图2 Flodd-PCR芯片设计及稀释性能表征
Flodd-PCR的动态范围表现及临床有效性验证
接下来,研究团队通过一系列实验表征了Flodd-PCR的实际动态范围,如图3所示。实验结果表明常规dPCR的动态范围仅为4 ~ 40,000拷贝/µL,而Flood-dPCR得益于连续梯度稀释的功能,能够将检测动态范围扩宽到4 ~ 20,000,000拷贝/µL。此外,团队还将Flodd-PCR和其他的代表性高动态范围dPCR方法进行了横向比较,结果表明Flodd-PCR在实现超高动态范围的同时并没有增加液滴的数量,这意味着Flodd-PCR的液滴读取和传统dPCR一样简便。
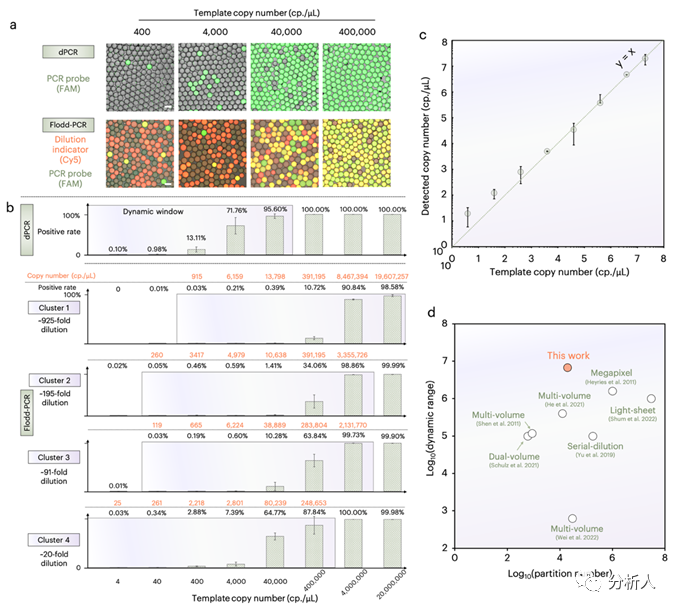
图3 Flodd-PCR的动态范围标准
最后,为了验证Flodd-PCR在临床检测上的实用性,研究团队将其应用于临床患者样本中人乳头状瘤病毒HPV(16型)的定量检测。HPV-16作为高危病毒类型可以在70%的宫颈癌病例中发现,其病毒载量的动态区间可达10⁷以上,远超出了传统dPCR的动态范围(约10⁵)。实验结果表明(图4),得益于更高的动态范围,Flodd-PCR的定量成功率优于dPCR,其定量结果也和金标准qPCR高度一致。以上结果表明,Flood-PCR技术可以运用到真实的临床案例中。
综上所述,Flodd-PCR是一种新颖的超高动态范围的数字PCR技术,其巧妙地运用了微流控技术和荧光编解码策略,实现了多种浓度样本检测的“多路复用”。此外,Flodd-PCR在操作流程上与传统数字PCR高度一致,甚至兼容商业化数字PCR设备,这使得该技术在实际推广上具有重要优势。
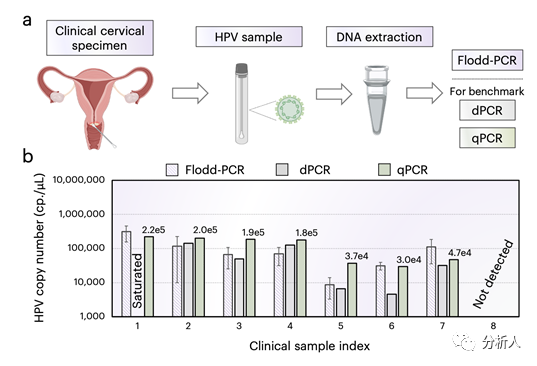
图4 Flodd-PCR对临床HPV样本的高动态范围定量
审核编辑:刘清
-
编解码
+关注
关注
1文章
140浏览量
19634 -
PCR
+关注
关注
0文章
118浏览量
19611
原文标题:荧光编码对数稀释数字PCR技术,实现超宽动态范围的核酸定量
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
磁编码器与数字信号处理的关系
固态光源点亮荧光原位杂交技术---提升生物医学研究和临床诊断新选择

什么是无杂散动态范围 (SFDR)?为什么 SFDR 很重要?
求助,光电探测器的检测,使用TIA方式还是对数放大器检测的动态范围,精度更高?
荧光检测器适用范围有哪些
荧光检测器用来检测什么物质
荧光检测器激发波长和发射波长怎么设置
PMP21783.1-60W、超宽范围电源 PCB layout 设计

超宽带技术UWB的应用是什么

基于机智云物联网的PCR温度控制

介绍一种用于绝对定量的微腔式数字PCR微流控芯片
超宽输入范围铁路电源解决方案之分析与比较
了解成像系统中的动态范围




 荧光编码对数稀释数字PCR技术实现超宽动态范围的核酸定量
荧光编码对数稀释数字PCR技术实现超宽动态范围的核酸定量












评论