元素周期表
我们现在知道,一般的原子和物质材料的结构组成比玻尔模型复杂得多,质子和中子也可以进一步细分为更小的部分。
幸运的是,这个模型确实描述了元素的基本结构,可以解释不同元素的属性。元素之间的电子、质子和中子的数量不同。大自然把亚原子粒子有序地结合在一起。了解一些支配原子结构的规则,有助于我们了解半导体材料和加工化学品的特性。原子(也就是元素)的范围从最简单的氢(1电子),到最复杂的一个,铹元素(有103个电子)。氢在原子核中只有一个质子和一个电子。
这排列说明了原子结构的第一条规则:在每一个在原子中,质子和电子的数量是相等的。2.每个元素都有特定数量的质子,没有两个元素有相同数量的质子。比如氢,它有一个质子原子核,而氧原子有八个。
为呈现这一具体规律,科学家们为每个元素分配数字,作为原子序数,它等于质子数(因此原子中的电子。元素的基本参考是元素周期表(下图所示)。元素周期表中每个元素都有一个方框,也就是由两个字母确定。原子序数在左上角这个位置。因此,钙(Ca)的原子序数是20,所以我们知道钙原子的原子核里有20个质子和20个电子统。中子是一种电中性粒子,它和质子一起形成增加了原子核的质量。
元素的原子结构如下图所示。1、氢;2、锂;11、钠。在构建图表时,有几个规则电子在它们的轨道上的位置。规则是:每个轨道(n)都能容纳2n^ 2个电子。轨道的数学解中的1表示:第一个电子轨道只能容纳两个电子。这条规则迫使锂的第三个电子进入第二环。该规则限制了第二环的电子数为8,第三环的电子数为18。所以,在构建钠原子的图解时它有11个质子和电子,前两个轨道占用10个电子,第11个在第三个轨道。
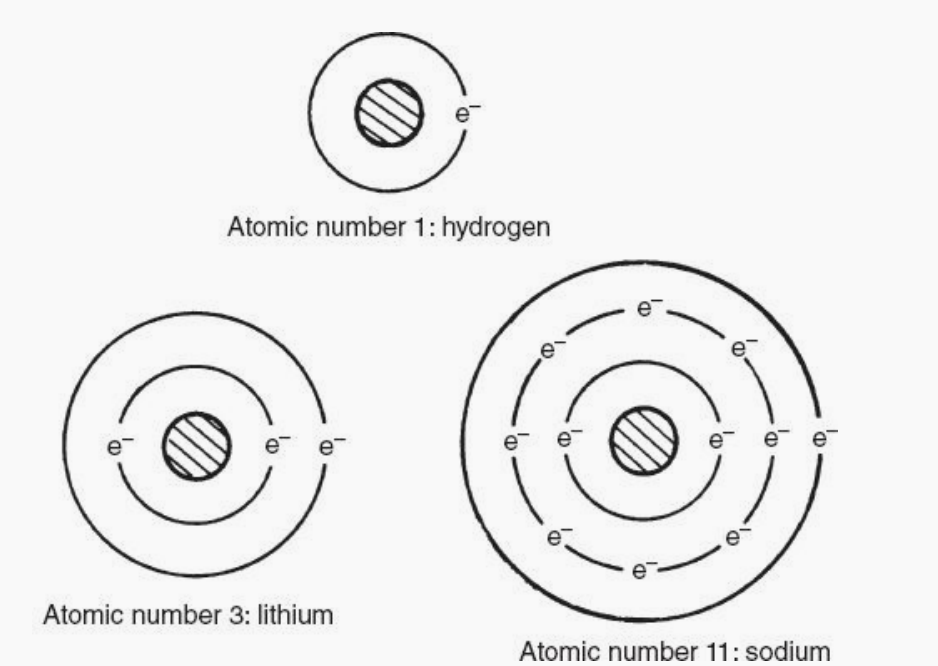
这三个原子有一个共性。每个原子的外圈里面只有一个电子。这说明了元素的另一个可观察到的事实。
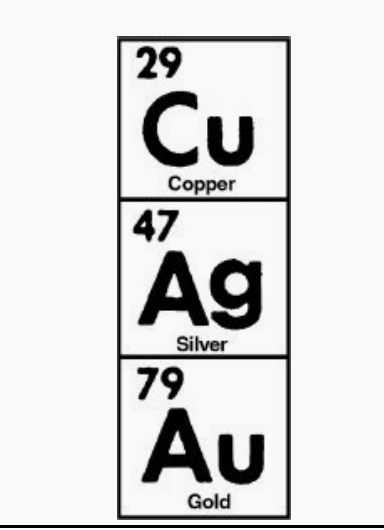
具有相同数量外轨道电子的元素具有相似的属性。这一规律反映在元素周期表中。注意氢,锂和钠出现在表格中一个垂直的列上,标有罗马数字1 (I)。列号代表的是数外环上的电子和每一列上的所有元素有相似的属性。所据此我们可以解释是,三种最好的导电体(铜、银、和金)都出现在元素周期表的同一列(Ib)(下图所示)。原子结构还有两个规则可以了解半导体。
元素的最外圈被填满或内部有8个电子时是稳定的结构。这些原子在化学上比有部分填充的元素更加的稳定。原子寻求与其他原子结合以创造稳定的状态,通过形成共享电子的方式,形成在最外圈达到8个电子上网稳定态。上面两个规则影响了n型和p型半导体材料的产生。
审核编辑:刘清
-
半导体
+关注
关注
334文章
26937浏览量
215177
原文标题:半导体行业(二百一十七)之半导体材料特性(二)
文章出处:【微信号:FindRF,微信公众号:FindRF】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐




 半导体行业之半导体材料特性(二)
半导体行业之半导体材料特性(二)














评论