研究背景
锂离子电池的改进对于实现车队的广泛电动化至关重要。目前,实现这一目标的最大障碍之一是缺乏价格合理的高能量密度电池。用锂金属负极解决了这些问题,使其成为该领域日益受到研究的话题。适当选择电解质对于确定电池的安全性、容量和循环寿命至关重要,尤其是在使用锂金属负极时。液体电解质的最大优点之一是组分(盐、溶剂和添加剂)易于合成,具有所需的功能化以改变 SEI 结构和组成。不幸的是,用碳酸酯电解液循环的锂金属负极上产生的SEI是厚的,多孔的,不均匀的,对体积变化很脆弱,并且无法抑制枝晶生长,导致与使用醚基电解质相比观察到的性能较差。因此,通过选择改性碳酸酯基电解质,可以在很大程度上保持对高压正极的氧化稳定性,同时可以形成由所需产物组成的SEI,以产生能够在各种电位下运行的能量密集型锂电池。
成果简介
近期,罗德岛大学Brett L. Lucht教授团队通过创新性地对碳酸酯基电解质进行的不同优化,包括不同类型和浓度的盐和添加剂,以产生具有有益特性并提高锂电池整体性能的SEI。未来的电解质设计选择可以针对电池的应用定制碳酸酯基电解液。
该工作以“Modification of Carbonate Electrolytes for Lithium Metal Electrodes”为题发表在期刊ACS Energy Lett上。第一作者为罗德岛大学Munaiah Yeddala。
研究亮点
(1)研究不同锂盐和溶剂的组合对电极的优化
(2)研究不同溶剂电化学反应路径与界面行为
(3)提出新型的添加剂并对现有碳酸酯电解质进行展望
图文导读
图1是本次实验所用的锂盐与添加剂的结构与化学式
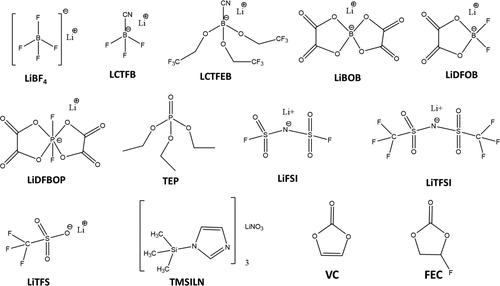
图1 本观点中讨论的锂电池电解质中使用的盐和添加剂的化学结构
环状碳酸酯
环状溶剂的一般分解反应如图2a–c所示。环状碳酸酯通常包含在电解质混合物中,因为正极表面的稳定性提高,锂盐的强溶剂化以及负极表面的良好钝化。EC和PC很容易在电压∼0.8-1.0 V与Li/Li下发生单电子开环反应,这与SEI形成的初始阶段相吻合。虽然EC还原的确切机制仍在争论中,但在SEI中形成的初始还原产物是二碳酸乙烯锂(LEDC)和乙烯气体。虽然由于电极不稳定,通常避免在石墨负极上使用PC,但PC可用于锂金属负极以形成类似的还原产物,即二碳酸锂丙烯(LPDC)和丙烯气体。
随着循环的继续,已知由这些组分形成的SEI会演变和变化,这可能是由于锂金属负极上的烷基碳酸锂LEDC和LPDC的不稳定性。在热、微量水或一些锂盐存在下,LEDC可以分解溶解以增加SEI的孔隙率,从而导致电解质持续还原生成Li2CO,以及其他与锂盐相关的还原产物。这导致在循环电池的负极上多层SEI的产生,其内部SEI由无机物质组成,包括LiF。与EC或PC不同,FEC是一种环状碳酸酯,由于在相对较高的电位1.1 V与Li/Li下还原,因此可用作助溶剂或添加剂。
在含FEC的电解质中,TEM分析显示锂负极上形成均匀的纳米结构SEI(图2d),EDX分析显示SEI由覆盖LiF纳米颗粒组成和一氧化碳,LiF纳米颗粒导致均匀的扩散场,导致锂的更均匀的电镀和剥离,这也抑制了Li枝晶的生长。随着循环的继续,FEC的还原也产生了一系列有机物质,覆盖任何最初沉积的LiF,形成外部聚合物有机SEI层,该层比碳酸酯电解质混合物通常观察到的更薄。
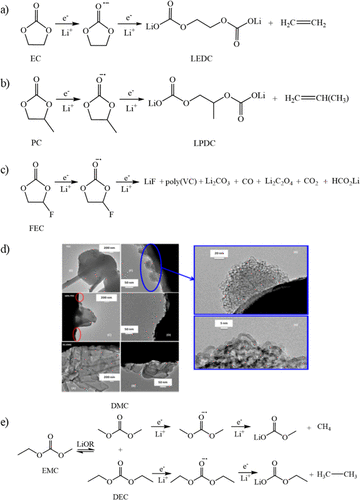
图2. a)碳酸乙烯酯、(b)碳酸丙烯酯和(c)氟碳酸乙烯酯的广义分解反应。(d) 在FEC电解质中形成的纳米结构SEI的TEM图像。(e) 碳酸甲乙酯、碳酸二甲酯和碳酸二乙酯的广义分解反应。
线性碳酸酯
电解质中的线性碳酸酯与环状碳酸酯具有不同的用途,因为它们具有较低的熔点和较低的粘度,当与EC或PC混合时,在电化学稳定性窗口中具有更高的离子电导率和协同效应。在线性碳酸酯中,最常用的溶剂是DMC,DEC和EMC。DMC和DEC都经历了类似的还原过程,唯一的区别是碳链长度,分别生成CO,甲烷/乙烷,甲醇锂/乙醇锂和碳酸甲酯锂/碳酸乙酯锂。由于分子的不对称性,EMC可以与电解质中的锂醇盐进行酯交换反应以形成DMC和DEC,从而产生产物的混合物,包括CO,甲烷,乙烷,碳酸甲酸锂,碳酸乙酯锂,甲醇锂和乙醇锂(图2e)。虽然溶剂中线性碳酸酯的选择不会对电池的电化学性能产生很大影响,但研究表明,产生的SEI通常由所用环状碳酸酯的还原产物而不是线性碳酸酯还原产物主导。因此,任何为改善锂负极循环性能而定制SEI的电解质修饰都应主要集中在对环状碳酸酯或盐的调整上,或者掺入添加剂或其他助溶剂,这些添加剂或其他助溶剂将优先减少以形成更稳定的SEI。
碳酸酯的缺点和替代品
与镀锂和剥离相关的体积变化是SEI产品演变为多层结构的主要原因。由标准碳酸酯电解质形成的SEI相当刚性,因此随着锂电镀和剥离的继续,SEI无法膨胀以适应体积变化,导致SEI出现裂纹。这会将新鲜的锂暴露于新的电解质中,随着更多分解产物的形成和演变,导致电解质持续降解和更厚的SEI。据报道,锂金属电池中SEI膨胀的证据,导致电解质与锂表面紧密接触,锂腐蚀和电解质耗尽。然而,靠近表面的富含无机物的物种导致更少的肿胀和更好的整体电池性能。
此外,表面上不均匀层的存在会导致锂的非均匀沉积,最终导致锂枝晶形成和随后的电池失效,如果枝晶穿透隔板并使电池短路。由碳酸酯形成的SEI也可以具有绝缘性能,导致形成死锂,其中未反应的金属锂完全包裹在较厚的SEI层中,但与负极中的导电性断开,因此无法参与电化学剥离或电镀。枝晶和死锂的形成如图3a所示,它们是锂金属负极电池失效的重要因素。因此,SEI的柔韧性和稳定性是减少枝晶形成和死锂以及提高锂金属负极容量保持性的关键。
除碳酸酯溶剂外,其他最常用的锂金属负极电解质是醚基电解质系统。虽然不是本观点的重点,但使用各种醚(如二甲氧基乙烷(DME)或1,3-二氧戊环(DOL))在提高锂金属负极的循环寿命、锂金属电镀和CE性能方面已经取得了重大进展。这主要是由于形成的高度柔韧性的SEI,由LiF和Li的内层组成。和外层含弹性体的聚醚,如图3b所示。这种聚合的SEI对锂的体积变化更灵活,并且能够通过抑制枝晶的形成来延长锂金属负极的寿命。然而,醚在高电位下的不稳定性极大地限制了它们在具有高压正极的高能量密度全电池中的应用。因此,对碳酸酯基电解质中的不同组分进行简单修改,在SEI中提供与醚基电解质相似的柔韧性。
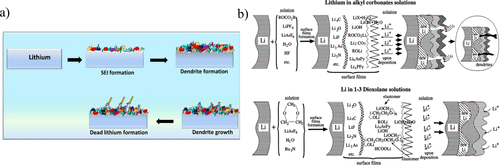
图3. (a) SEI中枝晶生长和死锂的示意图。(b) 碳酸酯和醚基电解质中金属锂上的SEI示意图。
碳酸酯电解质的改性
盐的选择
为电解质选择的盐是构成SEI的分解产物的重要贡献者。例如,一些盐在第一个镀锂循环中优先减少,而另一些盐仅在地层循环完成后才开始分解。因此,选择与锂金属负极循环的盐是一种重要的改性,可以极大地影响电池性能。
一项对Li/Cu电池的研究了九种不同的盐(六氟磷酸锂(LiPF6)、四氟硼酸锂(LiBF4)、六氟砷酸锂(LiAsF6)、高氯酸锂), 双(三氟甲磺酰)亚胺锂 (LiTFSI), 三氟甲磺酸锂、双(草酸)硼酸锂 (LiBOB)、二氟(草酸)硼酸锂 (LiDFOB) 和碘化锂 (LiI)),并将DOL掺入每种电解质(现在的PC:DME:DOL(1:1:1,v / v)),发现LiPF6的电池电阻增加了,但LiBOB电池(LiBOB-2)的阻抗降低了,如图4a所示。对这种现象的一种可能的解释是,将DOL添加到LiBOB溶液中可以防止盐的继续分解反应,而LiPF6的路易斯酸度实际上促进了DOL的聚合,从而促进了电解质的消耗。因此,只要以某种方式控制分解程度,LiBOB就能够形成均匀的SEI层。
基于观察到的LiBOB作为盐的改善性能,对盐中含氟和/或草酸盐的部分产生稳定SEI的益处进行了进一步的研究。为此,Cu / LFP电池用1.2M LiPF6、1.2 M LiDFOB、0.6 M LiBOB 或 0.6 M LiBOB + 0.6 M LiBF4在相同的EC:EMC(3:7,v/v)溶剂中。有趣的是,1.2 M LiDFOB电解质在所有电解质中具有最佳性能,甚至优于LiBOB / LiBF4电解质,尽管在SEI中具有相似的化学成分。由LiDFOB分解形成的SEI含有纳米结构的LiF(5-10nm),这是草酸盐离子作为封端剂的结果,从而产生均匀的扩散梯度并允许均匀的镀锂,如图4c所示。相比之下,LiBOB / LiBF4电解质产生更大的LiF颗粒(>300 nm)和不均匀,不稳定的SEI,因为LiBOB不断分解,导致循环不良。这表明SEI的纳米结构和形态在锂剥离/电镀中起着比通常考虑的更重要的作用。LiDFOB电解质的进一步优化是在Cu / LFP电池上进行的,这些电池已经用含有不同比例LiP6F的EC:DMC或FEC:DMC(1:4,w/w)电解质循环和 LiDFOB 加起来达到 1.0 M。在含有EC:DMC的电池中,性能最佳的电池含有1.0 M LiDFOB,而具有FEC:DMC溶剂混合物的最佳电池含有0.05–0.10 M LiDFOB和0.95–0.90 M LiPF6。图4b中的红外光谱表明,SEI中由含LiDFOB的电解质产生的主要物质是Li2C2O4以及纳米结构的LiF。低浓度LiDFOB,LiPF6的组合作为主要盐,FEC作为助溶剂大大提高了锂金属负极的电化学性能,从而证实了多种SEI形成组分之间的协同作用。
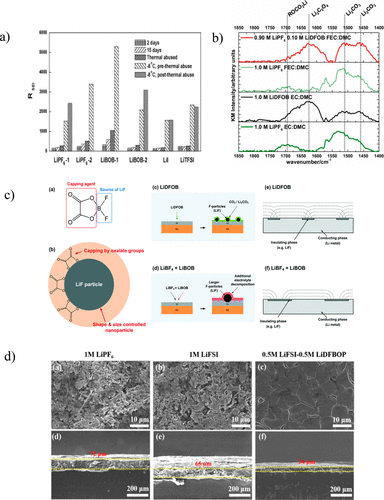
图4. (a) 不同电解质储存在不同时期和不同温度下的Li/Li对称电池的阻抗。(b) 在含LiDFOB的电解质中循环的锂电极的红外光谱。(c) 含 LiDFOB 电解质中的纳米结构 SEI 形成机制经参考文献许可转载(57).版权所有 2018 英国皇家化学学会。(d) 双盐电解质中锂电极上SEI的SEM图像(俯视图和横截面)。
盐的混合物
由于多种SEI形成组分已被证明是有益的,特别是在层状和稳定的SEI的受控生成中,因此利用两种盐的混合物可以产生协同效应并提高锂金属负极的容量保持率。因此,制备了含有0.5 M LiFSI(以减少电压极化)和0.5 M二氟双(草酸)磷酸锂(LiDFBOP)(优先还原并形成有益SEI产物)的电解质在EC:FEC(3:7,w/w)中,并用Li/Li和Li/LFP电池循环。使用双盐电解质循环的Li/Li电池在1000小时内具有出色的长期循环性能,而使用EC:EMC(1:3,w/w)和7 M LiPF6中1 M LiFSI构建的电池在EC:EMC(3:7,w/w)分别在电镀和剥离仅500和350小时后开始表现出增加的极化。性能的差异可以部分归因于由每种电解质形成的SEI的微观结构,如图4d所示。双盐电解质形成致密、光滑、均匀的SEI,有助于防止电解质持续还原并抑制枝晶和死锂的产生,而单盐电解质产生多孔、不均匀和厚实的SEI,导致锂沉积不均匀。因此,如果锂金属表面的预处理可用于产生类似的纳米结构的层状SEI,那么在不显着消耗电解质的情况下,可能会提高性能。然后,通过仔细添加其他协同成分(例如其他盐或添加剂),可以进一步提高循环性能。
新型添加剂合成
当预先存在的添加剂具有局限性时,例如LiNO3的溶解度差但性质好,可以合成具有相似结构或产生相似分解产物的新型添加剂。例如,合成了一种新的路易斯碱加合物1-三甲基硅基咪唑硝酸锂(TMSILN)以掺入LiNO3。作为添加剂进入电解质中,无需额外的组分来增加溶解度。由于氮部分与锂原子的配位,TMSILN可溶于高达1.0wt%。不含添加剂的电解液Li/Li对称电池在200 h后出现突然的电压极化,但含有1 wt%TMSILN的电解液在500 mA/cm的电流密度下稳定循环超过1 h。在Li/NCM622电池中应用这种电解质会产生类似的结果,含TMSILN的电解质在90次循环后保留约200%的容量,而基线电解质在第80次循环中仅保留183%的容量(图5a)。使用TMSILN电解质的第一个循环的差分容量分析表明,与基线电解质相比,添加剂的过电位较低,这意味着电阻较低,这可能是由于LiNO3分解导致电导率提高从加合物。TMSILN添加剂还会影响电池中锂的物理沉积,其中基线电解质在裸铜箔上产生不均匀的枝晶,但TMSILN电解质沉积球形锂成核,导致更有利的锂沉积(图5a的插图)。使用TEM和XPS对负极表面的进一步分析表明,含有氮分解物质的SEI生长薄层。因此,从LiNO3获得的许多有益特性仍然可以使用新型加合物添加剂来实现,同时避免溶解度限制等潜在缺点。
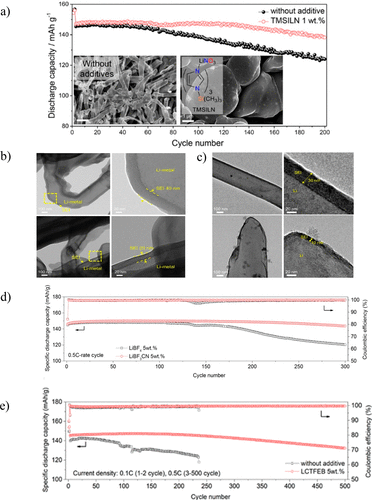
图5. a) 含有1M LiPF6的Li/NMC532电池的电化学性能在EC:EMC(3:7体积%)电解液中,带和不带LTMSILN。插图显示了用 1 M LiPF6 循环电解锂的 SEM 图像在EC:EMC(3:7体积)电解液中。(b) 锂电沉积在LiBF中的TEM图像4-含电解质(顶部)或含LCTFB的电解质(底部)。(c) 锂电沉积在 1.0 M LiPF 中的 TEM 图像6在EC:EMC(3:7,v/v)中,不带(顶部)和5wt%LCTFEB(底部)。(d) 含有 5 wt% LiBF4 的 Li/NMC532 电池的循环数据电解质和 5 wt% LCTFB 电解质。(e) 含有不含添加剂的标准电解质和 532 wt% LCTFEB 的 Li/NMC5 电池的循环数据。
另外,合成了具有这些基本特性的两种添加剂三氟(氰基)硼酸锂(LiBF3CN或LCTFB)和氰基三(2,2,2-三氟乙基)硼酸锂(LiB(OCH)2CF3)3CN,或LCTFEB),并与LiBF4进行比较。尽管具有相似的结构(图1),但电池性能和SEI特性都因添加剂的选择而异。循环 Li/Li 对称电池,频率为 1 mA/cm2LCTFB电解质的稳定循环超过650小时,LCTFEB电解质的循环稳定超过500小时,但LiBF4的电池失效在400小时内发生,对于不含添加剂的标准电解质,在200小时内发生。为了分析更实用的锂金属电池中的电解质,构建了Li/NCM523电池并在0.5C下循环。300次循环后,电池用LiBF4循环容量保持率为83.1%,而用LCTFB电解质循环的电池的容量保持率为98.4%,电压迟滞显着降低(图5d)。相比之下,使用无添加剂电解质循环的电池在84次循环后具有2.236%的容量保持率,而使用LCTFEB电解质循环的电池在91次循环后具有0.500%的容量保持性(图5e)。添加剂上配体的选择也会影响沉积的锂和随后形成的SEI的形态。在标准电解液中,不含添加剂,含LiBF4,苔藓状针状枝晶沉积在表面上,而LCTFB和LCTFEB电解质具有更光滑的表面。
此外,LCTFEB电解质循环会产生大而笨重的锂颗粒(>1μm)。电极的冷冻透射电镜分析表明,SEI 的厚度也因电解质而异,不含添加剂的标准电解质和 LiBF4 的锂厚度为 30、40、20 和 10 nm、LCTFB 和 LCTFEB(图 5b,c)。用无添加剂电解质循环的负极上的厚SEI表明对锂离子扩散具有很高的抵抗力,导致锂纵向生长并产生用标准电解质和LiBF4观察到的针状枝晶结构电解质。由于锂离子通过薄SEI的扩散相对较快,因此锂颗粒的直径能够增长,导致在与LCTFB和LCTFEB电解质循环时形成更大的颗粒。形成的SEI的化学成分也因电解质而异,因此,在具有相似结构特征的合成添加剂上选择配体可以极大地影响SEI的形貌和组成,并导致锂金属负极性能的提高。
总结与展望
1. 协同盐和添加剂组合,实现多个SEI设计目标
SEI中的柔韧性和导电性都可改善锂金属负极性能,其形成的表面膜能够保持稳定并防止电解质连续分解。但是,大多数组分仅解决其中一个目标。如果可以选择双盐来提供一些增加的离子电导率而不会显着消耗锂离子载体,除了优先还原以形成聚合物SEI的添加剂之外,那么这两个方面都可以实现。因此,添加剂和盐应以不同的比例和品种以组合方式进行测试,以潜在地实现任何协同效应。
2. 金属锂预处理优先产生SEI
如果需要某些不一定溶于碳酸酯电解质的组分,则锂金属负极表面的预处理可以帮助将这些组分掺入SEI中而不会原位形成。例如,在组装电池之前表面的聚合物涂层与电解质中的高导电添加剂相结合,可以使锂金属继续电镀和剥离,同时防止形成死锂。
3. 改性电解质与高压正极的相容性
改性碳酸酯电解质(而不是另一种溶剂类型)的主要优点是碳酸酯在高压正极上的稳定性。因此,任何新型添加剂或独特的盐混合物都应在高电位下进行测试,以查看是否观察到任何对整个电池有害的降解。
4. SEI的结构控制
虽然较少讨论,但SEI和沉积锂颗粒的纳米结构和形态对于持续的锂金属电镀/剥离至关重要。此外,如果可以设计出促进纳米结构沉积和控制SEI生长的预锂化涂层或添加剂,则锂金属负极性能可能会有所改善。
5. 以工业规模测试电解液
这里讨论的大多数电解质研究都是在实验室中小规模(纽扣电池)完成的。在纽扣电池中,电解质量和锂源相对不受限制。然而,在考虑未来在工业和商业规模上的应用时,由于电池组的生产成本和能量密度,需要考虑电解液的数量和锂箔的厚度。因此,应在软包电池和棱柱形电池上进一步测试有希望的改性电解质,以确保所有降解产物在更大范围内都是安全的,并且不会造成额外的危害。此外,电解液应符合所有工业标准,包括最小电解液量和电极负载速率。
审核编辑:刘清
-
锂离子电池
+关注
关注
85文章
3242浏览量
77774 -
锂电池
+关注
关注
260文章
8127浏览量
170582 -
电解质
+关注
关注
6文章
815浏览量
20087 -
电解液
+关注
关注
10文章
849浏览量
23146
原文标题:罗德岛大学Brett L. Lucht教授最新ACS Energy Lett.:优化碳酸酯基电解液用于锂负极
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
调控磷酸酯基阻燃电解液离子-偶极相互作用实现钠离子软包电池安全稳定运行
水系电解液宽电压窗口设计助力超长寿命水系钠离子电池
贴片电解电容正负极判断方法
镍氢电池的电解液是什么
新宙邦拟在美国投建10万吨/年电解液项目
新宙邦美国路易斯安那州碳酸酯溶剂和锂离子电池电解液项目启动
用于延长高压高Ni三元锂金属电池寿命的无氟醚基电解液





 优化碳酸酯基电解液用于锂负极
优化碳酸酯基电解液用于锂负极














评论