微流控技术是一种通过微小的通道和微型装置对流体进行精确操控和分析的技术。它是现代医学技术发展过程中的一种重要的生物医学工程技术,具有广泛的应用前景和重要性。它在高通量分析、个性化医疗、细胞筛选等方面有着巨大的潜力,Aigtek安泰电子今天就将为大家分享一篇微流控领域研究成果,一起接着往下看吧~
医学界发现肿瘤细胞会通过内渗的方式进入血管,随着血液的流动扩散到身体的各个部位。与此同时,科学家们也普遍意识到,较高的剪切力会对细胞造成致命的损伤,而相对低的剪切应力则有利于细胞在循环中存活。因此,细胞在通过内渗进入血管时,会选择流体剪切应力较低的路径。然而这些细胞到底是如何感应剪切应力并做出判断,以及如何实现择路而行这一举措,依然是一个未解的问题。
近期,The Johns Hopkins University的Konstantinos Konstantopoulos教授团队在Science Advances发表题为The fluid shear stress sensor TRPM7 regulates tumor cell intravasation的文章。该团队通过微流控芯片模拟了细胞内渗迁移的过程,并基于正常(非癌)或肿瘤细胞在从迁移到内渗过程中感知和响应剪切应力的能力提供了一种分子层面的解释:(TRPM7)是关键的流体剪切传感器。TRPM7 活性越高, 细胞对剪切力越敏感,迁移能力越弱。同时阐明了TRPM7感应下游的信号通路。
首先,该团队设计了一款拥有三维狭长通道的微流控芯片(图1A)。肿瘤细胞在人体内扩散时需要穿过的细胞外基质内的狭小通道,这些通道的宽度由3微米至30微米不等,长度有的可达600微米。而这款芯片有两条较宽的近似2维并互相平行的扁平流道(W=400um;H=30um),其间又由一排垂直于这两条流道并互相平行的微流道(W=10,20,or50um;H=10um;L=200um)连通。该芯片上的微流道可用来模拟细胞扩散的途径,再通过调整两侧二维流道内液体流速,就能提供静止或剪切力环境。
该团队于是比较了在不同尺寸的通道内,不同细胞(原代人皮肤成纤维细胞,人类新生包皮成纤维细胞以及中国仓鼠卵巢细胞)在剪切力作用下的表现。结果显示,不同细胞在不同宽度的流道内,都出现了明显的遇到剪切力(爬出微流道,接触到存在剪切力的二微流道)时回缩的现象(图1.B-E)。理论上,钙(Ca2+)信号有助于持续的细胞迁移,趋化,和对物理线索的反应。为了验证它与这里细胞遇剪切力回缩的现象有关,团队在成纤维细胞上加载了钙离子指示剂染料,并由此观察到钙离子流动量在遇到剪切力时急剧提升(图1F)。最终,得出结论:成纤维细胞在其前缘感知到剪切流时,导致钙内流,细胞逆转迁移方向。
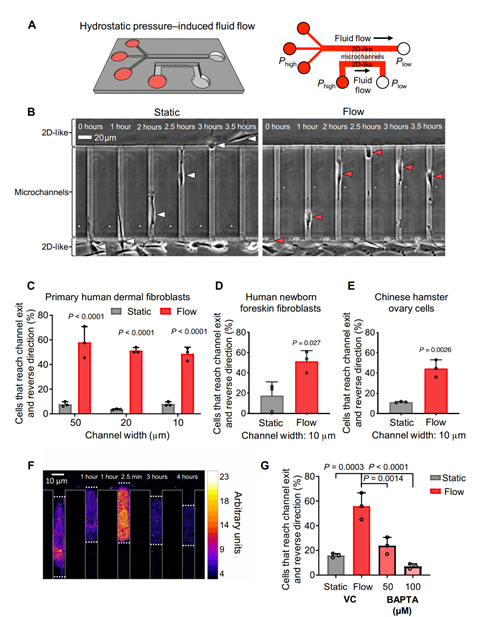
图1成纤维细胞在其前缘感应流体剪切时,细胞外钙离子会快速内流,从而使其发生反向迁移
为了验证细剪切力确实会促进钙离子内流,该团队增加了观测通量,在更大范围内观察细胞在剪切力下的钙离子流动状况(图2.AB),再次验证了当细胞从静止环境切换到剪切力环境(0.5dyne/cm^2)时,钙离子内流量会大幅跃升。钙离子的内流是由力敏离子通道控制的,但是力敏离子通道也有很多种,到底哪一个是真正与收到剪切力刺激后钙离子内流相关的呢?通过用抑制剂分别堵住不同的钙离子通道并运用排除法筛选,团队最终确认TRPM7这个TRP通道才是最关键的流体剪切传感器,是它介导了成纤维细胞迁移方向的逆转
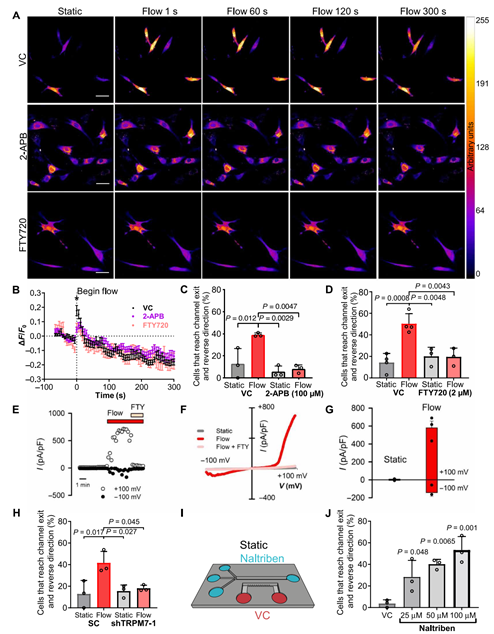
图2TRPM7是关键的流体剪切传感器,它介导了成纤维细胞迁移方向的逆转
找到了感应器,解释了细胞是如何感受到剪切力,那又是什么使得细胞向着相反的方向移动的呢?该团队先是从形态上观察到在微流道内迁移的细胞90%呈间质细胞形态(有突触)(图3AB),这显示了肌动蛋白聚合驱动(actinpolymerization–driven)的迁移机制,而回转的时候50%的细胞从伸展状态转变成囊泡状(图3AB),则体现了的肌动蛋白的聚集。最终,团队总结认为,剪切力增加了细胞肌动球蛋白(Myosin-II)的收缩力,使细胞能反向移动。
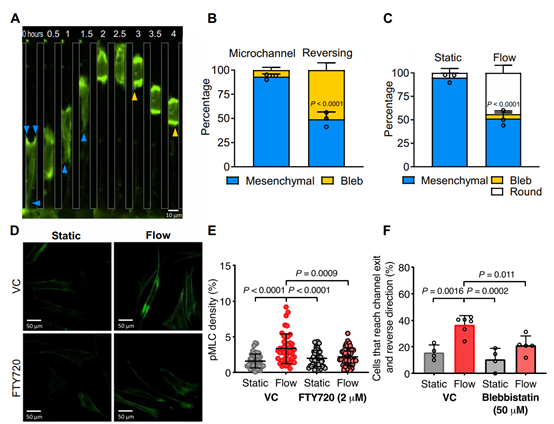
图3流体剪切应力会激活肌球蛋白-ii的收缩能力,这是逆转成纤维细胞迁移方向所必需的
联想到RhoA是一种被深入研究过并被广泛认可,能被多种物理因素激活从而影响细胞收缩/移动的蛋白质,该团队使用荧光寿命共聚焦显微镜(FLIM)证实了成纤维细胞迁移方向的逆转是由RhoA/myosin-II和IQGAP1-Cdc42协同介导实现的(图4)。
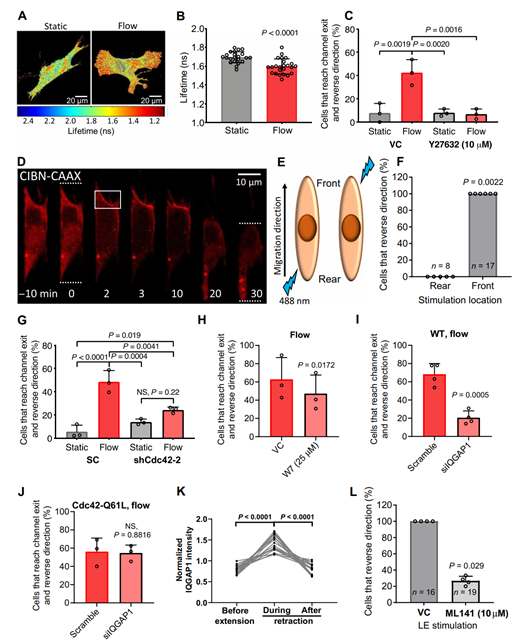
图4蛋白RhoA和极性蛋白Cdc42协同作用,介导迁移方向的逆转
找到了细胞感受剪切力刺激的感受器,也明白了细胞反向运动的机制,那么这些发现是否能被用来抑制癌细胞的转移、内渗呢?该团队检测了HT-1080纤维肉瘤细胞,观察到该肿瘤细胞在5dyn/cm^2处表现出来的反向运动程度仅与成纤维细胞在0.5dyn/cm^2的剪切力下的状态一致(图5A.B.)。再进一步检测,发现HT-1080纤维肉瘤细胞的各个Ca2+通道的表达几乎都远不及成纤维细胞(图5C.)。同时HT-1080纤维肉瘤细胞的RhoA分泌也可被剪切力激活,但总量远小于成纤维细胞(图5H.)。由此可见,HT-1080纤维肉瘤细胞对剪切力的灵敏度远低于成纤维细胞,因此才不受剪切力影响,更容易发生内渗并四处扩散。
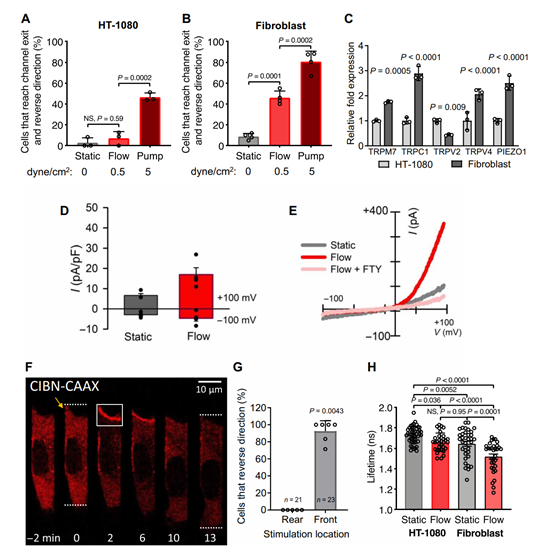
图5HT-1080纤维肉瘤细胞出现TRPM7活性、流体剪切敏感性和RhoA活性降低的现象
找到了纤维肉瘤细胞易内渗/转移的原因,该团队便尝试反向操作来解决这个问题。他们刺激纤维肉瘤细胞超量表达TRPM7,再施加剪切力进行检测。结果果然显示,纤维肉瘤细胞对剪切力的敏感程度大幅提升,并且宏观来看,它原发肿瘤的浸润(向外扩张)和内渗(穿透血管壁)现象也明显减少(图6,图7)。
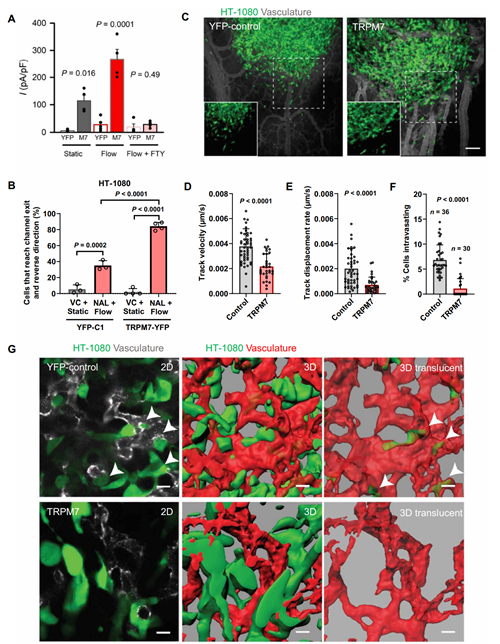
图6HT-1080纤维肉瘤细胞在过表达TRPM7后获得了极强的剪切敏感性,同时显示出大幅减弱的扩散出原发肿瘤并发生内渗的能力
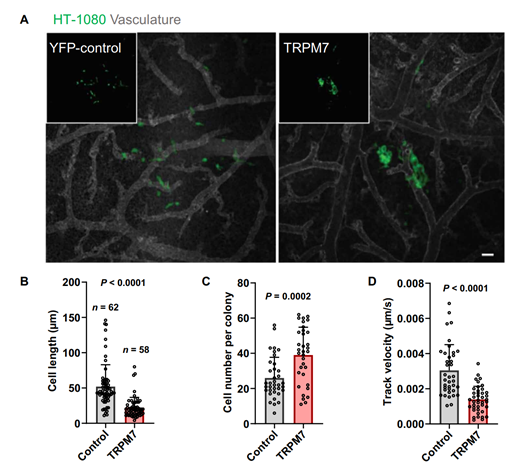
图7TRPM7在HT-1080纤维肉瘤细胞中的过表达抑制侵袭性转移灶的形成
这一研究充分表明,力敏离子通道是细胞探测其物理微环境的重要途经,能赋予细胞在非受限或受限环境下迁移、入侵和增殖的能力。了解了正常的成纤维细胞如何使用TRPM7力敏离子通道来检测和避免进入血流,以及癌细胞如何降低TRPM7活性、抑制其下游信号转导来降低自身对剪切力的敏感程度,人类对于癌症的治疗或许又能有新的认识。

-
传感器
+关注
关注
2548文章
50678浏览量
751995 -
高压放大器
+关注
关注
4文章
472浏览量
14348 -
微流控
+关注
关注
16文章
511浏览量
18863
发布评论请先 登录
相关推荐
ATA-2021B高压放大器在光纤电场传感器中的应用
安泰ATA-2042高压放大器在快速旋转软体驱动器研究中的应用

ATA-2042高压放大器
ATA-7010高压放大器在纳米薄膜制备中的作用有哪些




 ATA-2042高压放大器在细胞的剪切应力传感器研究中的应用
ATA-2042高压放大器在细胞的剪切应力传感器研究中的应用















评论