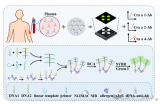
本文基于离心芯片采用由表面张力辅助的不混溶性结构实现全血中 cfDNA 的提取。整个操作过程小于 15 min,从血浆中回收的cfDNA为 65%,从全血中回收的为 30%。
液体活检简述见揭开液体活检技术的神秘面纱(附视频)
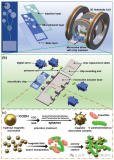
如图 1 所示,直径 100 mm 芯片由两部分组成:一部分用于血浆分离和转移,另一部分用于核酸分离。 其中,血浆分离是基于离心法实现的;一个漏斗状的腔室被用于血浆提取,该腔可容纳 4 mL 全血。在虹吸通道中设计有空气阀,避免在采样过程中血液在毛细管作用下进入样品腔。
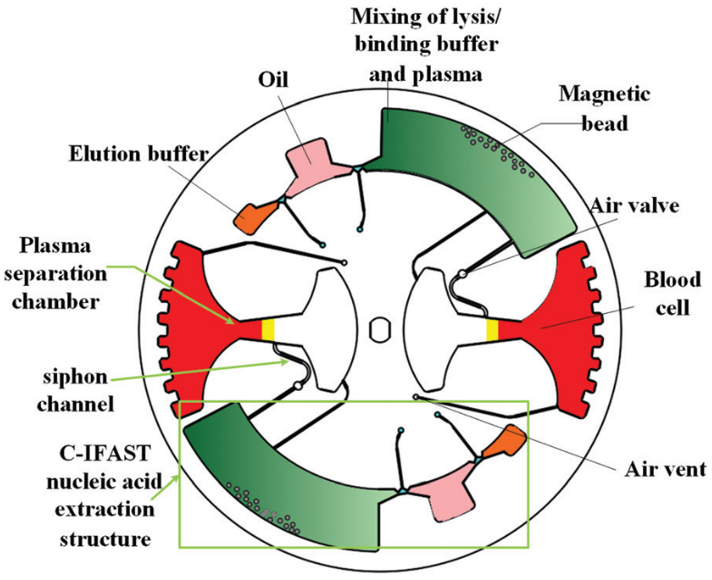
图 1
cfDNA 的提取和纯化如图 2 所示;腔室间通过拱状毛细管微通道相互连接,其中微通道高度为 200 μm,宽度从 400 μm 到 3 mm 不等。该结构的关键是确保整个过程中所有相的不混溶性,并确保在磁珠转移过程中形成稳定的界面。
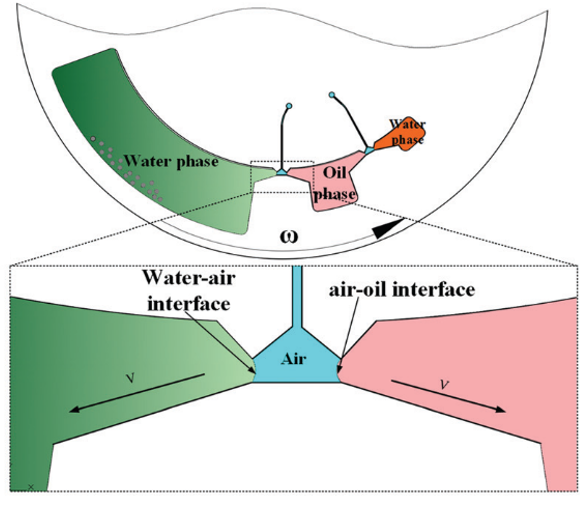
图 2
鉴于此,本文设计了一个用于不混溶相中磁珠转移的拱状通道(图 2 放大图)。根据表面张力在微尺度上的主导作用,一个虚拟的 水-空气“墙”和 空气-油“墙” 形成,以避免在芯片静止期间 (样品加载和磁珠转移时)水和油的混合。
其它类似结构见迷你样品进结果出核酸检测仪(附视频)
为了提高旋转过程中不混溶相界面的强度,对空气微腔表面进行聚四氟乙烯处理 (Teflon treatment),降低表面能,增加空气介质表面与水/油界面的张力。
在芯片启动加速过程中,微通道中形成了不混溶相的界面。如果角加速度过大,则当不混溶相界面两侧的压差超过表面张力,不混溶相界面将被破坏。
芯片实物图如图 3 所示。

图 3
磁珠在外磁场作用下连续通过几个不混溶界面。在磁珠转移过程中,磁珠在外部磁力的作用下凝聚成团。如果磁力克服界面张力,磁珠就能穿过界面。
芯片中各个腔室尺寸如图 4 所示。

图 4
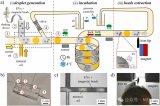
图 5 所示为芯片制作流程;首先由 CNC 加工模具,然后将 PDMS 涂在模具上,随后剥离粘接在玻璃片上。
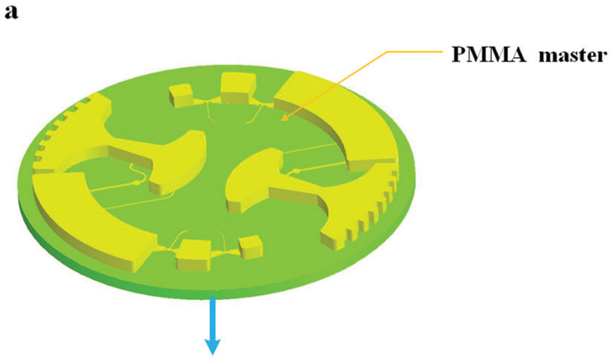
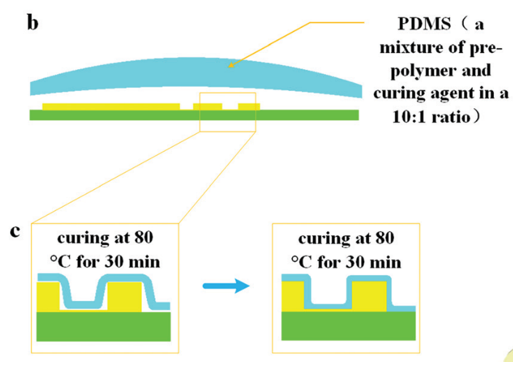
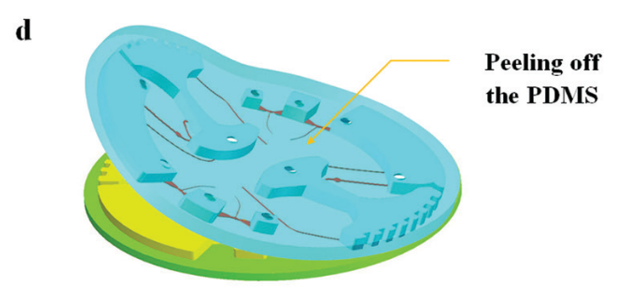
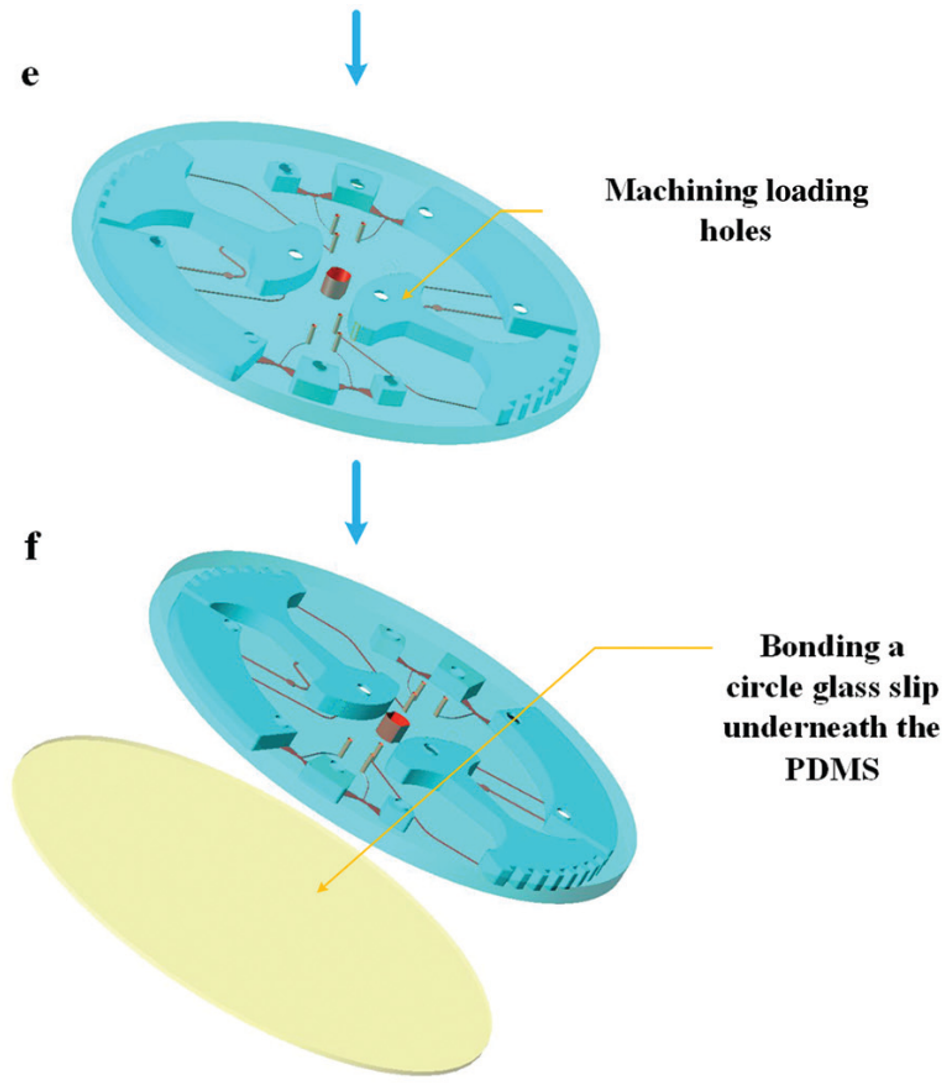
图5
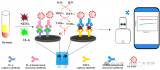
样品加载过程如下:首先,将 4 ml 全血 (掺有 HBV 片段短 DNA) 加载到血浆分离腔中;然后将 15 μl二氧化硅包被的磁珠,1.25 ml裂解/结合缓冲液,50 μl 的洗脱液注入对应的腔室。最后将硅油注入400 μl不混溶相腔。
本文采用硅油替代 FC-40 等氟化油是由于氟化油会导致气腔表面处理的聚四氟乙烯溶解。
对于血浆分离,芯片首先被缓慢加速到一个特定的速度 (120 rpm),以保持稳定的不混相界面。然后将芯片加速到 3600 rpm,持续 4 min。在细胞沉降后,芯片在减速期间激活虹吸阀。随后,分离的1.6 ml血浆样本被离心到血浆收集腔,用于后续 cfDNA 提取。
提取到血浆后,芯片开始进行核酸提取。采用加减速将磁珠、血浆,和裂解/结合缓冲液混合,以高效地将 cfDNA 结合到磁珠表面。
随后移动外部磁铁,将磁珠穿过不混溶相进入洗脱缓冲液中。此时,纯化的 cfDNA 就被带入洗脱腔。再次采用加减速混合将核酸从磁珠表面洗脱。最后收集洗脱腔上清液用于下游检测。如采用 定量 PCR 或数字 PCR。
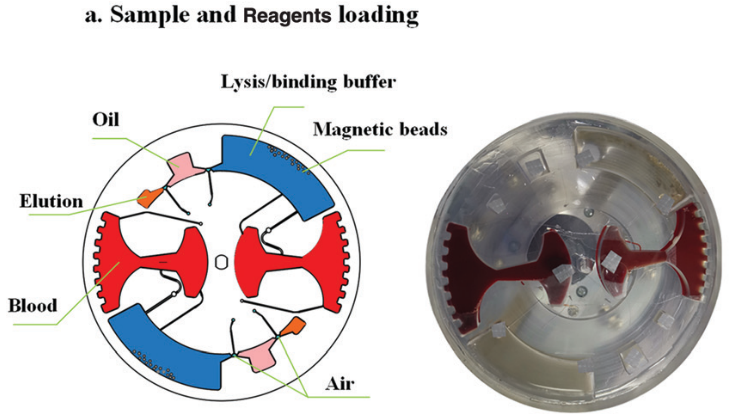
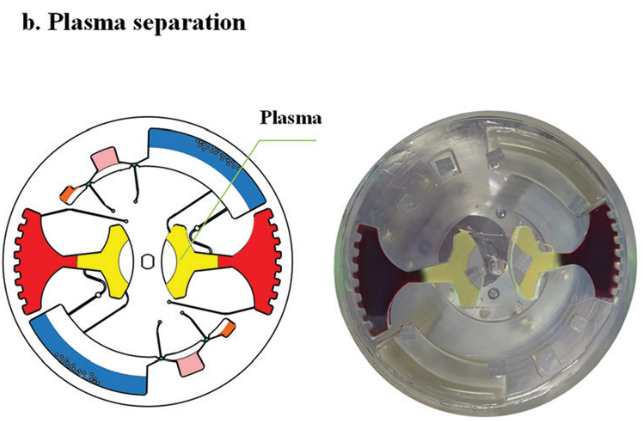
图 6
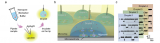
芯片首先以较低的角速度 (10 rpm/s) 启动,以保护不混溶相界面不发生混溶。当角速度增加到一个特定的值(120 rpm)时,不混溶相液体离开微通道进入腔室。然后,在 500 rpm/s 的加速度下升至 3600 rpm ,持续 4 min 实现血浆分离 (图 6)。
在血浆分离腔的底部,设计了指状结构有助于分散芯片旋转期间产生的离心压力。
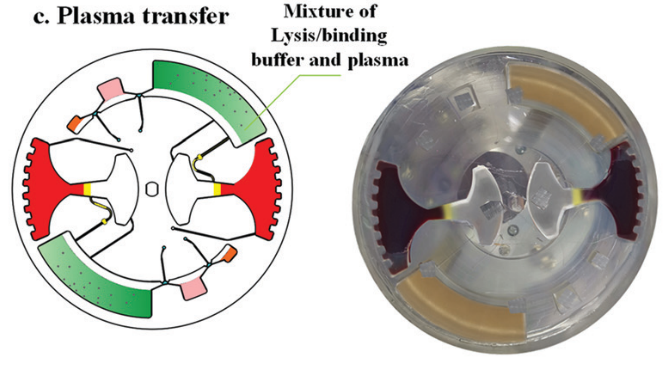
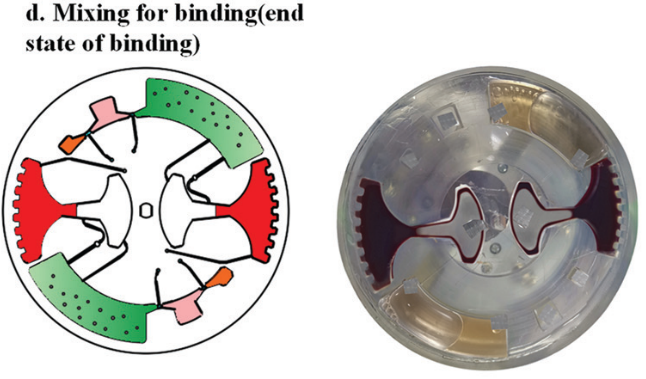
图 7
血浆分离后,芯片以 50 rpm/s 的减速度减至 350 rpm 激活虹吸阀,然后,以 20 rpm/s 的加速度至600 rpm转移 1.6 ml血浆到 cfDNA 提取腔(图 7)。
随后,进行 cfDNA 提取。芯片首先在120 - 840 rpm 之间进行加减速混合,持续 150 s 实现 磁珠、血浆,和裂解/结合缓冲液混合。之后手持磁铁以∼5mm/s 的速度手动移动,将腔室内磁珠穿过不混溶的屏障进入洗脱腔。
然后,再次在120 - 840 rpm 之间进行加减速混合,以充分洗脱核酸。
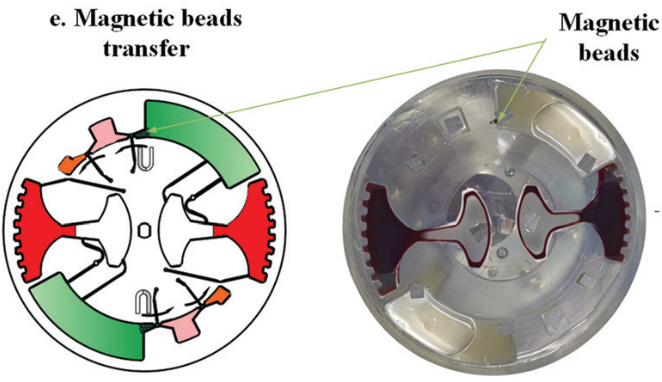
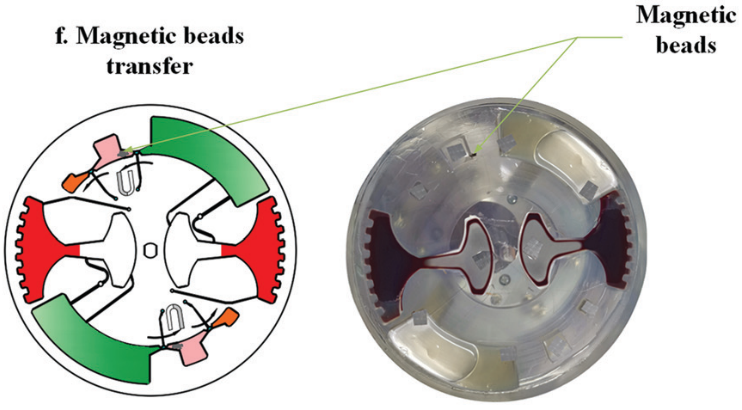
图 8
在血浆提取时,离心速度不能太快;如果速度太快,血细胞可能会破裂,导致内部物质释放出来,即所谓的 溶血。
在血浆分离过程中是否发生溶血现象,不仅取决于离心速度,还取决于离心时间。因此,合理的离心速度和时间是极其重要的。
低离心速度和短离心时间可能导致分离不充分,而高离心速度和长离心时间可能引起溶血现象。
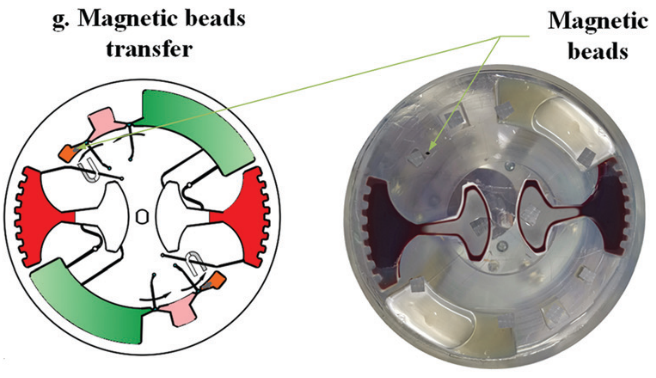
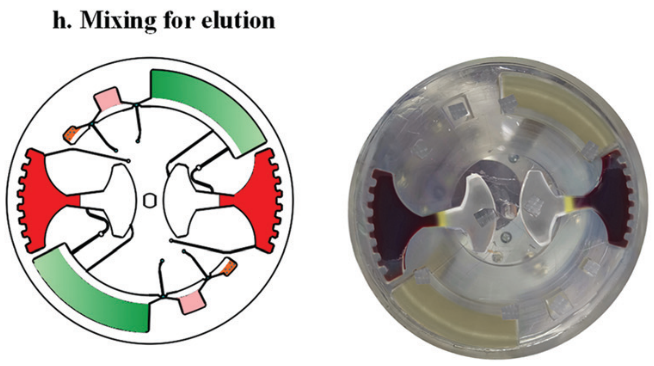
图9
附录
什么是溶血?
溶血是指红血细胞(也称为红细胞或血球)在一定条件下破裂和释放其内部的血红蛋白和其他细胞成分的过程。这通常发生在红细胞受到物理、化学或生物学上的压力或损伤时。溶血可以在体内或体外发生,具体取决于引发溶血的原因。
在体内,溶血可能由各种原因引起,如遗传性贫血症、自身免疫性疾病、药物反应、感染等。在体外,溶血通常涉及实验室操作或临床检测,如血液分离、储存和输送过程中的意外损伤。
溶血会导致血红蛋白释放到血浆中,这可能对机体产生负面影响,因为血红蛋白可以引起肾脏损害和其他并发症。在临床和实验室环境中,控制溶血是非常重要的,以确保血液样本和制备的产物的质量和完整性。
判断是否发生溶血通常涉及对血液样本或液体中的特定指标进行分析和观察。以下是几种常见的方法来判断是否发生了溶血现象:
颜色变化:溶血通常会导致液体从红色变成粉红色或透明,这是因为释放出的血红蛋白会影响液体的颜色。
吸光度测量:在实验室环境中,可以使用分光光度计来测量液体的吸光度。溶血会导致液体中血红蛋白的浓度增加,从而使吸光度值升高。
红细胞计数和形态观察:可以使用显微镜观察血液样本中的红细胞数量和形态。溶血可能导致红细胞数量减少,同时红细胞的形态也可能发生改变。
血红蛋白测量:使用血红蛋白测量方法,如比色法或电化学法,可以测定液体中的血红蛋白浓度。溶血会导致血红蛋白浓度升高。
血浆游离血红蛋白测定:溶血会释放血浆中的游离血红蛋白。通过测量游离血红蛋白的浓度,可以判断是否发生了溶血。
细胞膜标记物测定:可以通过测量红细胞膜上的特定标记物的浓度,如LDH(乳酸脱氢酶)和钾离子,来判断红细胞是否受损和是否发生了溶血。
审核编辑:刘清
-
磁珠
+关注
关注
6文章
270浏览量
44355 -
微流控芯片
+关注
关注
13文章
284浏览量
18983 -
PCR
+关注
关注
0文章
120浏览量
19721
原文标题:一种用于液体活检生物标志物(ctDNA)检测的微流控芯片
文章出处:【微信号:MEMS拓荒者,微信公众号:MEMS拓荒者】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
微流控技术在病原微生物检测中的研究进展
高通量生物分析技术之微流控芯片
基于一种AI辅助可穿戴微流控比色传感器系统
诺基亚宣布 23 亿美元收购美国光通信设备制造商英飞朗,索尼半导体发布工业用8K宽幅全局快门图像传感器




 一种用于液体活检生物标志物(ctDNA)检测的微流控芯片
一种用于液体活检生物标志物(ctDNA)检测的微流控芯片











评论