荧光的共定位是当今生物显微成像中一个极为常见的技术,两个或者更多种不同颜色的荧光探针被用来标记不同的结构/位点,使得其相互关系得以明晰地在合并的图像上展现。随着研究者对于实验的要求越来越高,这些荧光共定位的成像逐渐被希望能用于荧光强度高速变化或者样品本身位置不断变化的实验中,比如活动的斑马鱼、线虫体内两类神经细胞的荧光共定位成像。在这些实验中,由于样品本身是运动的,两个颜色的成像时间间隔越短,越能够反映荧光探针共定位的真实情况。
在另外一些实验中,同一个荧光探针的荧光颜色(波长)会随着环境的变化而发生变化,那么前后两种颜色荧光强度的比值就能反映出环境的变化,如Di4之于细胞膜电位,Cameleon之于Ca离子浓度等等。当相关的环境变化速度比较快的时候,两个颜色的成像时间间隔越短,测量也就越精确。
综合以上两类成像实验,均是需要尽可能地将两个不同颜色荧光信号在同一时刻拍摄下来,那么最理想的情况就是我们在这篇Application notes中所提到的双色同步成像,即完全同时地拍摄两个颜色通道的荧光信号。
双色同步成像——采用W-View GEMINI的完全同步成像
双色同步成像最直接的思路就是用彩色相机,但如今绝大多数的彩色相机是在黑白芯片的基础上将每个像素前添加滤光涂层(一般为红、绿、蓝三种,如下图),此彩色滤光涂层使得不同的像素可以分别得到不同的颜色信息,最后合成出彩色的图片。这样的设计在明场成像(如HE染色,免疫组化切片)中不可或缺,但对于生物荧光信号的成像却是有缺陷的。首先,滤光涂层的出现会吸收或反射部分入射光信号,降低整个芯片的灵敏度,在信号本来就较弱的荧光拍摄中会影响到成像信噪比;其次,由于不同像素前存在不同颜色的滤光涂层,对于单色光信号——比如荧光信号——的实际分辨率将被降低。换句话说,对于一台140万像素的彩色CCD相机,其真正能够检测到绿色荧光信号的像素仅有约70万个像素,其余的70万像素的绿光强度信息均为计算获得(注:因为绿色为人眼最为敏感的颜色,所以一般彩色相机中以4个像素为一组,两个像素采用绿色涂层,其余两个像素则分别采用蓝色及红色涂层)。更重要的,如果采用这类彩色相机用于双色荧光同步成像,一些颜色并不是红绿蓝三种颜色(对应彩色相机像素上的三种滤光涂层)的荧光探针将受到极大的限制。
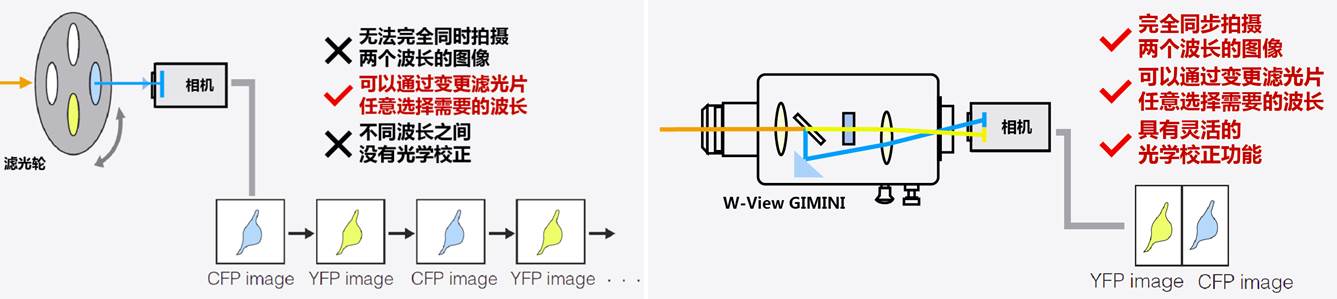
所以传统上,许多实验室通过切换显微镜上的滤光块转盘或者是采用滤光轮进行不同颜色之间的切换。但这样无法做到完全同步拍摄两个颜色的图片,滤光块转盘的切换时间需要约1秒钟,而滤光轮不同滤光片之间的每一次切换也需要几十毫秒时间,事实上影响了实验的时间分辨率,所以在比较高速的比例成像等场合,采用滤光轮或者滤光块转盘都容易造成数据的误差。
而采用滨松W-View GEMINI则完全没有这样的担心,两个颜色的信号被成像到相机的上下两半感光芯片上,实现了两个颜色成像的完全同步。
双色同步成像——一台Flash 4.0 LT相机作两台用
采用W-View GEMINI这样的双色分光附件将两种颜色的信号成像到一台相机的一个感光芯片上很好地解决了同步成像的时间问题,但对于绝大多数的相机,整个感光芯片只能设置一个曝光时间,当两个颜色的信号强度相差较大时将很难同时将两个颜色的成像信噪比保证在最佳状态。
而滨松Flash 4.0 LT则可以分别调整同一芯片上下两半的曝光时间。所以在采用W-View GEMINI配合Flash 4.0 LT的时候,我们可以非常灵活地调整两个颜色信号的相对亮度,得到更加能够突出所需信号和结构的图片。在两个颜色通道的信号差别非常大的时候,Flash 4.0 LT + W-View GEMINI这种灵活的曝光时间设置就可以针对不同的波长设置不同的曝光时间,同时保证两个波长信号的信噪比。

审核编辑 黄宇
-
FlaSh
+关注
关注
10文章
1638浏览量
148182 -
成像
+关注
关注
2文章
241浏览量
30506
发布评论请先 登录
相关推荐
用ADS1191设计一台心电仪遇到的几个疑问求解
实例 如何利用无线通讯终端来实现两台汇川PLC的同步控制?
探秘热成像双光谱云台驱动技术方案
提升工作效率,从共用一台屏幕开始
两台IR615和华为USG6335E建立IPsecVPN的过程
两台电脑怎么传文件?干货分享教程
如何用ESPRFTESTTOOL实现两台esp32之间的蓝牙灵敏度测试?
如何实现两台伺服电机比例同步运行
手持式激光焊机一台多少钱?

驱动系统单电机与双电机的区别




 双色同步成像——一台Flash 4.0 LT相机作两台用
双色同步成像——一台Flash 4.0 LT相机作两台用










评论