免疫疗法是临床上最具有前景的肿瘤治疗方式之一。该疗法采用PD-L1抑制剂等免疫检查点抑制剂(ICI),重新激活癌症患者体的免疫细胞,提高对肿瘤细胞的识别和清除能力。但在临床中,仅有部分患者能从免疫治疗中获益。大量研究表明,使用单一生物标记物,如PD-L1表达,并无法准确预测患者对ICI的反馈。临床常规组织活检方式,受限于取样位置和动态分析,无法提供足够精细的时空信息,也无法准确评估肿瘤的异质性,导致对肿瘤发生和免疫治疗过程中的细胞反应知之甚少。如何精准预测免疫治疗的疗效,成为了提高免疫治疗效率亟待解决的首要问题。

据麦姆斯咨询报道,针对该临床问题,北京航空航天大学常凌乾教授团队,与北京大学肿瘤医院吴楠教授、格拉斯哥大学Jonathan M. Cooper教授、北京机械设备研究所杨明珠研究员等合作,报道了一种循环肿瘤细胞(CTCs)捕获、原位培养和基因分析芯片系统,命名为“NICHE”。NICHE系统从PD-L1基因表达、肿瘤细胞响应免疫细胞的行为表型,对患者来源的循环肿瘤细胞进行划分,实现了肺癌患者对免疫疗法的精准预测,临床准确率(AUC值)达到90%以上。成果以“Genetic and phenotypic profiling of single living circulating tumor cells from patients with microfluidics”为题,发表在《PNAS》期刊上。该论文第一作者为北航医学科学与工程学院董再再(助理教授)、北航生物与医学工程学院汪于森硕士、北京大学肿瘤医院刘冰博士、上海市感染和免疫疾病科技创新中心徐高连教授。
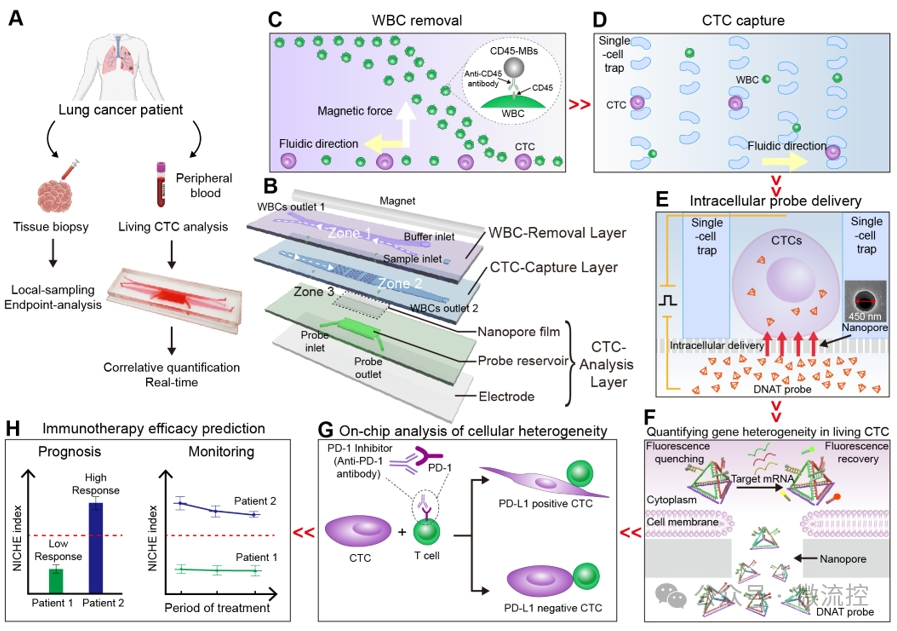
图1. 循环肿瘤细胞(CTCs)捕获、原位培养和基因分析芯片系统NICHE,用于肺癌免疫治疗的精准预测与监测。
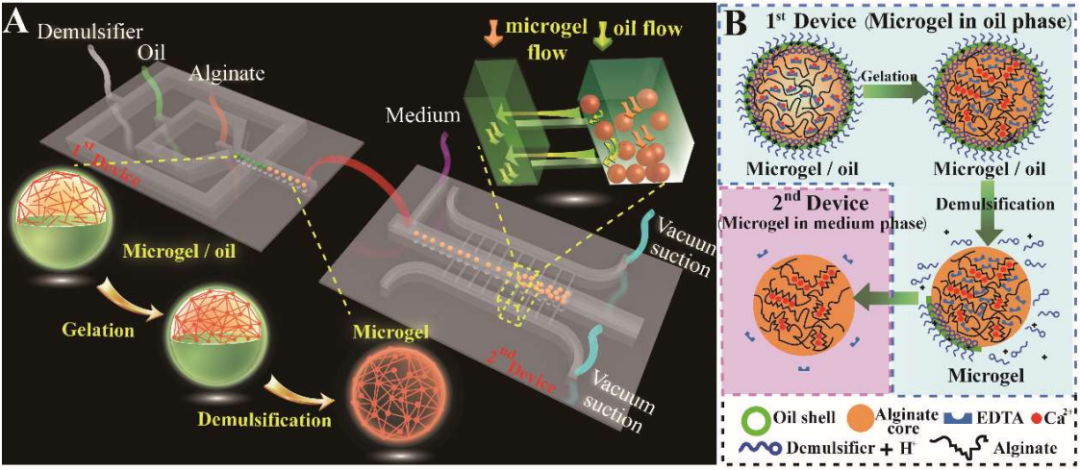
该纳米细胞芯片采用磁场和细胞尺寸,高效去除(> 93%)血样中的白细胞,并捕获循环肿瘤细胞使其形成单细胞阵列(>95%)。为了实现活循环肿瘤细胞内PD-L1基因的准确检测,研究者们设计了一种具有四面体结构的探针(DNAT),该探针的三条边上的识别序列分别用于识别3种不同的mRNA,通过不同的荧光标记,实现了PD-L1基因、内参GAPDH基因,以及循环肿瘤细胞鉴定基因的同时检测。DNAT探针具有良好的特异性,且能长时间抵抗核酸酶的降解。利用纳米电穿孔技术,该探针能在2秒内实现对95%以上细胞的递送,且细胞保持良好的活性(90%),与其他常规方法相比,纳米电穿孔技术展示出更高的递送性能(图2)。
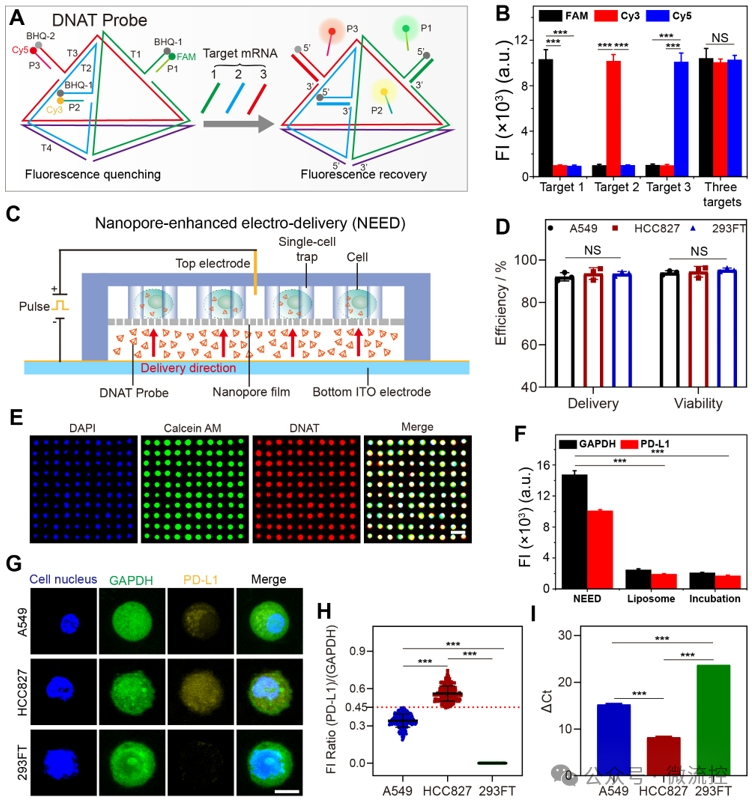
图2. 在单个活细胞水平循环肿瘤细胞内PD-L1 mRNA的精准量化。
基因检测始终,循环肿瘤细胞保持良好的活性。通过与免疫T细胞的共培养,研究者们发现,部分肿瘤细胞在免疫抑制剂存在时,细胞形态发生了明显的变长,且细胞增殖行为被显著抑制(图3)。根据肿瘤细胞PD-L1的表达情况,研究者们划分出了PD-L1高表达与低表达的阈值;另外,根据肿瘤细胞与免疫细胞共培养的结果,研究者们划分出了肿瘤细胞形态发生变化的阈值。综合循环肿瘤细胞中PD-L1高表达(PD-L1high)且表型发生变化(PA+)的占比,该研究定义了一种新的指标,“NICHE指数”,用于预测癌症患者响应免疫疗法的疗效。
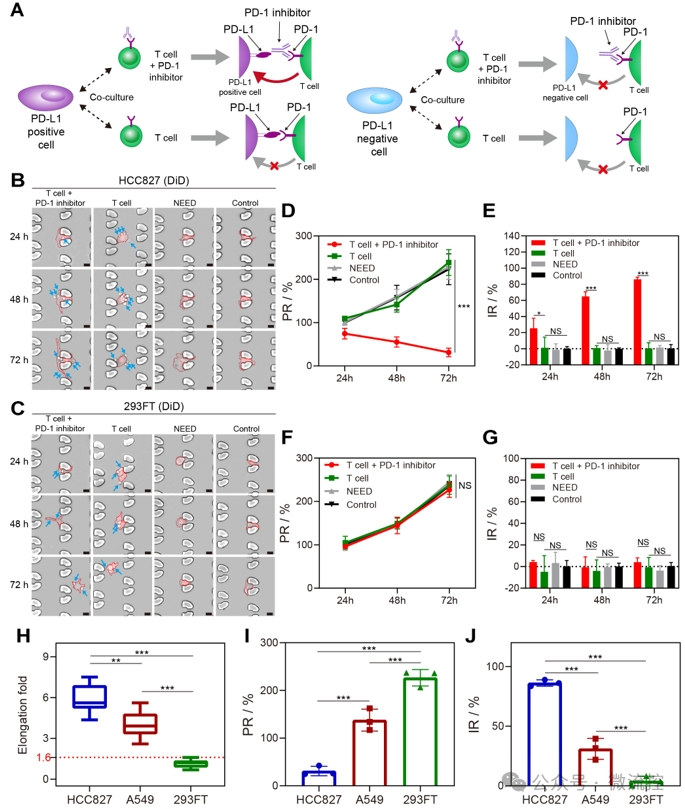
图3. 循环肿瘤细胞与免疫细胞共培养下发生形态改变。
为了评估NICHE在临床上预测免疫疗效的性能,该研究收集了80名非小细胞肺癌患者的外周血,通过在NICHE平台上的检测,证明了该平台捕获循环肿瘤细胞 并鉴定其基因和行为表型的能力(图4)。从方法对比结果来看,该研究提出的NICHE指数表现出高准确性,其AUC(0.906)明显高于目前临床上基于肿瘤组织中PD-L1表达细胞占比的标准参考方法(AUC=0.578)。此外,研究者们还对部分患者进行了长时间的用药监测,证实了NICHE在长期监测中的适用性。
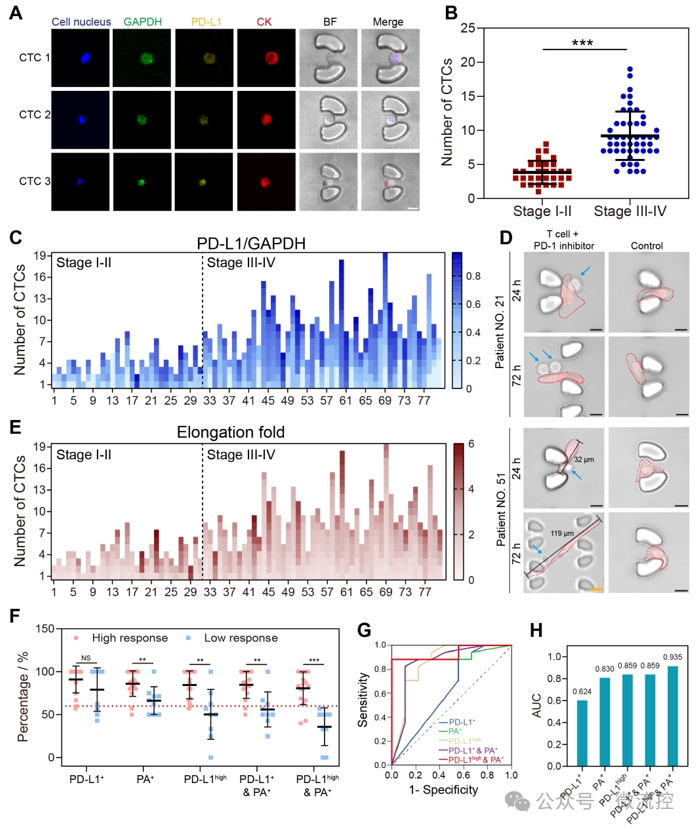
图4. 采用NICHE系统对肺癌血样中的循环肿瘤细胞进行捕获与分析,并实现了患者免疫治疗的精准预测。
文章链接:
https://www.pnas.org/doi/10.1073/pnas.2315168121
-
纳米技术
+关注
关注
2文章
201浏览量
26093 -
微流控芯片
+关注
关注
13文章
284浏览量
18983
原文标题:基于微流控的纳米细胞芯片,用于肺癌免疫治疗的精准预测
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
微流控芯片在细胞培养检测中的应用
玻璃微流控芯片的特点
常用的微流控芯片类型
使用原代肿瘤细胞进行药物筛选的数字微流控系统
ATA-7020高压放大器在微流控3D细胞微球培养中的应用
PDMS微流控芯片和PMMA微流控芯片的区别
ATA-320功率放大器在免疫磁珠法分离细胞实验中的应用




 基于微流控的纳米细胞芯片,用于肺癌免疫治疗的精准预测
基于微流控的纳米细胞芯片,用于肺癌免疫治疗的精准预测











评论