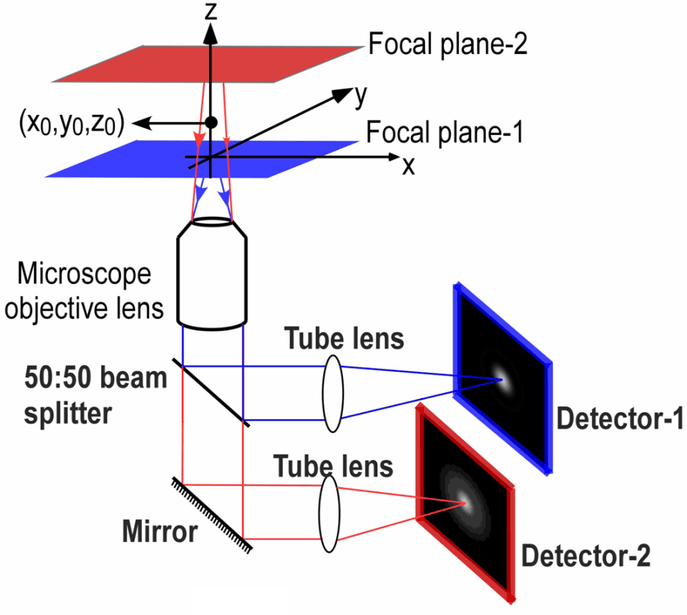
图 1:使用分光器的多焦点平面显微镜。样本中的两个不同焦平面(一红一蓝)由50:50分光器分割。反射光(蓝色)被发送到相机1,而透射光(红色)被发送到相机2。通过这种方式,可以同时对两个不同的焦平面进行成像。或者,可以使用发射图像分离器通过一个检测器对两个焦平面进行成像。
介绍
分光器是一种将光(例如激光束)分成两束(或多束)的光学装置。分光器在显微镜中非常有用,因为它们可以充当显微镜和探测器/相机之间的接口,分离显微镜的发射光。
分光器有两种主要类型:发射图像分光器将光分到单个相机传感器上,以便一台相机可以同时对多个波长进行成像;多相机适配器将光分到多个相机上,从而允许一个样品同时成像多个相机。这两种分光器装置本质上都允许在多个波长、偏振状态或振幅下同时对样品进行成像。有关分离器的介绍,请参阅我们的技术说明:“分离器简介”。
本文将介绍如何使用此类分光器设备来增强显微镜技术和高级成像应用。为什么要使用分离器?
需要分离器的技术
分光器允许同时对不同状态进行成像:无需手动或使用电子开关调整显微镜设置,而是可以无延迟地光学获取两种状态。多焦平面显微镜 (MPM)是这对于成像应用有用的一个示例,如图 1所示。 MPM 涉及同时对同一样本的两个不同焦平面进行成像,而不是手动调整焦点,然后在不同的所需焦平面处拍摄图像。
如果对 2D 细胞培养物进行成像,一个焦平面通常就足够了,因为大多数细胞制剂都不是很厚。但随着越来越多的研究人员开始对更大的 3D 样本进行成像,MPM 提供了一种有用的方法,可以在细胞在 3D 支架中相互作用或较大的生物体进行动态运动时对多个所需焦平面进行成像。对实时 3D 样品进行成像时,高速是必要的,并且由于无需手动调整焦点,MPM 提供了一种高速选项,可同时对穿过样品的多个 z 平面进行成像。 MPM 的实际应用示例如图 2所示。
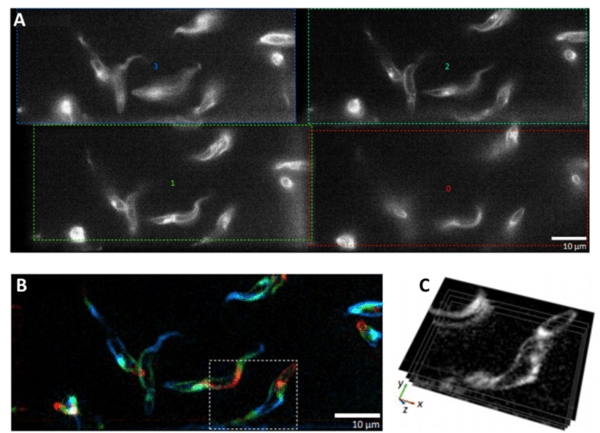
图 2:高速 MPM 可视化活体游泳的布氏锥虫寄生虫。该实验使用了四路发射图像分离器 MultiSplit V2。A) 同一样本的四个独立图像通道,每个图像通道在不同的焦平面处拍摄。 B) 对四个独立的焦平面进行着色、组合和过滤。每种颜色都来自不同的焦平面。 C) 四个焦平面相互关系的直接可视化。图片改编自惠勒 (2019)。
如果没有分光器,等待样品移动到正确位置时可能会浪费时间,例如选择性平面照明显微镜 (SPIM) 等光片技术中的扫描。扫描还会因相机快门而产生拖尾效应,并限制可用的曝光时间。通过同时捕捉多个兴趣点,可以避免这些限制,从而可以捕捉 3D 空间中微小、微弱和快速移动的物体。如果没有分光器,MPM 就不可能实现,并且展示了操纵样品发射光的强大功能和灵活性。
另一种需要分光器的技术是同时 多探针荧光成像,涉及不同荧光探针的同时成像。绝大多数荧光显微镜使用多个荧光团,特别是在蓝色通道通常被 DAPI(一种易于使用的细胞核标记物)占据的细胞上,为标记特定蛋白质的其他荧光团留下红色和绿色通道。
显微镜通常有一个电子开关,以便这些不同的荧光团可以在不同的通道中成像,从而产生多通道图像。切换时仍然存在时间延迟,并且使用分光器可以选择同时对多个荧光波长进行成像,从而消除任何延迟。这在对活细胞进行荧光成像时特别有用,可以高速捕获快速动态事件。除了结合荧光探针外,微分干涉对比 (DIC) 等明场图像也可以与荧光图像结合。
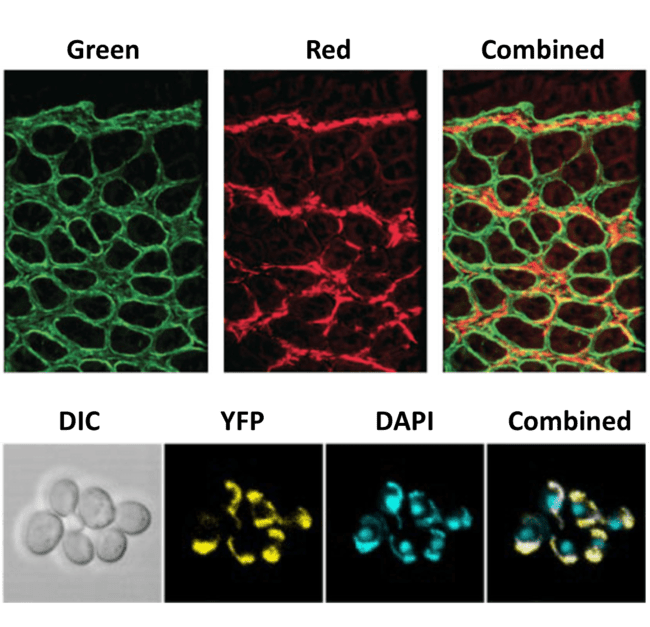
图 3:多探针荧光成像。顶部图像显示两个独立的荧光通道(绿色和红色),以及可以通过使用分光器同时成像来实现的组合图像。该图像可以通过后处理生成,但时间和信息可能会丢失。底部图像分别显示明场图像 (DIC) 和两个荧光标记物(黄色荧光蛋白 YFP 和 DAPI),以及三者的组合。
分离器增强的技术
有些技术本质上并不需要分离器来发挥作用,但它的包含使人受益匪浅。这主要是由于能够同时对多个不同状态进行成像,从而节省时间,并且根据技术的不同,其他优点也有所不同。值得注意的是,几乎所有先进的显微镜应用都受益于分光器和更灵活的成像能力,因此这里提到的技术只是冰山一角,本文绝不是详尽无遗的。
其中一项技术是福斯特共振能量转移 (FRET),这是一种用于确定两个荧光团彼此是否在一定距离内的技术。 FRET 利用荧光团分子之间的能量转移原理:类似于两个磁铁只有在足够靠近时才会吸引,两个荧光团只有在彼此距离在1-10 nm 以内时才会交换能量。 FRET 中有两种荧光分子:供体和受体,如果供体被激发并移动到足够靠近受体,它将转移能量。随后供体荧光的减少和受体荧光的增加可以通过显微镜轻松检测到。这本质上使 FRET 成为一种可以测量分子之间距离的“光谱尺”,因为只有当荧光团彼此之间的距离在 10 nm 以内时才会发生反应。
由于有两个荧光团,用于激发它们的光应该具有不同的波长,否则,两个荧光团将同时被激活并且不会发生FRET。这意味着需要两个特定波长来处理两种荧光团,并且能够对两种不同波长进行成像将使该技术更快、更有效,因为当荧光强度中一个波长减少而另一个波长增加时,会立即清楚。 FRET 是一种利用分离器的出色技术,如图 4所示。
虽然图 4中的所有三种方法在某些时候都使用分光器,但通过使用多相机适配器(图 4C),可以同时对两种荧光团进行成像,使该版本成为最快且很适合活细胞成像的版本。由于没有移动部件,也没有伪影,使用分离器设备的同步 FRET 增强了技术并允许更好的实验,从而改善动态过程的成像。
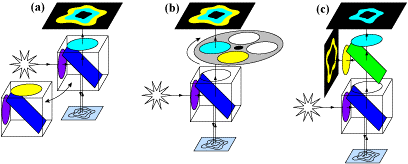
图 4:不同的 FRET 变化。 A) 可以交换两个不同的分光器立方体(每个波长一个)以对两个 FRET 波长进行成像。该技术速度较慢,并且可能会引入伪影。 B) FRET 立方体,其中立方体与滤光轮配对,滤光轮选择要分离的发射。这比交换立方体更快,并且更适合活细胞 FRET。C)使用多相机适配器的同步 FRET,其中可以通过将供体和受体分成两个相机来同时测量它们的发射。此方法没有移动部件并且同时发生,使其成为最快且无伪影的方法。
另一种受益于分光器的技术是全内反射荧光 (TIRF),该技术涉及从表面反射光以仅对样品的一小部分进行成像。在 TIRF 中,激发激光的角度使其完全从玻璃样品载玻片上反射。结果是所有激发光都被样品反射走。然而,在光被反射的区域,一小部分光会扩散到样品的一小部分中。这种光的延伸被称为倏逝波,它通常只能穿透样品约 100 nm,具体取决于显微镜光学器件。倏逝波与反射光的波长相同,因此它仍然会激发这个小区域内的任何荧光分子。
由于样品的一小部分被照亮,与标准宽场荧光相比,离焦光少得多,信噪比也更好。由于 TIRF 仅限于单个焦平面(仅照亮约 100 nm 的样品),因此它对于研究靠近表面的样品区域(例如固定在盖玻片或细胞膜表面上的分子)特别有用。
由于曝光时间短和单焦平面,TIRF 通常用于动态过程成像。为了使该技术更快并能够对多个荧光团进行成像,分光器的使用取得了巨大成功,使 TIRF 更加强大。使用分离器,可以同时执行多通道 TIRF(如图 5C所示),从而针对非常快速的事件优化该技术。
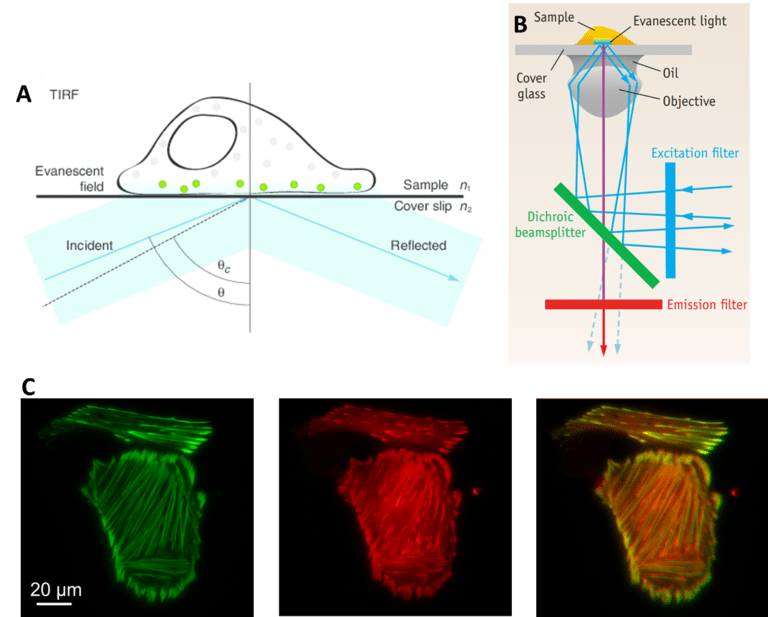
图 5: TIRF。 A) 单细胞的 TIRF,盖玻片反射光产生的渐逝场会激发最靠近盖玻片的精选少数荧光分子(绿色)。 B) TIRF 光路。 C) 同时多通道 TIRF,别显示绿色和红色通道以及组合的同步图像。
概括
分光器的使用既可以催生新技术,又可以增强现有技术,使分光器设备成为显微镜和相机之间强大的接口,提高研究人员控制光和设计更灵活和优雅实验的能力。
审核编辑 黄宇
-
分离器
+关注
关注
1文章
82浏览量
14937
发布评论请先 登录
相关推荐
LMH1980自动检测标清/高清/PC视频同步分离器数据表

TMUXHS4212双通道差分2:1多路复用器或1:2多路信号分离器数据表

HD3SS3212-Q1双通道差分2:1/1:2 USB3.2多路复用器/多路信号分离器数据表

TS5USBC400双路2:1 USB 2.0多路复用器/多路信号分离器数据表

TS5USBC402双路2:1 USB 2.0多路复用器/多路信号分离器或单端交叉开关数据表

TS3USB221高速USB 2.0(480Mbps)1:2多路复用器–多路信号分离器数据表

TS3USB221E高速USB 2.0(480Mbps)1:2多路复用器–多路信号分离器数据表

TMUXHS221 USB 2.0 480Mbps 2:1/1:2多路复用器/多路信号分离器开关数据表

TMUXHS4412 4通道20Gbps 2:1/1:2差分多路复用器/多路信号分离器数据表

HD3SS3202双通道差动2:1/1:2 USB 3.1多路复用器/多路信号分离器数据表

TMUXHS221LV USB 2.0 480Mbps 2:1或1:2多路复用器或多路信号分离器开关数据表

武汉大学:研究微流控电化学集成传感器,快速、高效分离和灵敏检测致病菌




 为什么要使用分离器?
为什么要使用分离器?










评论