2018 Medtec中国展即将于9月26-28日在上海世博展览馆举办。
作为备受展商和观众瞩目的同期现场会议——“创新技术论坛和法规峰会 2018”今年将如期召开,“法规、质量、技术”作为行业三大焦点仍将作为会议讨论的主要话题,议题全部基于作为注册、法规、质量、合规、医学、研发设计等部门及项目/企业负责人的广大观众对会议的需求来制定。
今年的会议内容保留了去年一票难求的传统热门法规峰会“中国医疗器械法规更新与应对”等;对去年备受关注的质量峰会“MDSAP最新进展和FDA工厂检查”做了更深入分析和经验分享;秉承创新引领行业发展趋势的理念,新开设了技术论坛“终端用户设计理念和创新技术A”及“前沿设计理念和创新技术B”。此外,现场其他创新会议及活动同样精彩不容错过。

上海浦东医疗器械贸易行业协会多年来一直是Medtec中国展的独家支持单位,与Medtec一起为行业发展不懈付出着。今年为了契合医疗器械市场对于法规咨询服务的强大需求,Medtec中国展新设了“医用法规专区”和“法规互动讲堂”,得到了上海浦东医疗器械贸易行业协会的认可和支持,协会会长严樑有望在法规峰会“中国医疗器械法规更新与应对”中介绍UDI的最新更新和进展,值得期待。
“法规峰会A:中国医疗器械法规更新与应对”将延续往届的超高人气,热门会议内容和议题、权威的演讲嘉宾阵容和契合听众需求的演讲议题,吸引着众多会议听众。今年我们将分析中国医疗器械行业的未来发展,围绕当下“CFDA医疗器械审评审批制度改革”、“医疗器械注册人制度”和“医疗器械临床试验质量管理规范”三大焦点政策和制度的改革、执行及实施进展来做深度解读。
法规峰会A:中国医疗器械法规更新与应对 (hot)
中国医疗器械行业的未来发展展望
CFDA医疗器械审评审批制度改革解读
UDI的数据库内容及要求
医疗器械注册人制度解读及实施进展
医疗器械临床试验质量管理规范的执行要点
符合法规要求的医疗器械临床试验设计
去年同期会议的质量专场,Medtec独家邀请到美国FDA驻华办公室助理主任萨顿,为大家现场讲解MDSAP及QMS提升等问题,并在现场设置FDA咨询台为观众现场答疑,获得了观众的一致好评,同时与会代表也对MDSAP提出了更多的问题。为此,今年质量论坛B将重点围绕“MDSAP最新进展和FDA工厂检查”进行更深入的分享,内容包括MDSAP实施进展、实践中MDSAP的注意事项与应对、FDA检查经验分享和CFDI海外飞检经验分享。FDA驻华办公室助理主任萨顿和独立法规RAC虞则立老师已确认现场开讲。此外,新设的会议论坛——质量论坛A将聚焦“外包选择与供应商管理”,帮助听众从器械生产商的角度分析如何进行供应商开发与管理控制等问题。
质量论坛B:MDSAP最新进展和FDA工厂检查(hot)
MDSAP实施进展与分享
实践中MDSAP的注意事项与应对
FDA检查经验分享
CFDI海外飞检经验分享
质量论坛A:外包选择与供应商管理(new)
医疗器械外包市场的发展现状和趋势分析
从器械生产商的角度:如何进行供应商开发与管理控制
遵循《医疗器械生产企业供应商审核指南》对供应商和外包服务商进行审核CRO/CMO公司
如何与器械制造商紧密合作,加速产品上市提升产品质量
Medtec作为全球系列展会的中国站,一直集合自身在美国、欧洲及日本等地区的资源优势,将海外前沿的设计理念和发展趋势引进国内。除了打造传统的法规和质量会议,今年我们在技术论坛开设了两大全新的会议主题:“终端用户设计理念和创新技术A”以及“前沿设计理念和创新技术B”来分析器械安全性设计、植入物产品的创新设计、外科手术机器人的研发进展及其中传感器的设计创新、如何使医疗产品的设计具有可制造性、设计医疗电子产品所必须掌握的创新要素和生物医用材料设计过程中的创新和挑战等国际前沿话题。
技术论坛A:终端用户设计理念和创新技术A(new)
临床医生的角度:器械安全性设计和“病人为中心”的理念的应用
从概念到实际:植入物产品的创新设计及案例分享
如何利用专利优势提高创新,如何规避知识产权风险
外科手术机器人的研发进展及其中传感器的设计创新
-
医疗器械
+关注
关注
19文章
828浏览量
51498
原文标题:中国医疗器械法规最热门政策解读!Medtec中国展同期会议内容揭晓
文章出处:【微信号:MEDTECCHINA,微信公众号:Medtec医疗器械设计与制造】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐

盘谷医疗器械进销存系统各地区医疗器械协会认可
医疗器械中电磁干扰的来源及影响

如何编制有源医疗器械设计开发流程?

华盛昌出席第90届中国国际医疗器械博览会
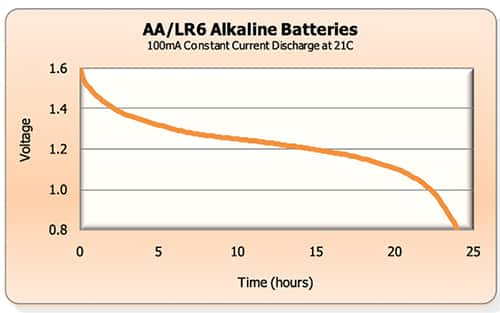
选择和优化医疗器械中的电池


1000+医疗器械新质生产力企业汇聚Medtec 2024

上海国际医疗器械展览会2025年6月25日-27日举办
医疗器械密封性负压测试仪评估

千家品牌聚展医疗器械新质力量,Medtec 2024免费参观注册通道开启





 中国医疗器械法规都更新了啥?这里有你想知道的
中国医疗器械法规都更新了啥?这里有你想知道的











评论