微流控单细胞分析的意义
细胞是生命体结构和功能的基本单位,是认识一切生命现象的基础和前提。传统的基于细胞的生物学分析中,研究对象通常是数以十万至百万计的群细胞。随着现代生物学的发展,这种传统的细胞研究方式得到的“平均值”已经不能满足人们的需要,因为研究发现细胞间存在多样性,或者说是异质性。从细菌到真核细胞,这种异质性越发显著。以肿瘤异质性为例,研究人员发现,同一种恶性肿瘤在不同患者个体间或者同一患体体内的不同部位肿瘤细胞间均存在一定的差异,体现出恶性肿瘤的高度复杂性和多样性。由此可见,需要建立有效分析单个细胞的化学信息,亦或是测定单细胞对外界刺激的反应的研究平台。这不但能使人们更充分地了解细胞群体中某些特殊的细胞功能,更能鉴别大量细胞群体中少量的不正常细胞,为重大疾病的早期诊断和治疗、药物筛选和细胞间相互作用等研究提供可靠的科学依据。
尽管单细胞研究已被认为是21世纪生命科学研究的重要突破口,但是将单个细胞作为分析对象时,检测平台的构建目前面临以下4方面的巨大挑战:(1)由于单细胞体积小(微米级),胞内分析物的尺寸更小(亚微米级甚至纳米级)且浓度极低,这就要求检测平台不但具有较强的分离与操控单个细胞的能力,而且应当具有较高的检测灵敏度;(2)为了能够有效地分析单细胞间的异质性以及得到具有统计学意义的数据,往往需要检测平台能够同时分析大量单细胞,即具有高通量和快速检测的能力;(3)在一些动态观察和分析单细胞的荧光、形态等研究需求中,检测平台应当具有实时显微观察的功能;(4)因需要分析与检测的细胞数量通常很大,检测及分析技术的开发应以简单易行、经济实惠为前提,以提高其在应用时的普适性。
单细胞分析这一研究领域具有学科交叉性强的特点,因此,在众多诸如生物学、物理学、材料学及计算机学等领域的科研工作者的共同努力下发展了很多单细 胞分析技术,包括流式细胞仪、荧光显微成像技术和毛细管电泳技术等。这些技术的出现已经使单细胞研究进入到了分子结构的水平,但是这些方法均存在着一 些不足。例如,虽然流式细胞术是目前用于高通量表征单个细胞活动的最先进的技术,但它并不具有操控某个特定目标细胞或者是动态跟踪观察单个细胞的能力。而其他单细胞分析的方法,包括显微成像、毛细管电泳等,虽然可以精准分析单细胞的组分和结构,但是检测通量较低。因此,为了满足单细胞分析领域更高的研究需求,人们将目光转向了微流控芯片这一新型操控及分析平台。
微流控芯片(microfluidic chip),又称芯片实验室(lab-on-a-chip, LOC),是一种以微机电技术为基础,以多维网络微流道为结构特征,目标是将化学或生 物样品的采集、稀释、反应、制备、检测等基本操作步骤转移和集成到很小的芯片上,最终实现常规化学或者生物实验室的微型化和集成化。微流控芯片不仅具有体积轻巧、样品及试剂使用量少、操作速度快、通量高、应用成本低等优点,更重要的是,这种集成化的微芯片式自动分析平台能够有效避免人为操作产生的误差,得到的数据可靠性更高。短短十几年内,微流控芯片已经成为最前沿的研究领域之一,特别是在与单细胞相关的研究中,微流控芯片被认为是最具发展潜力的高通量单细胞分析平台。微流控芯片中微米级的二维或三维通道为单个细胞的操纵提供了尺寸相匹配的结构。根据不同的研究需求,微流控芯片系统可将多种单细胞研究所需的操作单元,如细胞操纵相关的微泵、微阀技术,单细胞捕获技术以及检测分析单元等设计并集成到微小的芯片平台上。除此以外,微流控芯片的加工材料通常为聚二甲基硅氧烷(PDMS)及玻璃等,这类材料透明度高,生物相容性好,有助于单细胞的实时观察与分析。综上所述,相比传统的单细胞分析方法,微流控芯片技术展现出巨大的应用优势,为单细胞相关的研究提供了更多的可能性。
微流控单细胞捕获技术
在所有的微流控单细胞分析平台开发中,都要面临单细胞捕获的问题,这主要指如何在微米级通道内分离出单个细胞并将其固定在特定位置,以便于进行后期操作与分析检测。微流控芯片上的单细胞捕获过程应当兼具操作简单高效和保证细胞活性的要求。目前已报道出多种微流控单细胞捕获技术,其中,基于流体动力和液滴微流控的捕获方法主要是通过合理地设计芯片中的微结构,使得当细胞悬液以一定流速流过芯片时,即可实现高通量的单细胞捕获,捕获过程不需要施加其他外力;而基于光、电、声、磁的捕获法则是需要借助外力的作用驱使细胞移动到特定的捕获位置,以实现高效、准确的高通量单细胞捕获。下面逐一介绍这些技术的原理和应用,为单细胞分析相关领域的技术开发提供参考。
流体力学捕获法
流体力学捕获法是通过微加工的方式在微流控芯片中制备刚性障碍微结构,从而可以将单个细胞从流动的细胞悬液中分离捕获的方式。该方法主要包括两种捕获思路:一种是微筛式结构,利用各种形状的微挡板阵列拦截细胞,由于每个微挡板结构只能拦截并容纳单个细胞,因此当细胞悬液流过后即可形成单细胞捕获阵列;另一种是微坑式结构,主要是设计与单细胞尺寸相当的凹槽结构阵列,当细胞悬液流过芯片时,细胞因自身的重力落入凹槽阵列中,形成单细胞阵列,并且细胞在落入凹槽后,受到的流体冲击力很小,捕获的细胞不易被冲走。 Carlo等研究了一种U型高密度单细胞捕获阵列(图1(a)),当细胞悬液流进芯片的捕获区域时,其中一部分细胞会被卡在如图1所示的这种“微坝”阵列处,最终形成高通量的单细胞捕获阵列。Cooper等设计了一种如图1(b)所示的包含有440个单细胞捕获位点的微流控芯片,用于肿瘤单细胞的药物动力学研究,结果表明利用这种可视化的芯片平台对细胞凋亡的有效评估可以与流式细胞仪相比拟。Voldman等设计了一种双向凹陷的微结构阵列,实现两种单细胞的捕获、配对和融合,如图1(c)所示。当一种细胞流过芯片时,会在双向凹陷微结构的一面被捕获,此时将溶液反向流过后,捕获的细胞会被冲到另一面的凹陷中,然后再次进样捕获另一种细胞,即可形成单细胞配对阵列,配对率达70%。Deutsch等在玻璃基底上通过刻蚀方式制备了高密度的蜂窝状微坑阵列(图1(d)),将细胞悬 液滴在阵列表面后盖上盖玻片,静置几分钟后,细胞即可沉降落入微坑阵列中,形成单细胞阵列,而微坑的大小亦可根据细胞的种类不同而作相应的调节。这种高通量的单细胞捕获阵列的构建使得多种进一步的单细胞处理与分析,如荧光标记、酶动力学研究、胞内组分分析等,均可实时在线完成。
(a)~(c)微筛式细胞捕获阵列结构示意图及显微图片;(d)高密度蜂窝状微坑细胞捕获阵列
图1 基于流体力学的微流控芯片上的单细胞操控
流体力学捕获法操作过程简单,无需使用特殊的缓冲液,通过合理地设计芯片中微通道及与细胞尺寸相当的捕获微结构,即可实现高通量的单细胞捕获,并且固定的捕获位点适合于单细胞的实时观察和追踪分析。但是这种方法的芯片通常加工难度较大,成本较高,并且在进一步的单细胞分析中,可能会存在交叉污染的问题。
液滴微流控捕获法
利用液滴微流控法捕获单细胞是在封闭的微通道网络中生成纳升至皮升级液滴并将单个细胞包裹在液滴中的技术。这一技术不仅可以短时间内生成大量单细胞液滴,而且每个液滴皆可作为独立的单细胞微反应器,有效避免了交叉污染,最终可满足多种单细胞的研究需求。目前,最常用于生成微液滴的方法T型通道法和十字型流体聚焦法,两者都可以通过控制两相流速来生成大小均一、性质稳定的液滴(图2)。其中,T型通道结构如图2(a)所示,油相作为连续相,水作为分散相,分别从通道接口的两端汇入,在表面张力与剪切力的共同作用下,分散相进入连续相中形成分散的液滴。十字型流体聚焦芯片结构如图2(b)所示,中间流道的分散相受到两边连续相的“挤压”,即可稳定地形成连续分散的液滴,这种芯片结构产生液滴的过程更易于操控,液滴尺寸更均匀,范围也更广。从生物相容性和保证细胞存活的角度来说,用于包裹细胞的液滴通常采用的是油包水的形式。
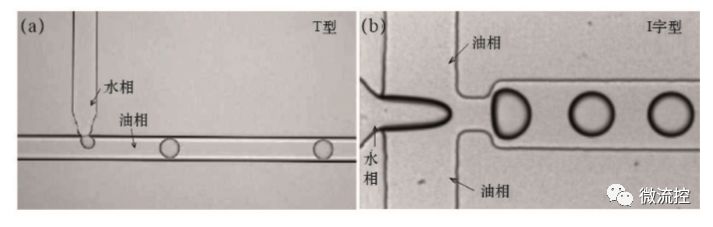
图2 T型通道法(a)及十字型流体聚焦法;(b)生成液滴示意
Pan等报道了一种用于观测单细胞的生长增殖情况的液滴微流控芯片技术(图3(a))。芯片的操作分为两步,第一步是生成大量包裹着单细胞的微液滴,第二步则是将单细胞液滴取出进行观察和分析;在取出单细胞液滴放置于芯片内后,细胞间的相对位置便不再会发生变化,可用于观察单细胞随着时间变化的增殖情况及细胞间的差异的研究。Novak等用琼脂糖液滴微流控技术进行了高通量的单细胞基因分析。他们先用琼脂糖液滴将细胞和包含有引物的微球一同包裹在微液滴内(图3(b)),在细胞被裂解后基因组DNA则被留在了液滴内,随后将液滴与聚合酶链式反应(PCR)所需的反应物进行孵育,可直接在液滴内进行PCR,最后将微球提取出来进行高通量的流式分析和DNA测序。值得一提的是,目前已经有不少公司开发了基于液滴微流控芯片技术的检测分析仪器,比如,英国Dolomite公司开发的液滴微流控系统可以在微流控芯片上快速生成大量尺寸可控、单分散性好的微液滴,液滴内部可以再包含更小的液滴,且外部和内部的微液滴在大小和形状上都具有很好的一致性,为单细胞测序以及单细胞间相互作用等分析领域的研究提供了一种稳定、高效的多功能分析平台。美国10XGenom-ics公司基于液滴微流控的原理设计开发了高通量单细胞转录组测序平台,可同时获得103~104个细胞的表达信息,从而实现对细胞群体的划分与细胞群体间基因表达差异的检测,也为肿瘤细胞异质性,免疫细胞群体检测以及胚胎发育等众多研究领域提供了技术平台。基于液滴微流控的单细胞捕获芯片加工成本低,消耗试剂和样品量少,捕获速度快,特别适合于需要将单细胞和其他试剂独立包裹在微液滴中进行单细胞分析的研究中,但是这种方法常存在单个液滴中无细胞包裹或多个细胞包裹的情况,并且包裹单细胞后的微液滴位置难以固定,不太适合特定单细胞的实时观察。
图3 微流控液滴生成与单细胞包裹图
单光束激光捕获法
单光束激光捕获技术,又称为光镊,是一种可以通过高度汇聚的激光束形成三维势阱,并利用束腰附近存在强大的梯度力捕获并移动单个细胞的技术(图4 (a))。如图4(b)所示,通过光束的调控,光镊能够精准地捕获一群细胞中的单个或多个目标细胞,并将其移动到特定的位置便于分析检测。再如,光镊可作为细胞融合的有效工具,将激光捕获的2个细胞紧密接触再融合,能使对细胞的损伤降至最低,也不会产生不期望的融合物(图4(c))。进一步地,光镊不仅可以精准地操控微米级的单个细胞,可以利用光束的穿透性实现对细胞内部各种尺寸更小的细胞器进行操纵。
图4 基于光镊技术的微流控芯片中的单细胞捕获
光镊捕获技术在单细胞的操控方面拥有独特的优势,光镊具有微米级范围定位的能力,能够精确地捕获和移动单个细胞,而且光镊不需要接触细胞,因此整个操作甚至可以在完全密封的容器里进行,不会损伤细胞,污染少。但是,光镊需要的设备要求较高,价格昂贵,并且不太适合应用于高通量的单细胞捕获和分析领域。
介电电泳捕获法
介电电泳现象由Pohl在1951年首先发现,描述的是非均匀电场中介电粒子被极化而受力产生的定向移动。如图5所示,在不同的电极结构产生的不同的非均匀电场中,介电粒子会受正介电电泳力(p-DEP)作用向高电场或者受负介电电泳力(n-DEP)作用向低电场运动,最终在不同的位置被捕获固定,从而实现粒子 的有效操控。同样地,作为介电粒子的细胞被置于非均匀电场中时,只需通过改变施加电压的大小和频率等条件,细胞即可根据其所受到的介电电泳力进行移 动。近年来,研究人员将基于介电电泳的细胞操纵技术与微流控芯片技术相结合,得到了一系列高效可靠的单细胞研究平台。
图5 不同电极结构产生的非均匀电场中受正介电力和负介电力的粒子捕获示意
Hunt等开发了一种“介电电泳镊”(图6(a)),将微电极制备在玻璃毛细管的针尖两侧,通过调整电压、频率等参数,可以灵活实现单个细胞的捕获、释放、移动等多种操控,但是每次只能对一个细胞进行分析,通量较低。Voldman等利用微加工技术制备了8组三维柱状电极阵列(图6(b)),每组分别包含4个微柱状电极,并可作为一个独立的单细胞操控单元,通过调节施加电压的参数,可以利用介电电泳力选择性地捕获单细胞,而在断电后,捕获的单细胞会被释放。Cheng等建立了一种平面式的基于介电电泳技术的高通量单细胞配对微流控芯片平台(图6(c)),两种细胞悬液先后流经微流控芯片并受强介电电泳力的作用被捕获进入微孔阵列中,最终在1cm×1.5cm的捕获区域完成了超过2400对的单细胞配对,配对效率达70%以上,这种高通量单细胞配对芯片有望应用于细胞的精准融合,细胞-细胞间相互作用等研究领域中。
图6 基于介电电泳技术的微流控芯片上的单细胞捕获
基于介电电泳技术的单细胞捕获法具有操作简单灵活、捕获效率高、对细胞损伤小以及可实时观察等优点。但是,这一捕获法通常需要使用特殊的缓冲液,合理地设计电极结构及分析细胞受到的介电电泳力,对保证细胞的活性和实现高效的单细胞捕获至关重要。
声捕获法
通过声波结合微流控芯片进行细胞操控的方法,是指在芯片上施加一定的声场,使芯片通道内的细胞受到声波力的作用驱使细胞迁移至特定位置。用于细胞操控的声波分为体声波驻波和声表面驻波两类。体声波驻波操控细胞的原理是当超声驻波激发微流体通道产生共振时,通道内的细胞由于大小、质量、密度等物理性质的不同,将受到不同的声波力的作用,从而可以将不同种类的细胞分成几股液流,实现理想的细胞分离富集的预处理过程。Laurell等利用这种技术成功完成了血液清洗过程(图7(a))。另一种声表面驻波装置,又称为声镊,通过在微流控通道周围放置叉指换能器用于形成表面驻波。在声表面驻波的作用下,细胞将受到机械扰动并沿着流体上清晰的流线移动。与体驻波相比,声表面驻波装置可以提供的频率范围较大,更加有利于单个细胞的灵活操控,即能快速地将单个细胞捕获在精确位置,而且细胞的活性不受影响,这一技术在微流控单细胞操控领域受到越来越多的关注。Huang等开发了一种利用声表面驻波装置实现高通量单细胞操控的微流控芯片,如图7(b)所示。他们构建的声学装置包含了两对产生声波的叉指换能器。当两股声波在微通道内相遇时,形成的驻波会产生一系列的压力节点,细胞在压力节点处可被捕获,并且通过调节声波波长和相位,可以移动压力节点从而灵活控制单细胞的捕获位置。
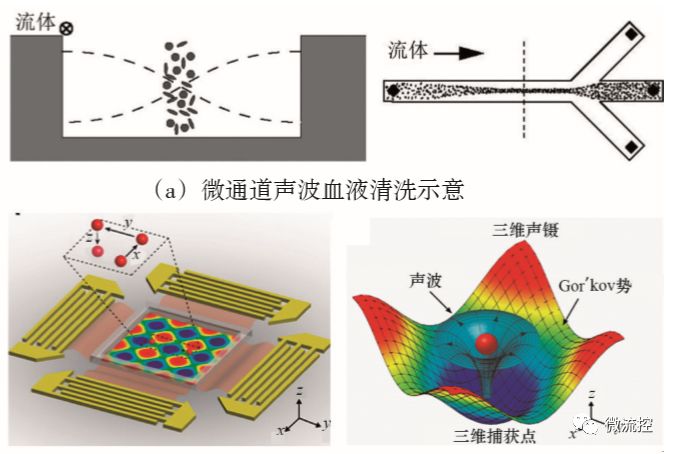
图7 基于声波技术的微流控芯片上的细胞操控
声表面驻波技术能实现无接触、快速简便的高通量单细胞捕获,且用于捕获的声波能量对细胞无伤害,芯片制作较为简单。与介电电泳技术类似,该技术对产生声表面驻波的装置的设计、制作及控制要求较高。
磁捕获法
磁捕获技术的工作原理是目标细胞与磁性微球发生非特异性或特异性吸附后,利用外加磁场的作用可以实现目标细胞的捕获和排列。以基于肿瘤表面标志物的磁捕获技术为例,目前大多数癌细胞表面具有一种叫上皮细胞黏附因子(epithelial cell adhesion mole-cule, EpCAM)的蛋白质,通过在磁珠表面包被Anti-Ep-CAM抗体,即可与目标癌细胞发生特异性结合,形成磁珠-细胞的复合物,然后在外加磁场的作用下,复合物受磁力作用被分离捕获。Chan等将单个细胞包裹在一种双色磁性微球中(图8(a)),通过外加磁场操控双色球,可以实现对单个细胞的操控。Kang等报道了一种基于磁珠捕获技术的循环肿瘤细胞(CTCs)分离微流控芯片,如图8(b)所示。芯片内包含有主通道以及通道两边的侧腔结构,侧腔内集成有磁铁。他们以掺有少量乳腺癌细胞的小鼠血液作为样本验证器件的性能,癌细胞的表面吸附有磁珠,即当这种血液样本流入芯片后,带有磁珠的癌细胞会在磁场的作用下被捕获入侧腔结构中,最终实现了90%的捕获效率,并且捕获得到的癌细胞能够存活7天。
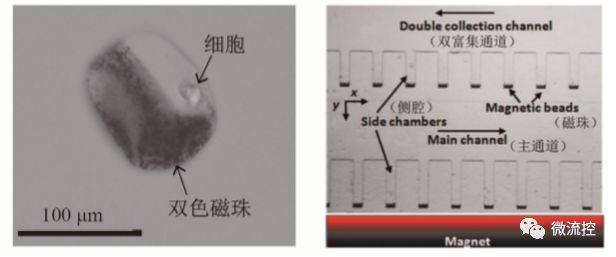
(a)双色磁珠包裹单细胞图片;(b)微磁-微流控CTCs分离芯片
图8 基于磁捕获技术的微流控芯片上的细胞操控
总体来说,磁捕获技术对芯片结构设计的要求不高,细胞捕获也不需要复杂的外部设备。但是,捕获操作之前需要先对细胞进行磁性粒子修饰,而且在基于抗原-抗体识别的免疫磁珠捕获技术中往往还存在着抗体容易失活、价格昂贵、反应条件苛刻等一系列的缺陷,从而限制了其实际应用。
结论
经过多年的发展,微流控单细胞捕获技术已经广泛应用于单细胞相关领域的研究中,为进一步的单细胞生物学的研究提供了有力的保障。虽然目前这些微流控芯片单细胞捕获方法多样且有效,但是每种方法本身都存在一些不足。例如接触式方法如液滴微流控技术设备简单,但是往往捕获效率不高;借助外力的非接触式的捕获方法操作温和、效率高,但通常需要集成外部复杂的设备。因此,合理有效地结合多种微流控单细胞捕获手段,最终发展更为简单高效的单细胞捕获技术,不仅能够增强其在普通实验室中的实用性,更为单细胞分析提供了更可靠的研究平台。
-
芯片
+关注
关注
458文章
51439浏览量
428883 -
细胞
+关注
关注
0文章
66浏览量
18376 -
微流控
+关注
关注
16文章
550浏览量
19028
原文标题:微流控芯片在单细胞捕获中的应用
文章出处:【微信号:MEMSensor,微信公众号:MEMS】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
微流控芯片在细胞培养检测中的应用
常用的微流控芯片类型
基于介电电泳的选择性液滴萃取微流体装置用于单细胞分析
基于双极性电极阵列的微流控芯片,可实现细胞可控、非接触三维旋转





 微流控芯片在单细胞捕获中的应用
微流控芯片在单细胞捕获中的应用










评论