研究背景
在醚类电解液中,锂硫/硒(Li-S/Se)电池发生“固-液-固”反应机制,产生可溶的多硫化物Li2S4-8(LPSs)/多硒化物Li2Se4-8(LPSes)中间产物。这种机制会不利于电池电解液用量的进一步减少,从而弱化Li-S/Se电池在能量密度方面的优势。使用抑制 LPSs/LPSes溶解的低溶剂化电解质AN2(AN与LiTFSI摩尔比为2,简称AN2),可以减少电解质用量。但是低溶剂化电解质反应动力学缓慢,并且与锂金属的兼容性差。
成果简介
近日,华中科技大学伽龙教授通过调节电解质结构,发现在弱溶剂化电解质AN3(AN与LiTFSI摩尔比为3,简称AN3)中,LPSs/LPSes溶解度略高于低溶剂化电解质,可以促进电化学反应,并稳定锂负极。在高电流密度、高负载和贫电解液 (E/A) 的条件下,AN3电解质可实现高活性材料利用率。
在0.1 C时,采用SeS2正极的电池的放电容量为1047 mAh g-1(理论容量1123 mAh −1的93.2%)。即使采用高负载SeS2正极(9.5 mg cm−2)和超低E/A(1 μL mg−1)条件下,使用AN3电解液的电池可逆容量仍达到713 mAh g−1。
研究亮点
(1) 提出了一种弱溶剂化电解质AN3(AN:LiTFSI 1:3摩尔比)来实现高比能 LiSeS2电池。
(2) 弱溶剂化电解质AN3改变了反应路径,促进了SeS2 正极的转化。
(3) 部分溶剂化的中间体有助于在锂负极上形成坚固的 SEI。
(4) 在 1 μL mg-1 的贫电解质条件下,实现了具有 7.0 mAh cm-2 高负载的可逆 Li-SeS2电池。
图文导读
为了使用AN作为锂金属电池电解质的溶剂,增加锂盐浓度是有效解决方案,高浓盐可以使游离AN分子与Li+离子配位。为了确定需要多少盐来保证对Li金属的还原稳定性,将新鲜的锂箔浸入AN溶剂和AN溶液中(ANx,这里x是指AN与LiTFSI的摩尔比),并监测溶液的颜色变化。纯AN溶剂在1小时后变为淡黄色,稀释溶液(AN4)在1天后变为黄色,颜色变化是由于Li和AN分子之间的反应。而锂箔在AN2和AN3电解质中即使在10天后也保持透明。
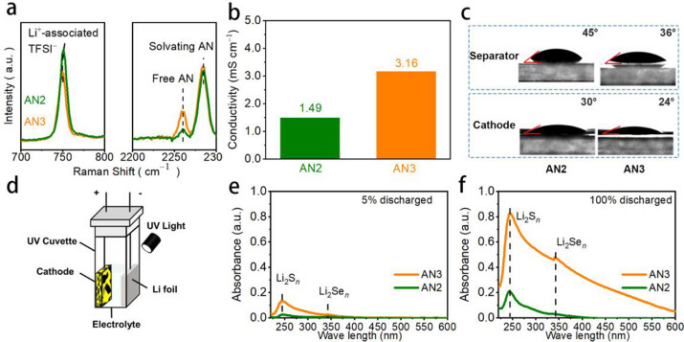
图1. AN2和AN3电解液的物化性质比较。(a)拉曼光谱,(b)电导率,(c)电解液在隔膜和正极上的接触角,(d)用于原位UV-Vis表征的比色池的示意图,以及(e)5%和(F)100%放电深度下的UV-Vis光谱。
与以前文献中常用的AN2相比,AN3显示与Li+离子配位的TFSI−的拉曼光谱峰更低(749 cm−1),有更强的自由-AN峰(如2258 cmν1的≡C−N伸缩振动),表明AN3中有更多的自由Li+离子和AN分子(图1a)。这种电解液结构的变化使AN3在不同温度下具有更高的离子电导率(图1b)。此外,随着游离AN分子的增加,AN3与隔膜和SeS2正极的润湿性更好(图1c)。以上物理化学性质证实了AN3作为锂金属电池电解液的优越性。
额外的游离AN分子还赋予AN3作为Li-S(Se)电池电解质的其它优点。一个明显的例子是它对LPSs/LPSes更高的溶解度,这有利于电池的高倍率能力。为了研究AN2和AN3之间的溶解度差异及其对电化学行为的影响,作者设计了一个比色池(图1d),并在放电过程中原位监测电解质的UV-vis光谱,其峰强度与溶质的浓度呈线性关系。
图1e观察到位于242 nm和340 nm的两个主要吸收带,其分别对应于可溶性LPSs和LPSes。AN3中LPSs的峰值强度是AN2的5倍,表明AN3中形成了更多的可溶性LPSs,并且在放电过程开始时产生了两种电解质之间的溶解行为的差异。在放电结束时(100%放电,图1f),尽管两种电解质的峰强度增加,但在AN2仍然难以观察到340 nm吸收带(LPSes的峰)。
电化学过程中AN3中LPSes的形成可能有利于Li金属负极的稳定性。基于原位UV-vis结果,清楚地证明了AN3中比AN2中有更多的溶剂化中间产物。微溶剂化电解质(如AN2)代表饱和电解质,其中的中间体很难溶解。弱溶剂化电解质(如AN3)代表浓缩电解质,其含有比游离AN2更多的配位AN,反应产生的中间产物可以轻微溶解。
作者选择SeS2作为正极活性材料,因为硒的电导率(10-5 S cm-1)远高于硫的电导率(5×10 -30 S cm-1),将硒引入硫正极可以提高电极的电导率,这对于促进Li-S/Se电池的反应至关重要,尤其是在使用低溶剂电解质时。SeS2显示出与Se和S的XRD不同的X射线衍射(XRD)图,证实了在加热过程之后形成了新的相。
得益于将高导电Se结合到S电极中,Li-SeS2电池在AN3电解液中显示出比Li-S电池(0.70 V)更低的放电-充电极化(0.28 V)。此外,在AN3电解液中,Li-SeS2电池比Li-S电池表现出更好的循环稳定性,尽管其在前40次循环中的放电容量较低。这种循环稳定性的显著提高可归因于LiSeS2电池的Li负极在AN3电解质中的稳定性增加。
在AN3电解液中加入硒元素不仅提高了正极的电导率,而且允许更多的多硒化物溶解,这些多硒化物既是重要的氧化还原介质,又有助于形成稳定的SEI。
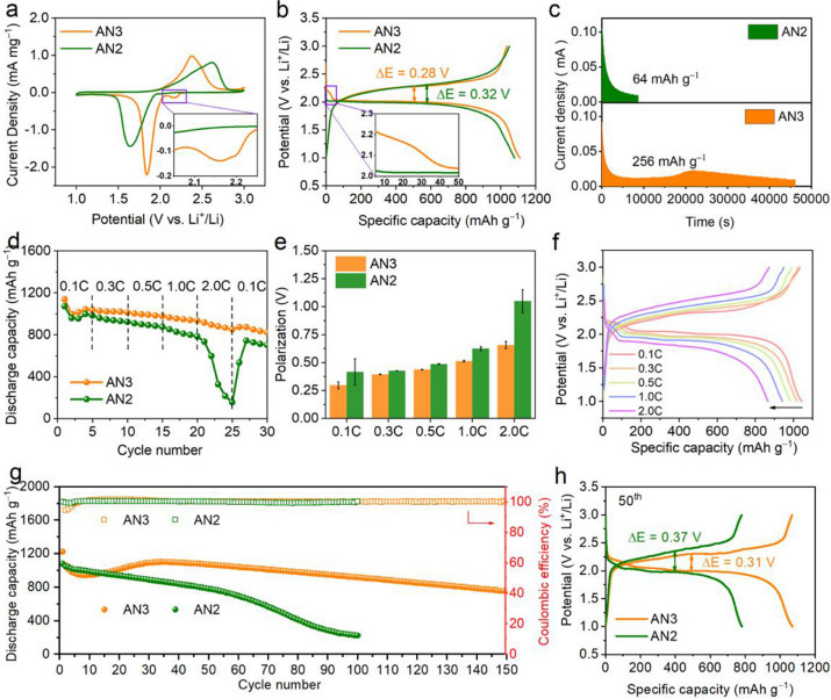
图2. 在AN2和AN3电解液中,Li-SeS2电池的电化学行为比较。(a)在0.1 mV s−1扫描速率下的CV曲线,(b)在0.1 mA cm−2电流密度下的放电充电曲线,(c)恒压2.1V放电曲线,(d)倍率性能,(e)过电位,(f)0.1,0.3,0.5,1和2C(1C=1123 mA g−1)下的放电/充电曲线,(g)在0.1 mA cm−2电流密度下的循环性能,以及(h)第50个循环的相应放电-充电曲线。
用扫描速度为0.1 mV S-1的循环伏安法(CV)研究了AN2和AN3中Li-SeS2电池的电化学动力学。与AN2的CV曲线相比,AN3中的电池显示位于2.16V的额外还原峰 (图2a),这是由于AN3中LPSs/LPSes中间体的形成和溶解。这样的结果与原位UV-vis表征一致(图1d-f)。
相比之下,由于LPSs/LPSes在AN2的低溶解度,AN2的Li-SeS2电池仅显示一个放电平台,这意味着固-固转换机制(图2b)。游离AN溶剂的引入将低溶剂化的AN2电解质转变为弱溶剂化的AN3电解质,并允许部分活性材料参与电化学过程中的溶解沉淀反应,这将反应极化从0.32降低到0.28 V,而没有容量损失。
电化学阻抗谱(EIS)进一步证实了AN3中Li-SeS2电池反应动力学的改善。通过在2.1 V下恒压放电实验,以了解放电过程中固体SeS2到LPSs/LPSes中间体的溶剂化过程。AN3电池的恒电位放电时间为46135 s,容量为256 mAh g-1,远高于AN2电池(8672 s和64 mAh g-1)。此外,与AN2相比,AN3中的电池在21481 s处观察到明显的还原电流峰,这证实了在AN3中,Li-SeS2电池在放电期间的溶剂化过程增加(图2c)。
AN3中LPSs/LPSes中间体的溶剂化增加使得Li-SeS2电池具有超高倍率性能。图2e比较了在0.1C至2C(1C = 1123 mA g-1)范围内,AN2和AN3中Li-SeS2电池的倍率性能。在AN3中,Li-SeS2电池在0.1 C时表现出1047 mAh g-1的高容量,相当于理论值的93.2%,即使当电流密度增加到2.0 C时,仍可保持851 mAh g-1的稳定容量(图2d)。
相比之下,在AN2电解质中的电池在2.0 C下经历快速容量衰减。同时,电解质从微溶剂化的AN2到弱溶剂化的AN3的调节降低了充电-放电极化,在2.0 C高倍率下,AN2对于AN3的极化从1.05 V降低到0.65 V (图2e和2f)。
以0.1 mA cm−2的电流密度循环测试,研究了Li-SeS2电池在AN2和AN3中的长循环性能。如图2G所示,AN3中的电池表现出良好的循环性能,135次循环后保持了800 mAh g−1的高可逆容量,对应于每循环0.25%的低容量衰减率。相比之下,AN2中的电池容量衰减很快,75次循环后容量为490 mAh g−1,100次循环后容量为223 mAh g−1。
研究还发现,在AN3中,电池的库仑效率(CE)保持在99%以上,表明在电化学过程中,即使有更多的LPSs/LPSes溶解在AN3中,中间产物的“穿梭效应”也可以忽略不计。
图2h比较了在第50个循环时,Li-SeS2电池的放电-电压分布,在AN3中的极化是0.31V,容量为1071mAh g−1,甚至低于AN2中第一个循环的极化(0.32V)。同时,AN2中电池的极化从第一个循环的0.32V 增加到 50 个循环后的 0.37V,电压极化的变大可能解释了AN2中的电池容量损失(从第一个循环的1079mAh g−1到50个循环后的781mAh g−1)。
综上,电化学极化、倍率能力和循环性能的改善可以归因于LPSs/LPSes在AN3中的溶解度增加,从而促进了中间产物在电化学过程中的溶剂化,改善了反应动力学。
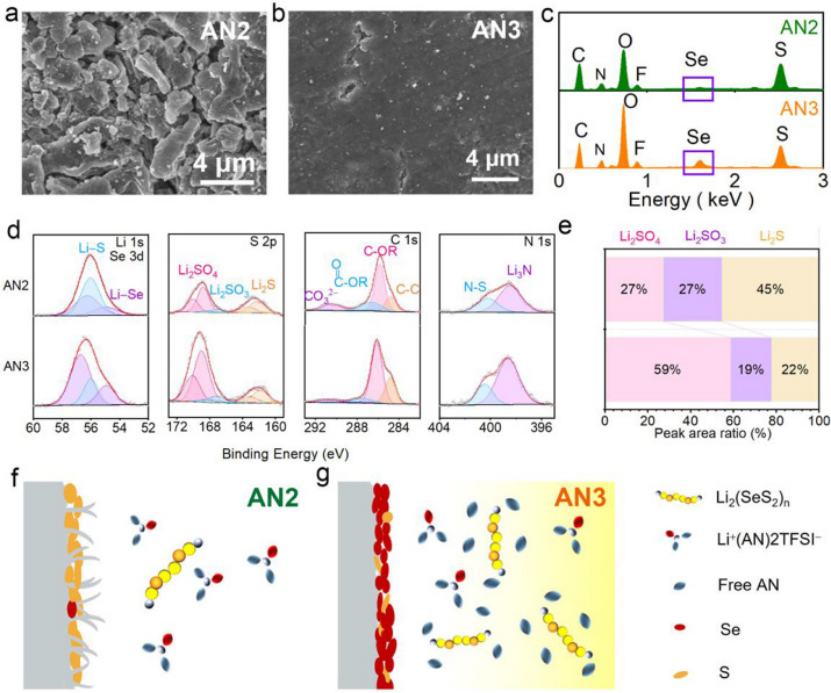
图3.在(a)AN2和(b)AN3中,在100次循环后的锂负极表面形貌,以及(c)相应的EDS结果。(d)Li 1s、S 2p、C 1s、N 1s的XPS,以及(e)在AN2和AN3电解液中循环3次后,Li-SeS2电池中含S的Li金属负极物种的相对组成。(F)AN2和(G)AN3中锂负极上的SEI形成示意图。
为了研究电解液对锂负极稳定性的影响,在AN2和AN3中拆解了循环后的Li-SeS2电池,并用SEM比较了循环后的Li负极的形貌。在AN2中循环的锂负极仅在三次循环后就显示出多孔疏松的结构(图S14a),而在AN3中,循环的锂负极沉积光滑致密,没有锂枝晶。100次循环后,AN3中的锂负极保持致密(图3b),而在AN2中锂沉积的形貌为单独的颗粒状 (图3a)。上述结果证实,通过将电解液的溶剂化性能从稀溶化调整为弱溶剂化,锂负极的循环稳定性显著提高,这也有助于Li-SeS2电池的长期稳定性。
为了弄清电解液如何影响锂阳极上SEI的形成,用能谱仪(EDS)检测了循环锂负极的元素分布。如图3c所示,AN3中循环锂负极的能谱显示出更强的Se峰。Se元素含量的增加可以归因于AN3中可溶性LPSes的增加,富Se的SEI层一直被认为有利于锂负极的稳定性。
用X射线光电子能谱(XPS)进一步表征了循环锂负极的SEI组成。图3D比较了AN2和AN3电解液中形成的SEI的Li 1s、S 2p、C 1s和N 1s谱。两种电解液中循环锂负极的Li 1s峰分别对应于Li-Se键的56.7和54.9 eV。根据峰面积比,AN3循环后的锂表面上的Se原子浓度远远高于AN2电解液中的Se原子浓度。
电解液中的硫元素可以从LiTFSI盐和可溶性LPS中获得,而Se元素只能从电解液中的可溶性LPS中找到。因此,可以再次证实,在AN3中循环的锂负极中Se含量较高是由于从稀溶化AN2到弱溶剂化AN3电解液中可溶性中间产物的增加。
在S 2p中可以发现在两种电解质在锂负极界面的另一个明显差异。在AN3中形成的SEI中SO42-的峰高于AN2。LiSO4 可以有效保护 Li 表面免受 AN 分子的腐蚀,从而延长锂的使用寿命。Li2SO4组分对于锂金属上稳定的SEI是有益的,并且对电池的循环能力很重要。
根据峰面积比计算AN2循环锂负极SEI中Li2SO4的含量,Li2SO4中S的原子浓度为59%,几乎是AN2的两倍(图3e)。而对于在AN2中循环的锂负极,SEI包含更多的CO32−,这是由于Li负极和AN2电解质之间的连续反应,导致气体生成和对SEI的破坏,因此循环稳定性较差。对于N 1s光谱,AN3中的SEI含有更多的Li3N(398.6 eV),Li3N不仅增加了SEI的机械强度,而且还表现出高Li离子电导率,有助于均匀和快速的Li+离子通量。
这些结果表明,自由AN分子和溶解的LPSs/LPSes之间的共反应在AN3中形成了致密光滑的SEI层。随着Li2SO4和Li3N的增加,在AN3中形成的SEI层更加光滑和致密,实现了均匀和快速的Li镀/剥离。
为了进一步确认SEI层的功能,组装了不对称的Li||Li电池。具有新鲜Li片的Li||Li电池仅在15小时后就显示出巨大的极化波动,这表明Li负极和AN3之间发生了剧烈的副反应,表明在AN3中的Li-SeS2电池中形成的SEI层有效地稳定了Li负极的循环稳定性。
如图3f和3g所示,用于解释微溶剂化AN2和弱溶剂化AN3电解质中SEI的形成。在AN2中,所有溶剂分子都与LiTFSI配位形成Li+(AN)2TFSI。由于缺少游离AN分子,LPSs/LPSes中间产物的溶解变得困难,从而导致Li-SeS2电池在AN2中的“固态”反应途径受阻。
在这种微溶剂化电解质中,锂负极表面形成的SEI层疏松不稳定,导致电池循环稳定性差。在AN3 中,增加的游离 AN 分子允许溶解更多的 LPSs/LPSes 中间体,Li-SeS2电池经历LPSs/LPSes中间产物的转化过程。溶解的LPSs/LPSes中间产物促进了 S (Se) 与其放电产物之间的转化,并有助于在锂负极表面形成坚固稳定的 SEI层,从而延长循环寿命,并提高倍率性能。
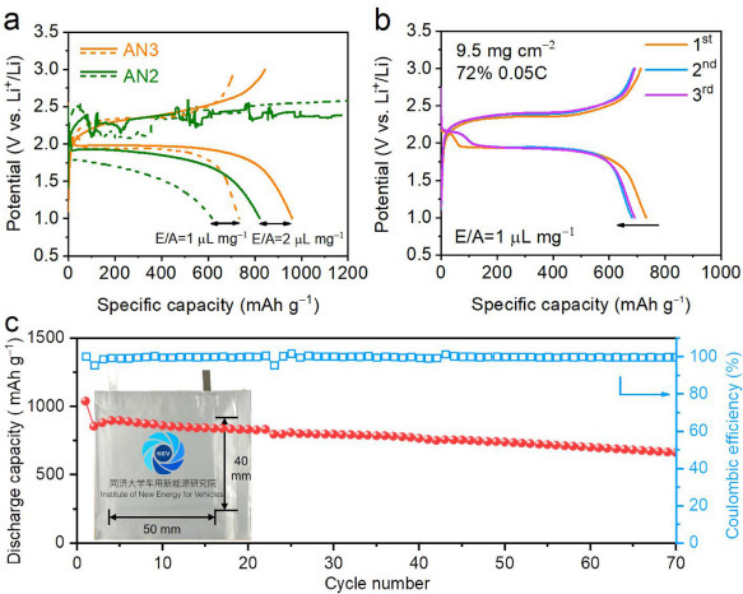
图 4. (a) 在 AN2和AN3 电解质中,负载为 9.5 mg cm−2、E/A 比为 1 和 2 µL mg−1 的 Li-SeS2 电池的放电-充电曲线,(b)在 AN3 电解质中, E/A 比为 1 µL mg−1 的情况下,Li-SeS2 电池前三个循环的放电-充电曲线,以及 (c) Li-SeS2软包电池的循环性能,插图为电池图片。
如图4a所示,在高负载(9.5 mg cm−1) 和高活性材料含量(72 wt%)的SeS2正级中,在E/A比为2 μL mg−1条件下,使用AN3的电池获得844 mAh g−1的可逆容量,相当于活性物质利用率为79%。
即使在极低E/A比为1 μL mg−1的苛刻测试条件下,可逆容量也可达到713 mAh g−1。在考虑正极、正极集流体、负极和电解质的质量条件下,也可以达到370 Wh kg-1的能量密度。当E/A比增加到3 μL mg−1时,稳定循环容量为734 mAh g−1。AN2中的Li-SeS2电池无法在1 μL mg−1的E/A比下完成充电过程。如图4c所示,软包电池中AN3电解质具有662 mAh g−1的高容量,每圈容量衰减率为0.5%,显示了AN3在实际应用中的巨大潜力。
总结与展望
通过在微溶剂化的AN2电解质中引入更多的游离AN分子,成功地调节了以AN为溶剂的电解质的结构和溶剂化行为。新配制的弱溶剂化电解质AN3增加了LPSs/LPSes中间体的溶解度,并促进了Li-SeS2电池的放电-充电反应。此外,在溶解的中间产物的帮助下,在锂负极表面上生成了坚固稳定的SEI层,这保证了Li- SeS2电池的长期循环稳定性。即使在极低E/A比(1 μL mg−1) 和高活性负载/含量(9.5 mg cm−2 72wt%),Li- SeS2电池仍能实现713mAh g-1的高可逆容量。这项工作为开发具有高能量密度和长循环稳定性的Li-S(Se)电池开辟了可能性。
审核编辑:刘清
 电子发烧友App
电子发烧友App

























评论