4.产前DNA 测序(2013)
产前DNA检测已经发展到无创产前基因检测(NIPT)阶段
目前已经可以通过母体外周血提取胎儿游离 DNA(cffDNA),进行筛查疾病
成熟期:已成熟
突破点:通过一小管母亲血液中的胎儿DNA对基因测序
重要性:在胎儿出生前进行基因检测,排除多种基因缺陷病
该领域主要参与者:Illumina、Verinata、Sequenom、Natera、Ariosa、LifeCodexx、卢煜明
提到产前DNA测序就不能不说Illumina和Verinata。2013年1月7号,Illumina——这家世界上最广泛使用的DNA测序仪的生产商以3.5亿美元收购了Verinata公司。而Verinata不过是一家几乎还没有收入的创业公司。吸引Illumina的是Verinata的先进技术:对未出生胎儿进行DNA测序。这项技术可以通过一小管母亲血液中的胎儿DNA而检测唐氏综合症。在以前,唐氏综合症检测意味着要从胎盘或羊水中获取胎儿的细胞,这些方式都具有一定的流产风险。
利用母亲的血液可以获取胎儿基因组信息,一些患者为了了解自己的遗传性疾病或诸如癌症等疾病而接受基因组测序,但是将来人类无需等到发病了才去做测序,在出生时就知道相关的信息。根据中国香港科学家卢煜明的研究,母亲血液中游离的DNA中有15%是来自于胎儿。
通过快速的DNA测序技术,这些片段可以转变为大量的信息,不过后来,Verinata的创始人、斯坦福大学生物物理学家Stephen Quake很快发现,利用母亲血液中的胎儿DNA除了可以筛查染色体异常外,还可以对胎儿进行全基因组测序,这样就可以在胎儿出生前排除患有囊性纤维化(cystic fibrosis)、β-地中海贫血症以及自闭症等风险。而且这项基因检测成本一直在下降。
目前,已经发展到无创产前基因检测(NIPT)阶段,这项技术是通过母体外周血提取胎儿游离 DNA(cffDNA),进行筛查如唐氏综合征,Rh血型,性染色体异常,以及胎儿性别,是测序中竞争最为激烈的领域。无创产前基因检测在全球,尤其是在低收入和中等收入国家逐渐普及。不过产前检测让医生面临的法律与道德义务变得更加复杂,近日卫计委发布了通知,无创产前筛查和诊断试点正式取消,筛查机构必须获得新的职业许可证书。成人可以决定是否对自己的基因组进行测序,而未出生的胎儿是不能对此表示意见的。这些信息可能会影响人的一生。甚至有人提出提供检测的服务商,应该将其报告限制在20种左右最常见的严重疾病中。
5.深度学习(2013)
深度学习技术推动人工智能向前发展的核心力量
为医生提供可供选择的循证治疗方案,已经实现帮助医生做出更好的决策
成熟期:正在使用
重要性:试图模拟大脑的工作方式,提高医疗效率,尤其在肿瘤治疗领域力图实现精准治疗
该领域主要参与者:谷歌、谷歌、苹果、IBM、微软、Facebook、百度等
深度学习是和人工智能的发展深度结合在一起的。其实,深度学习并不是新生事物,它是传统神经网络(Neural Network)的发展。神经网络研究领域的领军者Hinton在2006年提出了神经网络深度学习算法,使神经网络的能力大大提高,向支持向量机发出挑战。Hinton和他的学生Salakhutdinov在顶尖学术刊物《Scince》上发表了一篇文章,开启了深度学习的篇章。
深度学习的核心就是算法,算法模型也经历了一个快速迭代的周期,Deep Belief Network、Sparse Coding、Recursive Neural Network, Convolutional Neural Network等各种新的算法模型被不断提出,而其中卷积神经网络(Convolutional Neural Network,CNN)更是成为图像识别最炙手可热的算法模型。目前已经在语音识别、图像识别等应用非常广泛。
在医学领域,以深度学习为基础的人工智能,从学习在丰富的医学数据中识别复杂模式的算法,到为个性化医疗提供对现实世界证据的分析,再到发现与 DNA 结合的蛋白质的序列特异性和怎样用其协助基因组诊断以及个性化治疗,在医学成像上可提高分辨率、分析的广度和速度以及诊断上带来了非常了不起的进步,甚至在药物开发和更广泛的治疗干预上显示出了巨大的潜力。
尤其是谷歌,已经成了吸引深度学习和人工智能人才的磁铁。2013 年 3 月,谷歌收购了一家创业企业,它的创始人是多伦多大学的计算机科学教授杰弗里·辛顿——是赢得默克比赛的团队成员。辛顿会同时兼顾大学和谷歌的工作,他说计划“在这一领域中提出构想,然后把它们用在真正的问题上“,这些问题包括图像识别、搜索,和自然语言理解。
2012年6月,谷歌展示了当时最大的神经网络之一,其中拥有超过10亿个连接。由斯坦福大学计算机科学教授吴恩达和谷歌研究员杰夫·迪安带领的团队,给系统展示了一千万张从YouTubu视频中随机选择的图片。软件模型中的一个模拟神经元专门识别猫的图像,其他专注于人脸、黄色的花朵,以及其他物体。由于深度学习的能力,即使没人曾经定义或标记过,系统也识别了这些独立的对象。IBM的沃森在肿瘤精准治疗领域,能够在几秒之内筛选数十年癌症治疗历史中的150万份患者记录,包括病历和患者治疗结果,并为医生提供可供选择的循证治疗方案,已经实现帮助医生做出更好的决策。
在2011年到2015年的五年时间,人工智能领域的并购资金从2.82亿美元增长到2015年的23.88亿美元,而并购数量也从67起增长到397起。以谷歌、苹果、IBM、微软、Facebook为代表的等行业巨头正在通过并购进行产业布局。
6.基因组编辑(2014)

CRISPR的工作流程,创新性地利用RNA
通过基因编辑携带定向突变的灵长类动物的能力,为科学家研究与遗传相关的疾病提供方法
成熟期:进入到诊断
突破点: 利用基因组工具构建出两只携带有特定基因突变的猴子
重要性:为人类疾病研究提供了新的有价值的工具
该领域主要参与者:云南省灵长类生物医学重点实验室,Jennifer Doudna(加州大学伯克利分校),张峰(麻省理工学院),George Church(哈佛大学)
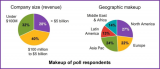
科学家们认为,CRISPR可能是自20世纪70年代生物技术时代开启以来出现的最重要的基因工程技术。CRISPR系统具有搜索和替换DNA的双重功能,可以让科学们通过替换碱基,轻松的改变DNA的功能。目前已经证实,利用CRISPR可以治疗小鼠的肌肉萎缩、罕见肝脏疾病,使人类细胞免疫HIV等惊人的功能。在资本市场上,都是千万美元级别的投资。Emmanuelle Charpentier在欧洲创立了CRISPR Therapeutics。Jennifer Doudna之前与张锋共同创立了Editas Medicine,离开Editas Medicine后她现在创立了一家小公司Caribou Biosciences。
CRISPR/Cas是在大多数细菌和古细菌中发现的一种天然免疫系统,可用来对抗入侵的病毒及外源DNA。最先试验的是一对出生在昆明科灵生物科技有限公司(Kunming Biomedical International)和云南灵长类动物生物医学研究重点实验室里雌性双胞胎恒河猴明明和玲玲。在体外受精后,科学家用了新型DNA工程技术CRISPR在受精卵中编辑修改了3个基因。标志着CRISPR可以在灵长动物体内完成靶向遗传修饰。在过去几年,CRISPR由加州大学伯克利分校、哈佛大学、麻省理工学院等机构的研究人员研发出来。这项技术已经开始转变科学家对遗传工程的理解,因为它可以让他们精确并相对轻松地改变基因组。
CRISPR可以精确并相对容易地,在染色体上的某个特定部位改变DNA,理论上,这项技术可以在培养皿中改变任何动物细胞类型的基因,包括人类细胞。CRISPR与早期的基因组编辑方法:锌指核酸酶(ZFN)以及转录激活因子样效应物核酸酶(TALEN)系统相似。但是后两种方法都是利用蛋 白质来定位靶序列,这些蛋白质通常很难生成且成本高昂。CRISPR利用的是RNA,使得设计它们变得较为容易。
某个基因变异的重要性通常并不明确,它很可能会致病,也可能仅仅和某种疾病间接相关,CRISPR可以帮助研究人员找到确实能致病的突变。在究竟谁该拥有CRISPR专利问题上,虽然还有争议,人们普遍认为是Charpentier和Doudna推动了CRISPR编辑的发展,张峰则是通过证实它能够在真核细胞中起作用揭示了它的巨大潜力,来自哈佛医学院的George Church独立证实了张锋的这一研究发现。
CRISPR未来最有潜力的应用是,修复人类组织中的基因,可以治疗诸如血友病、罕见代谢疾病、亨廷顿氏病和精神分裂症等基因疾病。随着对CRISPR系统认识的加深,实验设计的优化改造,相信其靶向效率会进一步提高,CRISPR以及其衍生技术终究会带来一场科学史上的巨大变革。
7.大脑成像图(2014)
清晰的大脑成像图让神经科学家更完整深入地观察大脑结构
极为精细的大脑成像图,第一次在细胞水平上剖析了人类大脑,为神经科学家提供了解读其无穷复杂性的指南
成熟期:尚未完全成熟
突破点:高分辨率,以20微米的尺度展现了人类大脑的结构
重要性:能够让神经科学家更完整深入地观察大脑结构,了解大脑不同区域之间的相互作用,脑结构及其对人行为的控制
该领域主要参与者:Katrin Amunts(德国尤利希研究中心),Alan Evans(蒙特利尔神经学研究所),Karl Deisseroth(斯坦福大学)、圣路易斯华盛顿大学
人脑一直是个神秘地带,人类也一直试图了解人脑的全部,“欧洲人脑计划”(提出在巨型计算机上对人脑建模)、“美国脑计划”(要从多个维度获取大脑活动数据并对此建模)这些雄心勃勃的计划,都在尝试创建一个广泛的大脑活动的图片。
大脑图谱的早期工作应该要归功于神经解剖学家们,其中最有名的应该是布鲁德曼(Korbinian Brodmann)在20世纪初的工作。在此之前,关于大脑的不同区域负责不同功能的观点已经随着颅相学的流行而兴起,在布洛卡(Broca)等脑区的功能而得到强化。然而,布鲁德曼关注于脑区的细胞构筑,未从3D空间来建立大脑的模型。3D大脑模型的出现,得益于法国神经解剖学家Jean Talairach,他在于1967年提出一个3D的大脑模型,与Tounoux 于1988年进一步完善此大脑模型。
目前最通用的模板,是加拿大蒙特利尔神经研究所(Montreal Neurological Institute,MNI)于90年代表所建立的MNI系列模板。在最早的尝试中,他们扫描了241个正常志愿者的大脑结构,按照Talairach大脑图谱的方式,使用标志性的大脑结构对每个受试者的大脑进行标定,得到每个大脑的AC-PC线和大脑的外部轮廓。目前使用更为广泛的是ICBM152模板,也是由MNI出品,然而MNI305和ICBM152模板中无法清楚地看到每个大脑的结构。
在德国尤利希研究中心与MNI共同完成的“Bigbrain”项目中,建立了第一个细胞级别的超高分辨率的大脑3D模型:由7404个组织切片组成的,分辨率达到20微米,几乎精确到了分子级别。这个花了十年的地图集,在超级计算机的帮助下将它们数字化缝合在一起,超清晰3D大脑模型的建立,有望为今后神经成像提供一个更加标准的大脑图谱,也为今后建立标准3D大脑模型提供了新的途径。
清晰的大脑成像图得益于技术的创新,比如德国尤利希研究中心的Amunts正在开发一种这样的技术,使用偏振光来重建脑组织中的神经纤维的三维结构。在斯坦福大学的神经科学家和生物工程师Karl Deisseroth的实验室开发了一种名为Clarity的技术,允许科学家直接看到完整脑中神经元和电路的结构。今年7月,美国圣路易斯华盛顿大学的一个研究小组称,他们绘制出迄今最全面、最精确的人类大脑图谱,其中97个人类大脑皮层区域此前从未描述过,属于首次公布。
下篇:《麻省理工科技评论评选的14大医疗领域突破科技(下)》
 电子发烧友App
电子发烧友App






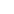
























评论